功能连接偏侧化在AD早期诊断中的应用研究
2018-03-23武旭斌
武旭斌,相 洁
(太原理工大学 现代科技学院,太原 030024)
AD俗称为老年痴呆症,潜伏期长不易被发现,且病变严重,损害不可逆,是一种严重威胁老年人健康的神经类疾病,如果没有积极治疗,患者用不了几年就会从最初较轻度的短期记忆丧失症状,发展到较为严重的完全失忆。
目前较为广泛的研究使用了MRI(magnetic resonance imaging)结构像,DTI(diffusion tensor imaging)等研究方案。这类方法的原理是如果病人疾病恶化,将伴随着脑部的形态变化,这类变化借助影像研究易于被发现。BEHESHTI et al利用结构像,提取了被试者的灰质相似矩阵作为特征,使AD、正常组的分类准确率到达了84.07%[1].TANG et al使用T1加权像以及DTI像调查了海马和杏仁核的形状差异和各向异性分数值,并将其作为特征,使AD与正常人的区分准确率达到了96.4%[2].而在最新的利用功能像进行疾病辅助诊断方面,CHEN et al在一组数据集上将全脑的116个脑区的功能连接作为特征,使得AD、非AD这两组被试的分类准确率提高到了82%,之后去除AD被试,又将所剩下的NC,MCI被试的分类准确率提高到了91%[3]。
综合起来,基于结构像和DTI技术的分类效果较好,部分研究分类准确率已经达到了较高水平,但是这种方法一般需要等到疾病晚期,大脑结构有明显萎缩时才能识别疾病,这是其一大缺点。而以探索血氧含量变化的功能像分析,可以很好地揭示包含在影像信息中的生理意义,具有较高的应用价值。使用功能像分析大脑疾病早期的功能变化,而不需要等到大脑结构的改变,这为早期疾病的辅助诊断提供了可能。而基于功能像的研究中,目前诊断准确率还有待提高,因此找到一种AD病人的功能异常指标将是进一步研究的重点。
大脑的左右半球存在结构和功能上的不一致,这种现象称为大脑的偏侧化现象。其中功能方面,通常语言功能表现出明显的左半球优势,而认知控制等功能则体现出右半球优势[4]。计算脑网络中的偏侧化指数(laterality index,LI),能使偏侧化这一现象量化,从而更好地服务于其他研究工作[5]。已经有研究表明痴呆病人与正常人相比,大脑偏侧化现象存在明显的变化过程[6]。因此本文拟将偏侧化指数这一量化的指标作为特征进行分类,旨在提高分类准确率,更好地服务于疾病诊断。
1 方法
1.1 研究对象
本实验数据取自ADNI的公开数据集,ADNI全称为阿尔茨海默病症神经影像学倡导团体(alzheimer's disease neuroimaging initiative,ADNI),网址(http://adni.loni.usc.edu/)。其中AD患者72人,正常老年人(NC)85人。年龄范围从43.2岁至87.6岁,具体信息如表1所示。
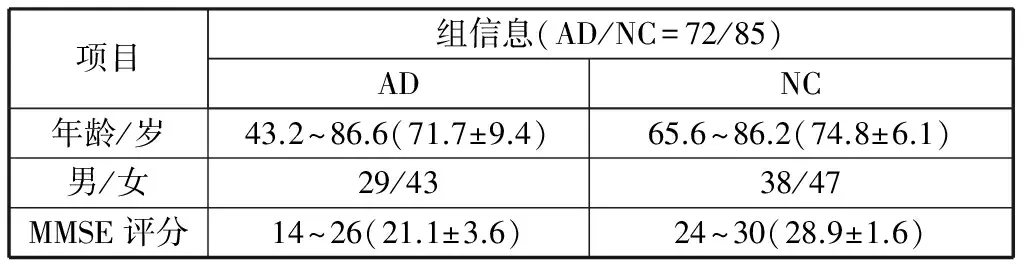
表1 被试信息表Table 1 Test information table
1.2 数据采集
受试者在平静闭眼的状态下完成数据采集,扫描间隔为3.3 s,共扫48层,采用升序隔层扫描,共140个时间节点。
1.3 制作对称模版
制作对称的T1像模版用于空间标准化,以消除由于标准化模版不对称而造成的偏侧化差异。首先将T1像模版进行翻转,然后将原图像和翻转后的图像取平均,制作成为新的对称T1像模版。
为了进一步探索大脑不同脑区的联系,且消除现有脑模版的不对称所带来的偏侧化影响,实验制作了对称脑模版。实验选用被广泛使用的AAL(anatomical automatic labeling,AAL)脑模版,将左右脑区翻转,并取交集,分别得到两个对称一致的脑区节点,再迭加形成最终90个对称脑区。
1.4 数据预处理
实验基于data processing assistant for resting-state fMRI(DPARSF v2.3)工具,在Matlab2009b上对图像进行预处理。针对每例数据的预处理流程为:a) 去除前10个时间点采集的图像数据;b) 以中间层为参考进行时间层校正;c) 头动校正;d) 去除6个头动参数、全脑平均信号、白质信号和脑脊液信号等协变量;e) 基于对称T1像模板进行空间标准化,重采样体素大小为3 mm×3 mm×3 mm;f) 空间平滑,高斯核半宽全高为4 mm×4 mm×4 mm;g) 低频滤波。带通滤波的范围为:低频截至频率0.01 Hz,高频截至频率0.08 Hz。
1.5 构建半球网络
借鉴之前半球网络在正常被试大脑上的构建方法[7],本实验将预处理之后的图像利用对称AAL模版提取时间序列,得到时间点乘以脑区数的文件。由于本实验研究左右半球各自的特性,故将1-89编号的左半球数据和2-90编号的右半球数据分别提取,各得到时间节点数乘以45的文件。详细流程如图1所示。
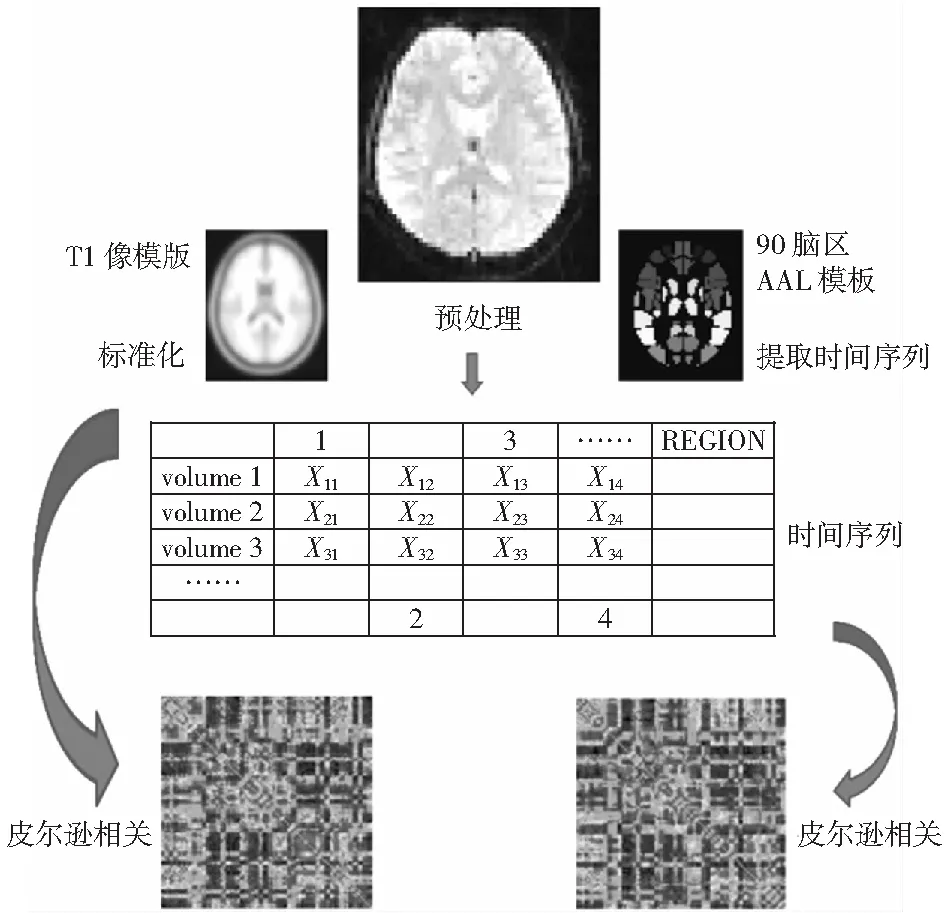
图1 网络构建过程Fig.1 Process of network construction
1.6 功能连接强度及其偏侧化
为了对比之前文献中的方法,首先计算之前文献常用的功能连接强度。本实验采用常用的皮尔逊相关(pearson correlation)方法,计算左右半球的功能连接强度,得到功能连接网络矩阵。
偏侧化指数最早由ITURRIA使用在结构脑网络矩阵的计算中[8],计算公式如下:
这里将其移植到功能脑网络的连接强度矩阵中。其中,x(l)代表左脑指标的值,x(r)代表右脑指标的值。AS值为正代表左脑偏侧化,AS值为负代表右脑偏侧化。
1.7 特征选择
本研究采用单变量特征选择方法中的统计分析法,具有科学、精确以及客观等特点,在脑疾病研究中被广泛应用。
将上一步所得功能连接强度矩阵进行Fisher-Z变换,使之服从正态分布。针对两组被试左右半球的功能连接强度矩阵,分别进行左右半球不同组间的双样本t检验。阈值选取P值小于0.001,得到两类被试具有显著连接强度差异的脑区。
运用上一步偏侧化指数计算公式,计算功能连接强度矩阵的偏侧化指数,进行双样本t检验。阈值选取P值小于0.05,得到两类被试具有偏侧化指数显著差异的脑区。
1.8 分类
本实验侧重于特征选择,对于分类器并未进行过多优化,研究选择支持向量机分类模型。根据大量已有文献显示,SVM分类器对于生物信息研究具有优势[9]。在SVM分类器的参数中,本实验选取线性核函数,使用默认参数。首先,对于类别多的问题,当特征数较多时,时间消耗就成为必要的考虑因素,而线性核函数在此方面恰具有一定优势。其二,SVM线性分类器恰能弥补在生物信息研究中,样本数量较少的问题[10]。实验采用留一交叉验证,虽然其算法繁琐,但样本利用率最高,适合于小样本的情况。为了对比特征选择效果,实验首先只将功能连接强度作为特征进行分类,其次加入偏侧化指数特征后,再进行分类。
2 结果
2.1 左右脑功能连接强度差异特征
AD与NC的比较差异如表2所示。T值为正代表AD大于NC。阈值选取为P<0.001.特征数为39个。
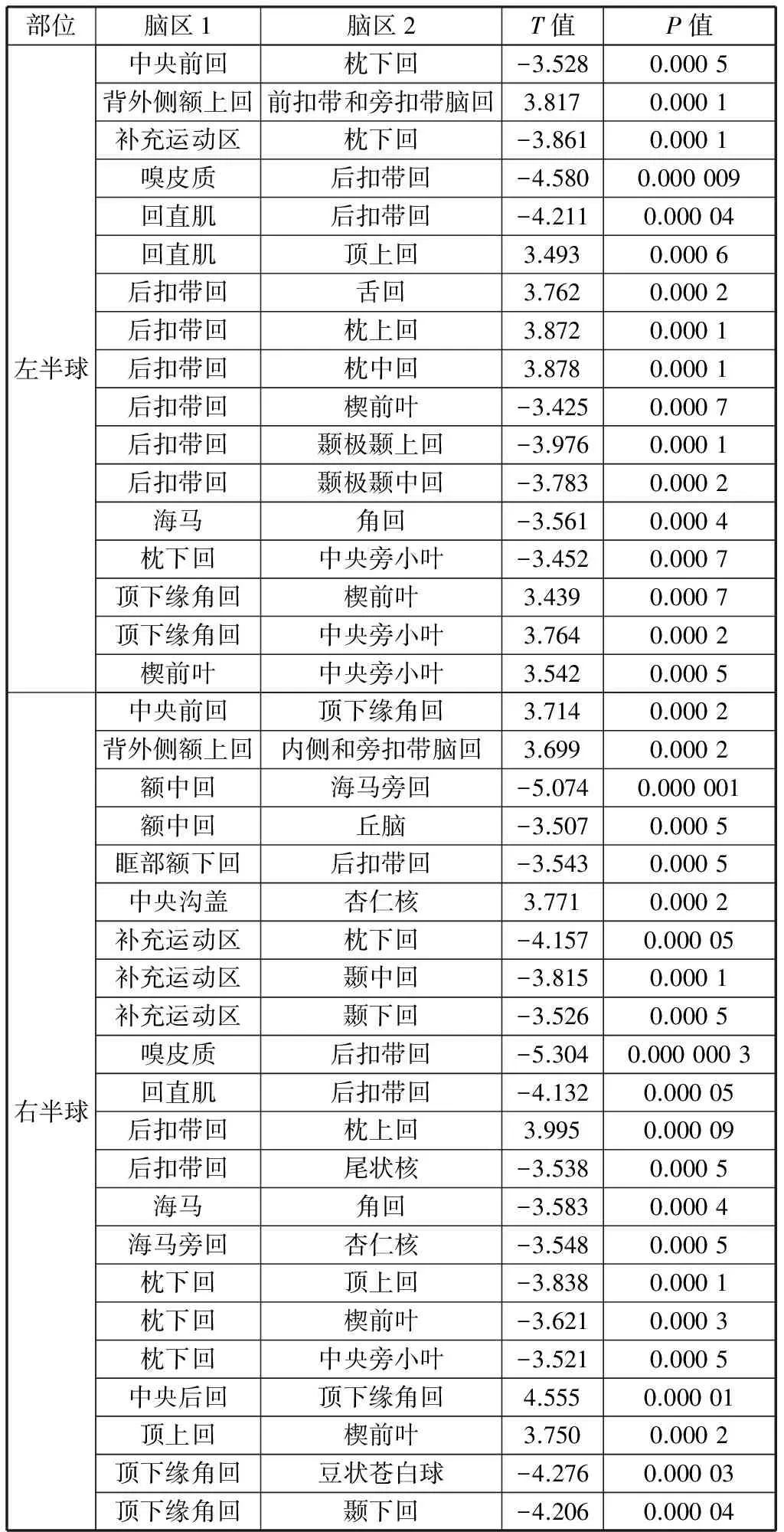
表2 AD,NC功能比较差异Table 2 Differences on functional connectivity between AD and NC
2.2 功能连接偏侧化差异特征
实验计算了两组被试间功能连接强度的偏侧化差异,如表3所示。阈值选取为P小于0.05.特征数为25个。
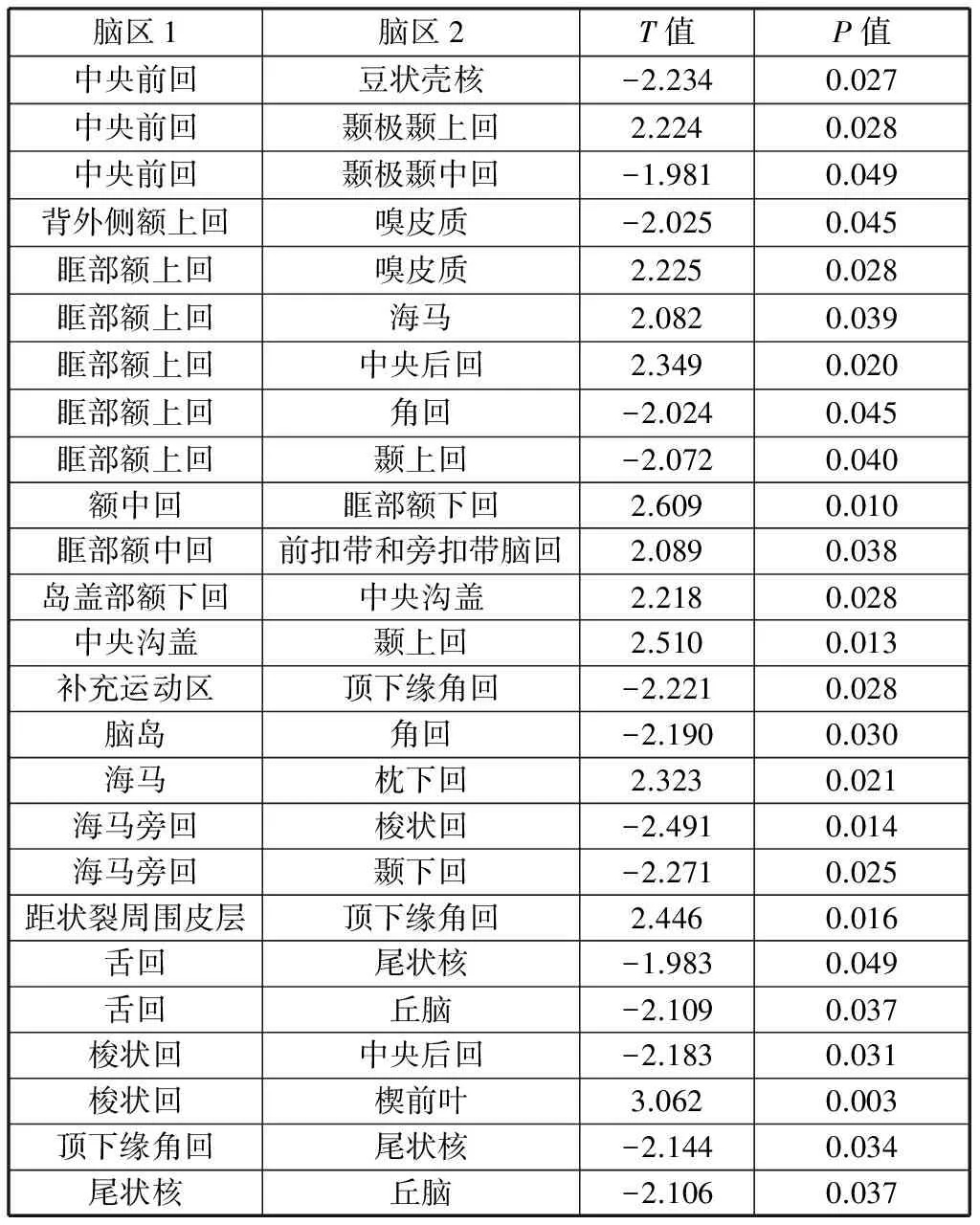
表3 AD,NC功能连接差异Table 3 Differences on laterality index of functional connectivity between AD and NC
2.3 分类结果
由于本文使用二分类,评价二分类的指标常用的是受试者工作特征曲线(receiver operating characteristic curve,ROC)。图2、3中灵敏度是实际有病而且被正确诊断出来的概率。特异度就是实际没病而且被正确诊断的概率。AUC即ROC曲线的曲线下面积,最靠近左上角的曲线,此曲线即代表分类效果最佳的方案。
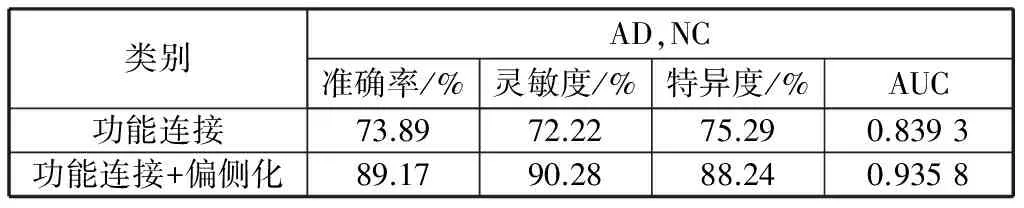
首先,将功能连接强度作为特征进行分类,结果如图2所示。其次,加入偏侧化指数后进行分类,结果如图3所示。最后,比较两种特征下的分类各项指标,如表4所示。
3 讨论
3.1 所选特征的生理意义分析
通过研究分析,可以看到一些出现频率较高的异常连接脑区,如海马、海马旁回、内嗅皮质、杏仁核、梭状回、颞中回、楔前叶、扣带回(包括后扣带回)、额中回、回直肌等。其中,海马、海马旁回、内嗅皮质负责记忆功能。杏仁核具有情绪、学习和记忆功能。梭状回负责视觉认知,颞中回有阅读,注视距离功能。楔前叶主要负责意识、认知、情景记忆。扣带回(后扣带回)负责行为、认知、情绪调节。额中回负责情感、语言、工作记忆。回直肌负责情绪、情感和内脏活动。根据已有文献表明,这些脑区都是AD与正常人相比高度病变的脑区[11]。

图2 以功能连接强度为特征的分类准确率Fig.2 Classification accuracy used functional connectivity
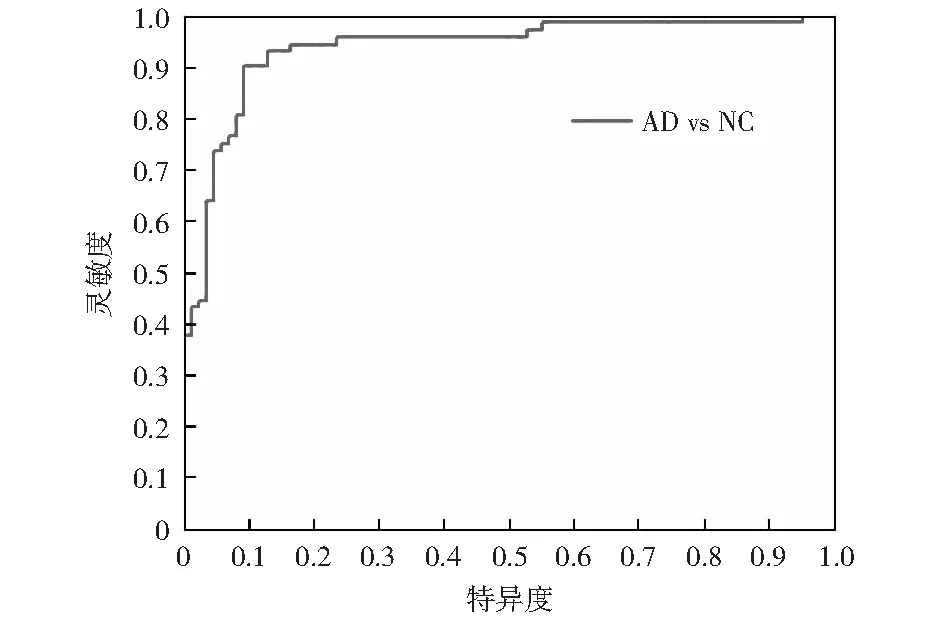
图3 以功能连接强度及其偏侧化指数为特征的分类准确率Fig.3 Classification accuracy used functional connectivity and its laterality index
类别AD,NC准确率/%灵敏度/%特异度/%AUC功能连接73.8972.2275.290.8393功能连接+偏侧化89.1790.2888.240.9358
有研究通过选取种子区域,考察种子区域与其他脑区的功能连接。WANG et al通过功能连接分析发现,与NC相比,AD组的右侧海马、双侧楔叶及后扣带回等区域的功能连接显著减低[12]。本实验与该结论一致。随后,又有研究者在全脑水平下,对AD患者进行了脑区间功能连接的相关性研究分析后发现,相比于正常对照组,AD患者的前额叶和顶叶间的相关性下降,在顶叶和枕叶等脑区的相关性上升[13]。本实验结果同样印证了这一观点。通过功能连接的结果可以看出,不同被试者右侧半球的连接要明显多于左侧半球的连接。正如DONALD在2012年通过对默认模式网络的研究发现,右侧结构半球可能是导致痴呆症的核心区域所在[14]。而本实验的结论在静息态功能脑网络方面与此结论相同。
功能连接的偏侧化指数检验仅能表示组间差异,这里关注功能连接出现偏侧化差异的脑区。本研究同时发现,AD,NC的眶部额上回与海马,以及枕下回与海马之间的连接出现差异,正如PEREIRA 2010年的发现,左侧海马的硬化,会导致更多的功能连接减弱[15],因为左侧的变化,将导致偏侧化产生变化。
3.2 分类效果比较
在基于静息态fMRI的分类研究中,通常使用的方法是借助功能连接强度作为特征。本研究同样使用了这种特征。在使用功能连接强度作为特征的分类实验中,AD,NC的准确率为73.89%,而加入功能连接强度的偏侧化指数后,准确率提高到了89.17%,结果表明,功能连接强度的偏侧化指数的加入对分类效果有提高。
在最新的利用功能像进行疾病辅助诊断方面,CHEN et al在一组数据集上利用AAL模版将全脑的116个脑区作为感兴趣区,将其功能连接作为特征,使得AD,非AD这两组被试的分类准确率提高到了82%[3],本实验仿照其方法,在半球网络上加入偏侧化指数后,使得准确率达到了89.17%,提升效果较为明显,同时达到了在基于功能像的研究中较为良好的准确率。
4 结论
随着越来越多的人老龄化,患有AD病症的人也越来越多,但是目前的医疗水平及手段还不能将这种神经退化性疾病完全治愈。如果我们对其能尽早的进行诊断并相应的进行药物干预,可以大大减缓AD的病情危害。如何找到新的具有实际医学意义的指标,使得病人与正常人的辅助诊断效率提升,是目前研究急需攻克的一个问题。
通过对AD研究现状的分析,发现许多研究人员的研究诊断方法中,有些运用大脑结构的变化区分被试类型,这种方法显然与尽早发现疾病的初衷不符。还有研究运用复杂庞大的特征信息进行分类研究,虽得到了很好的效果,但显然费时费力。
本课题提出了偏侧化这一指标作为特征,旨在为分类准确率提供贡献。提取被试者的功能连接,功能连接的偏侧化进行探索,通过统计分析得到了显著差异的特征,并且分析了选用这些特征时实际的生理意义。实验证明该指标有助于在传统方法上提高准确率。
[1] BEHESHTI I,DEMIREL H,MATSUDA H,et al.Classification of Alzheimer's disease and prediction of mild cognitive impairment-to-Alzheimer's conversion from structural magnetic resource imaging using feature ranking and a genetic algorithm[J].Comput Biol Med,2017,83:109-119.
[2] TANG X,QIN Y,WU J,et al.Shape and diffusion tensor imaging based integrative analysis of the hippocampus and the amygdala in Alzheimer's disease[J].Magn Reson Imaging,2016,34(8):1087-1099.
[3] CHEN G,WARD B D,XIE C,et al.Classification of Alzheimer disease,mild cognitive impairment,and normal cognitive status with large-scale network analysis based on resting-state functional MR imaging[J].Radiology,2011,259(1):213-221.
[4] TOGA A W,THOMPSON P M.Mapping brain asymmetry[J].Nature Reviews Neuroscience,2003,4(1):37-48.
[5] RATNARAJAH N,RIFKIN-GRABOI A,FORTIER M V,et al.Structural connectivity asymmetry in the neonatal brain[J].Neuroimage,2013,75:187-194.
[6] KIM J H,LEE J W,KIM G H,et al.Cortical asymmetries in normal,mild cognitive impairment,and Alzheimer's disease[J].Neurobiology of Aging,2012,33(9):1959-1966.
[7] TIAN L,WANG J,YAN C,et al.Hemisphere-and gender-related differences in small-world brain networks:a resting-state functional MRI study[J].Neuroimage,2011,54(1):191-202.
[8] ITURRIA-MEDINA Y,FERNNDEZ A P,MORRIS D M,et al.Brain hemispheric structural efficiency and interconnectivity rightward asymmetry in human and nonhuman primates[J].Cerebral Cortex,2011,21(1):56-67.
[9] YANG Z R.Biological applications of support vector machines[J].Briefings in Bioinformatics,2004,5(4):328-338.
[10] BEN-HUR A,WESTON J.A user's guide to support vector machines[J].Data Mining Techniques for the Life Sciences,2010:223-239.
[11] 齐志刚,李坤成.阿尔茨海默病的神经影像学诊断进展[J].国际医学放射学杂志,2008,31(5):329-333.
QI Z G,LI K C.Advance of diagnostic neuroimaging in alzheiimer's disease[J].International Journal of Medical Radiology,2008,31(5):329-333.
[12] WANG L,ZANG Y,HE Y,et al.Changes in hippocampal connectivity in the early stages of Alzheimer's disease:evidence from resting state fMRI[J].Neuroimage,2006,31(2):496-504.
[13] WANG K,LIANG M,WANG L,et al.Altered functional connectivity in early Alzheimer's disease:a resting-state fMRI study[J].Human Brain Mapping,2007,28(10):967-978.
[14] ROYALL D R,PALMER R F,VIDONI E D,et al.The default mode network and related right hemisphere structures may be the key substrates of dementia[J].J Alzheimers Dis,2012,32(2):467-478.
[15] PEREIRA F R,ALESSIO A,SERCHELI M S,et al.Asymmetrical hippocampal connectivity in mesial temporal lobe epilepsy:evidence from resting state fMRI[J].BMC Neuroscience,2010,11(1):66.
