电针耳穴通过SIRT1/PGC-1α途径延缓D-半乳糖致衰老豚鼠听皮层老化△
2018-03-23帅常娟刘淑云姚宇杨烨殷泽登
帅常娟 刘淑云 姚宇 杨烨 殷泽登
氧化应激是细胞氧化-抗氧化失衡而导致的应激损伤状态,研究证实氧化应激是导致老化的重要原因之一[1~3]。沉默信息调节因子1(silent information regulator1, SIRT1)是烟酰胺腺嘌呤二核苷依赖的蛋白脱乙酰化酶,可通过脱乙酰化激活过氧化物酶体增殖物激活受体γ 辅激活因子1α (peroxisome proliferators-activated receptor-γ coactivator 1α, PGC-1α)等底物调节细胞内氧化应激状态,从而保护细胞免受氧化应激损伤[4~7]。PGC-1α是近年来发现的在抗氧化应激系统中起关键作用的转录调节因子,能够诱导细胞抗氧化酶的表达,提高组织抗氧化能力[8]。前期研究发现听觉中枢老化可能与超氧化物歧化酶(superoxide dismutase, SOD)活性降低所导致的抗氧化功能下降有关,电针“听宫”和“翳风”两个穴位可提高SOD活性,能在一定程度上抑制D-半乳糖所致的豚鼠听觉中枢的老化过程[9],但有关通过电针耳穴提高听觉中枢抗氧化能力的分子信号转导途径尚不清楚。研究表明,SIRT1/PGC-1α途径参与年龄相关性骨骼肌老化萎缩和听力损失过程[10~12]。本研究拟从mRNA水平和蛋白水平检测D-半乳糖致年龄相关性聋豚鼠听皮层SIRT1、PGC-1α表达,并观察电针“听宫”穴和“翳风”穴对其表达的影响,探讨SIRT1/PGC-1α 途径在年龄相关性聋豚鼠听皮层老化过程中的作用以及电针耳穴是否通过SIRT1/PGC-1α途径调节听皮层的老化过程。
1 材料与方法
1.1实验动物及分组 选取耳廓反射灵敏、无噪声暴露及耳毒性药物使用史的4月龄豚鼠30只(体重230~400 g),随机分为对照组、D-半乳糖模型组(简称模型组)、D-半乳糖模型+电针组(简称电针组),每组10只;以18月龄豚鼠10只(体重500~700 g)为老年组。豚鼠均由西南医科大学实验动物中心提供。
1.2实验方法
1.2.1D-半乳糖致年龄相关性聋豚鼠造模 参照李君梅等建立的方法[9],模型组及电针组豚鼠颈背部皮下注射D-半乳糖300 mg·kg-1·d-1,对照组予以注射等量生理盐水,每天1次,连续6周。老年组豚鼠常规饲养,不作任何处理。在饲养过程中,仔细观察各组动物的外观及表现。
1.2.2电针方法 清醒状态下,电针组豚鼠固定后取双侧“听宫”穴和“翳风”穴[13, 14],用HM6805-I型经穴治疗仪(HM6805-I型,1100801072,四川恒明科技开发有限公司)刺激,疏密波,频率14 Hz,强度0.4~0.6 mA,连续输出,9次/秒,持续刺激15 min,每天一次,连续6周。刺激强度以针刺附近豚鼠耳廓颤动,四肢轻抖动但不挣扎嘶叫为度[15]。
1.2.3ABR检测 采用Kong等[16]建立的方法进行ABR检测。豚鼠造模及电针结束后,2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,麻醉满意后置于隔声屏蔽室内,环境温度(25±3) ℃,应用听觉脑干诱发电位仪(Intelligent Hearing Systems, 美国)测试。记录电极置于颅顶,参考电极置于双侧耳廓背面,接地电极置于鼻尖。刺激声为短声,双耳同时刺激、记录,声刺激强度从100 dB SPL 开始,扫描时间25 μs,叠加次数为1 024次,刺激间隔19.30次/秒,最大刺激强度为132 dB SPL,刺激强度按10 dB递减,接近阈值时,按5 dB递减,记录各组ABR反应阈。
1.2.4动物听皮层取材 ABR测试完成后,动物麻醉未醒前,迅速断头,暴露颅腔,参照Schofield等[17]的方法对双侧听皮层解剖定位后于无菌台上取出,立即用4 ℃生理盐水洗净血迹后冻存于-80 ℃冰箱。
1.2.5实时荧光定量PCR检测听皮层SIRT1、PGC-1α mRNA的表达 听皮层于液氮中研磨后,按照离心柱型RNA提取分离试剂盒(DP419, 北京天根生化科技有限公司,中国)的步骤提取总RNA。用分光光度计(ND-100, NanoDrop公司, 美国)测定总RNA的浓度和纯度,并通过电泳鉴定其完整性。按逆转录试剂盒(FSQ-201, TOYOBO, 日本)说明,以所提取的RNA为模版逆转录得到cDNA,PCR扩增。参考Khan-Malek等[18]的方法对PCR结果进行统计分析。PCR引物相关信息见表1。

表1 实时荧光定量PCR引物相关信息
1.2.6Western Blot法检测豚鼠听皮层组织SIRT1、PGC-1α蛋白表达 蛋白提取后,采用BCA法测定蛋白含量。4%浓缩胶和10%分离胶分离蛋白质样品,浓缩胶电压80 V,分离胶电压120 V;采用湿转法转膜,脱脂牛奶进行封闭,SIRT1蛋白一抗(9475s, 上海优宁维科技股份有限公司, 中国)、PGC-1α蛋白一抗(ab54481, 上海复申生物科技有限公司, 中国)和内参一抗(β-actin)4 ℃冰箱中孵育过夜,二抗(bs-0295G-HRP, 北京博奥森生物技术有限公司, 中国)置于脱色摇床上低速震荡室温孵育1 h。底物发光,凝胶成像系统成像拍照。使用Quantity one凝胶成像系统分析条带的灰度值,为避免人为因素的误差,采用目的蛋白与相应内参灰度的比值作为蛋白的相对表达量,进行半定量检测,并进行统计分析。
1.3统计学方法 采用SPSS17.0软件进行数据分析,结果以均数±标准差表示,应用单因素方差分析,方差齐时,组间比较采用LSD检验。
2 结果
2.1各组豚鼠ABR阈值 对照组、模型组、电针组和老年组的ABR阈值分别为:35.75±4.66、74.5±5.59、44.4±7.92和76.5±7.8 dB SPL。与对照组比较,模型组和老年组ABR阈值升高(P模型组<0.00 1;P老年组<0.00 1);与模型组和老年组相比,电针组ABR阈值降低(P<0.00 1);模型组与老年组相比,差异无统计学意义(P=0.344)。
2.2豚鼠听皮层STR1/PGC-1α mRNA表达 各组豚鼠听皮层SIRT1/PGC-1α mRNA相对表达量见表2。与对照组比较,老年组和模型组SIRT1、PGC-1α mRNA表达降低(P老年组SIRT1=0.02;P老年组PGC-1α<0.00 1;P模型组SIRT1=0.01;P模型组PGC-1α<0.00 1);与模型组比较,电针组SIRT1、PGC-1α mRNA表达增加(P电针组SIRT1=0.011,P电针组PGC-1α<0.00 1);与老年组相比较,电针组SIRT1、PGC-1α mRNA表达增加(P电针组SIRT1=0.016;P电针组PGC-1α<0.001);模型组和老年组相比较,差异无统计学意义(PPGC-1α=0.536;PSIRT1=0.814)。
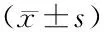
表2 各组豚鼠听皮层SIRT1、PGC-1α mRNA相对表达量
注:★与对照组比较;◆与模型组比较;△与老年组比较,P<0.01
2.3豚鼠听皮层SIRT1/PGC-1α蛋白表达
各组豚鼠听皮层SIRT1、PGC-1α蛋白表达变化见表3、图1、2。与对照组比较,老年组和模型组SIRT1、PGC-1α蛋白水平降低(P老年组SIRT1<0.001;P老年组PGC-1α<0.001;P模型组SIRT1<0.001;P模型组PGC-1α<0.001);与模型组比较,电针组SIRT1、PGC-1α蛋白表达增加(P电针组SIRT1<0.001,P电针组PGC-1α<0.001);与老年组相比较,电针组SIRT1、PGC-1α 蛋白表达增加(P电针组SIRT1<0.001;P电针组PGC-1α<0.001);模型组和老年组相比较,差异无统计学意义(PPGC-1α=0.753;PSIRT1=0.282)。
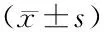
表3 听皮层SIRT1、PGC-1α蛋白表达相对灰度值
注:▲与对照组比较;●与模型组比较;*与老年组比较,P<0.01
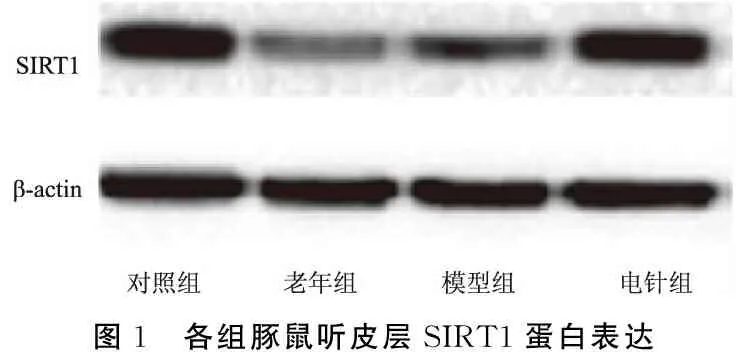
图1 各组豚鼠听皮层SIRT1蛋白表达
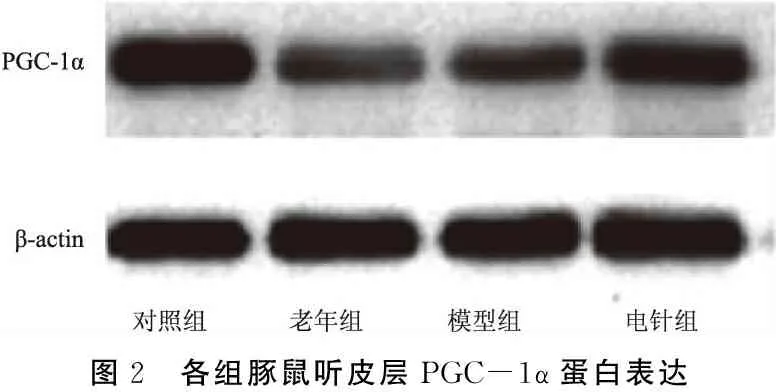
图2 各组豚鼠听皮层PGC-1α蛋白表达
3 讨论
3.1SIRT1/PGC-1α途径在年龄相关性聋豚鼠听皮层老化中的作用
应用D-半乳糖用于年龄相关性聋动物造模具有造模简单、周期相对较短的优势,现已广泛用于衰老相关的实验研究[19]。前期研究发现,应用D-半乳糖造模的年龄相关性聋豚鼠可表现出与自然衰老豚鼠相一致的听力下降,机体氧化损伤加重,抗氧化酶活性降低,听觉中枢老化[9,15,20]。本研究显示,模型组豚鼠与对照组相比ABR反应阈增高,但与老年组相比,无明显差异,提示D-半乳糖致年龄相关性聋豚鼠模型构建成功。
前期研究发现,听皮层的老化可能与SOD活性降低所导致的抗氧化功能下降有关[9],但其具体机制目前尚不清楚。近年来有研究表明,SIRT1/ PGC-1α信号途径在氧化应激时,可促进抗氧化酶类表达增加,发挥抗氧化应激作用[21,22]。Di Emidio等[23]研究发现SIRT1的下游因子锰超氧化物歧化酶(Mn-SOD)是位于线粒体中的关键抗氧化酶,过表达SIRT1可通过上调Mn-SOD保护小鼠卵母细胞免受氧化应激损伤。本研究结果显示,与对照组相比,模型组和老年组豚鼠听皮层SIRT1和PGC-1α在mRNA水平及蛋白水平的表达均显著下调,说明SIRT1下调可能参与D-半乳糖致年龄相关性聋豚鼠的听皮层老化。Xue等[24]研究发现,老年C57BL/6小鼠耳蜗毛细胞的凋亡与SIRT1和PGC-1α的表达降低有关,过表达SIRT1显著增加了耳蜗毛细胞中PGC-1α的表达,减少氧化应激诱导的线粒体功能障碍,从而抑制细胞凋亡。本研究结果显示与对照组相比较,模型组和老年组豚鼠听皮层SIRT1和PGC-1α表达下调,这可能与氧化应激诱导线粒体功能障碍,从而促进细胞凋亡相关。由此推测,豚鼠听皮层的老化可能是由于SIRT1/PGC-1α表达下调,导致SOD活性下降所致。
3.2电针耳穴通过SIRT1/PGC-1α 途径延缓年龄相关性聋豚鼠听皮层老化
年龄相关性聋目前尚无有效的治疗药物[25]。电针耳穴不仅能提高毛细胞及耳蜗血管纹细胞线粒体酶的活性,保障细胞能量供应[26],而且还能促进听神经纤维的再生[27]。前期研究表明,电针可以促进听皮层 β-catenin蛋白表达[20]、改善听皮层糖代谢和促进听皮层 IGF-1表达,从而改善听力[28]。本研究结果显示,电针组豚鼠ABR阈值较老年组和模型组明显降低,表明电针在一定程度上能改善年龄相关性聋豚鼠的听功能。Dong等[29]研究发现,电针可通过上调SIRT1依赖的PGC-1α的表达,从而改善SAMP8小鼠脑的能量代谢。Jung等[30]研究发现电针可通过减少活性氧及其相关酶的产生,从而改善缺血性脑卒中患者血脑屏障功能,减轻脑水肿。这些研究说明电针能调节机体氧化应激功能。本研究结果显示,电针组豚鼠听皮层SIRT1和PGC-1α的mRNA和蛋白表达高于模型组和老年组,说明电针耳穴能提高SIRT1和PGC-1α的表达,本课题组前期研究也证实了电针可提高SOD的活性;说明电针能在一定程度上通过调节氧化应激抑制D-半乳糖所致的豚鼠听皮层的老化过程[9]。
综上所述,电针可能通过上调SIRT1/PGC-1α的表达,提高SOD的活性,提高机体抗氧化应激能力,从而延缓年龄相关性聋豚鼠听皮层的老化过程,但其具体机制有待继续研究。
1 Mikhed Y, Daiber A, Steven S, et al. Mitochondrial oxidative stress mitochondrial DNA damage and their role in age-related vascular dysfunction[J]. Int J MolSci, 2015, 16: 15918.
2 Venkataraman K, Khurana S, Tai TC, et al. Oxidative stress in aging-matters of the heart and mind[J]. Int J MolSci, 2013, 14: 17897.
3 Sánchez-Rodríguez C, Martín-Sanz E, Cuadrado E, et al. Protective effect of polyphenols on presbycusis via oxidative/nitrosative stress suppression in rats[J]. Exp Gerontol, 2016, 83: 31.
4 Cheng Y, Takeuchi H, Sonobe Y, et al. Sirtuin 1 attenuates oxidative stress via upregulation of superoxide dismutase 2 and catalase in astrocytes[J]. Neuroimmunol, 2014, 269: 38.
5 Lee YH, Chen HY, Su LJ, et al .Sirtuin 1 (SIRT1) deacetylase activity and NAD+/NADH ratio are imperative for capsaicin-mediated programmed cell death[J]. Agric Food Chem, 2015, 63: 7361.
6 Liu H, Sheng M, Liu Y, et al. Expression of SIRT1 and oxidative stress in diabetic dry eye[J]. Int J Clin Exp Pathol, 2015, 8: 7644.
7 Tan M, Tang C, Zhang Y, et al. SIRT1/PGC-1α signaling protects hepa-tocytes against mitochondrial oxidative stress induced by bile acids[J]. Free Radic Res, 2015, 49: 935.
8 Basu S. A complex interplay between PGC-1 co-activators and mTORC1 regulates hematopoietic recovery following 5-fluorouracil treatment[J]. Stem Cell Res, 2014, 12: 178.
9 李君梅, 殷泽登, 谢仕津, 等. 电针耳穴对年龄相关性聋豚鼠耳蜗核、下丘和听皮层超氧化物歧化酶活性的影响[J]. 中国老年学杂志, 2013, 33: 5608.
10 Li FH, Yu HT, Xiao L, et al. Response of BAX, Bcl-2 Proteins, and SIRT1/PGC-1α mRNA expression to 8-week treadmill running in the aging rat skeletal muscle[J]. AdvExp Med Biol, 2016, 923: 283.
11 Kou X, Li J, Liu X, et al. Ampelopsin attenuates the atrophy of skeletal muscle from D-gal-induced aging rats through activating AMPK/SIRT1/PGC-1α signaling cascade[J]. Biomed Pharmacother, 2017, 90: 311.
12 Tian G, Sawashita J, Kubo H, et al. Ubiquinol-10 supplementation activates mitochondria functions to decelerate senescence insenescence-accelerated mice[J]. Antioxid Redox Signal, 2014, 20: 2606.
13 赵铭辉, 李胜, 谯凤英, 等. 国内针灸治疗突发性聋临床随机对照试验文献分析[J]. 中国中西医结合耳鼻咽喉科杂志, 2010, 18: 244.
14 Albuquerque AA, Rossato M, Oliveira JA, et al. Understanding the anatomy of ears from guinea pigs and rats and its use in basic otologic research[J]. Braz J Otorhinolaryngol, 2009, 75: 43.
15 谢仕津, 殷泽登,李君梅, 等. 电针耳穴对 D-半乳糖致豚鼠年龄相关性聋听觉中枢丙二醛表达的影响[J]. 听力学及言语疾病杂志,2012, 20: 254.
16 Kong WJ, Yin ZD, Fan GR, et al. Time course of neuronal and synaptic plasticity in dorsal cochlear nucleus of guinea pig following chronic kanamycin-induced deafness[J]. Brain Res, 2010, 1328: 118.
17 Schofield BR, Coomes DL. Auditory cortical projections to the cochlear nucleus in guinea pigs[J]. Hear Res, 2005, 199: 89.
18 Khan-Malek R, Wang Y. Statistical analysis of quantitative RT-PCR results[J]. Methods Mol Biol, 2017, 1641: 281.
19 秦红兵,杨朝晔,范忆江,等. D-半乳糖诱导衰老小鼠模型的建立与评价[J]. 中国组织工程研究与临床康复,2009,13:1275.
20 刘淑云, 邓力强, 杨烨, 等. 电针耳穴对年龄相关性听力损失豚鼠听觉中枢β-catenin表达的影响[J]. 听力学及言语疾病杂志, 2016, 24: 593.
21 Wang SJ, Zhao XH, Chen W, et al. Sirtuin 1 activation enhances the PGC-1α/mitochondrial antioxidant system pathway in status epilepticus[J]. Mol Med Rep, 2015, 11: 521.
22 Bu XS, Wu D, Lu XM, et al. Role of SIRT1/PGC-1α in mitochondrial oxidative stress in autistic spectrum disorder[J]. Neuropsychiatr Dis Treat, 2017, 13: 1633.
23 Di Emidio G, Falone, Vitti M, et al. SIRT1 signalling protects mouse oocytes against oxidative stress and is deregulated during aging [J]. Hum Reprod, 2014, 29: 2006.
24 Xue T, Wei L, Zha DJ, et al. miR-29b overexpression induces cochlear hair cell apoptosis through the regulation of SIRT1/PGC-1α signaling: implications for age-related hearing loss[J]. Int J Mol Med, 2016, 38: 1387.
25 Frisina RD, Ding B, Zhu X, et al. Age-related hearing loss: prevention of threshold declines, cell loss andapoptosis in spiral ganglion neurons[J]. Aging (Albany NY),2016, 8: 2081.
26 康颂建, 史献君, 史永芝, 等. 电针对庆大霉素耳中毒的防治作用及其机制的研究[J]. 中国应用生理学杂志, 2001, 17: 285.
27 张晓哲. 电针针刺治疗耳鸣临床疗效对比研究[J]. 中国针灸, 2002, 22: 91.
28 涂厚义, 陈茜, 刘淑云, 等. 电针听宫和翳风穴对豚鼠听皮层糖代谢及IGF-1表达的影响[J]. 听力学及言语疾病杂志, 2015, 23: 280.
29 Dong W, Quo W, Wang F, et al. Electroacupuncture up-regulates SIRT1-dependent PGC-1α expression in SAMP8 mice[J].Med Sci Monit, 2015, 21: 3356.
30 Jung YS, Lee SW, Park JH, et al. Electroacupuncture preconditioning reduces ROS generation with NOX4 down-regulation and ameliorates blood-brain barrier disruption after ischemic stroke[J]. J Biomed Sci, 2016, 23: 32.
