紫杉醇脂质体对比紫杉醇用于三阴乳腺癌新辅助化疗的疗效观察
2018-03-22李晓平余绮荷李尚仁陈奇仰
李晓平,余绮荷,李尚仁,陈奇仰
(1.江门市中心医院普通外科;2. 江门市中心医院肿瘤科,广东 江门 529000;3.台山市都斛镇医院,广东 台山 529226)
新辅助化疗广泛应用于治疗三阴乳腺癌(Triple negative breast carcinoma,TNBC)患者,该方法的优点在于:降低原发肿瘤分期,增加保乳手术机会,判断肿瘤对化疗药物的敏感性。对于TNBC患者来说,在新辅助化疗后接受手术治疗,能否获得病理完全缓解(Pathology complete release,pCR)是判断预后的替代指标[1]。当前新辅助化疗方案多是基于蒽环类后序贯紫杉烷,4周期蒽环联合4周期紫杉烷的方案在人表皮生长因子受体2(HER2)阴性的肿瘤患者中可产生较高的pCR率,一般为30%~45%[2-3]。
普通剂型的紫杉醇主要副作用表现为过敏反应、末梢神经毒性、血液学毒性以及脱发。紫杉醇脂质体是将紫杉醇包封到卵磷脂中,有利于肿瘤组织接受到更高剂量的药物输送,在保持药物活性的同时可减少副作用,并被批准使用在曾用过含蒽环类标准化疗的乳腺癌患者的后续治疗[4]。本研究通过回顾性分析,对比紫杉醇脂质体和普通紫杉醇用于三阴乳腺癌新辅助化疗的疗效及安全性。
1 对象与方法
1.1 对象
通过回顾自2013年1月至2016年12月,在我院确诊为乳腺癌并接受新辅助化疗的女性患者。在新辅助治疗前,所有患者均行粗针穿刺活检确诊为浸润性乳腺癌,且免疫组化结果提示雌激素受体(ER)、孕激素受体(PgR)和HER2状态均为阴性,亦即三阴乳腺癌。
所有患者均需要行全血细胞计数、生化、胸部CT、肝脏超声或CT检查等对其进行分期,需要行超声心动图检查以明确心功能情况。所有检查在化疗4个周期后、新辅助化疗结束时、随访期间每6个月均重复1次。排除标准为:(1)脏器功能异常不能耐受化疗;(2)年龄>70岁;(3)ECOG状态评分>2;(4)患者个人原因未能完成新辅助治疗全部疗程。
通过筛选共纳入33例患者,其中15例采用紫杉醇脂质体,另外18例采用普通紫杉醇。记录以上患者的临床资料、肿瘤特征、缓解率和毒性信息。
1.2 新辅助化疗方案
所有患者均接受8疗程的新辅助化疗,前4个周期的化疗方案相同,均为蒽环类(表柔比星 90 mg/m2或吡柔比星60 mg/m2)联合环磷酰胺(600 mg/m2),每3周为1周期。随后根据紫杉醇剂型不同,分别接受4周期的紫杉醇脂质体或紫杉醇治疗,剂量密度均为175 mg/m2,每3周为1周期。化疗后若出现骨髓抑制,则需使用重组人粒细胞集落刺激因子(G-CSF)支持治疗。
1.3 手术方法
外科手术方式包括保乳手术或全乳房切除术,依据腋窝淋巴结状态决定是否需要行腋窝淋巴结清扫还是仅行前哨淋巴结活检术。所有乳腺标本在手术后均依据Miller-payne分级系统评估肿瘤对化疗药物的病理反应情况,病理完全缓解(pCR)定义为乳腺部位肿瘤无浸润性肿瘤细胞残留[1]460-469。MP评分0分定义为病情稳定,1~4分定义为部分缓解,5分定义为pCR。
1.4 统计学分析
运用SPSS21.0对数据进行统计分析。对患者和疾病特征进行统计描述,计量资料采用t检验,等级资料采用秩和检验,计量资料采用Fisher确切概率法。P<0.05认为差异有统计学意义。
2 结 果
2.1 患者特征
自2013年1月至2016年12月,共纳入33例患者,随访时间为9~56个月。患者临床病理特征见表1。患者的平均年龄为(46.5±8.9)岁。29例(87.9%)患者病理学为浸润性导管癌,14例(42.4%)患者处于绝经状态,26例(78.8%)患者为III期乳腺癌。两组患者基线特征的差异无统计学意义(P>0.05),见表1。
2.2 疗效
紫杉醇脂质体组,有5例(33.3%)患者在新辅助化疗后获得pCR,53.3%的患者(8/15)疗效评价为PR;紫杉醇组,亦有5例(27.7%)患者在化疗后取得pCR,55.5%的患者(10/18)疗效评价为PR。两组患者的疗效差异无统计学意义(P=0.930),见表2。
2.3 安全性
两组患者前4周期化疗方案均一致,因而仅比较后四周期化疗时两组方案的毒性情况(见表3)。
患者对两种治疗方案均耐受良好。两组病例中,各有一例因IV度中性粒细胞减少而减量10%。
治疗期间观察到的最主要的毒性是骨髓抑制,而白细胞减少则是最常见的血液学毒性,紫杉醇脂质体组中,8例(53.3%)患者出现白细胞减少,其中3例患者为3~4度中性粒细胞减少症。紫杉醇组中,10例(55.5%)患者出现白细胞减少,其中5例为3~4度中性粒细胞减少症。两组患者在血液学毒性比较中,差异无统计学意义(P>0.05)。
紫杉醇脂质体仅有3例患者出现严重脱发,而在紫杉醇则很常见有17例(20% vs 94.4%,P<0.01)。紫杉醇脂质体组发生神经毒性、皮疹反应的几率分别为6.67%,6.67%,显著低于紫杉醇组的16.7%,44.4%,P<0.05。
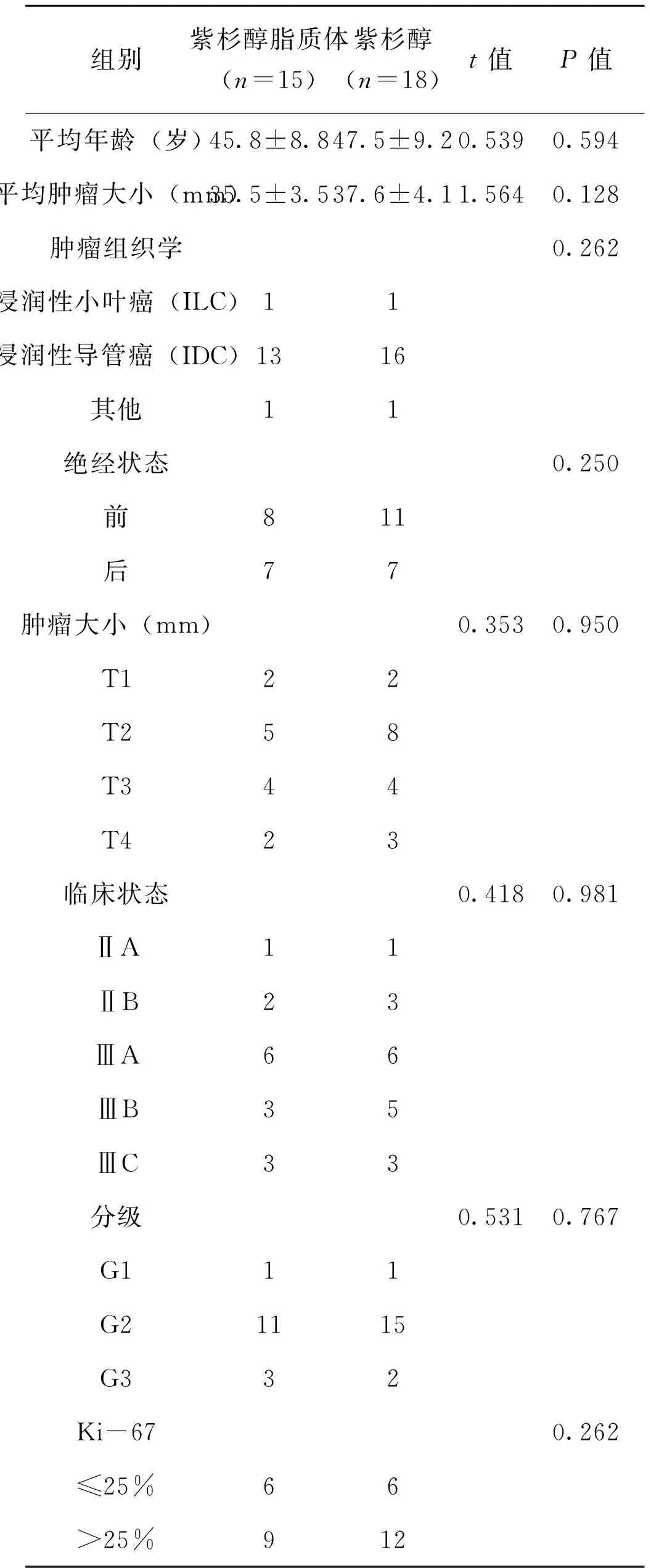
表1 两组患者基线特征
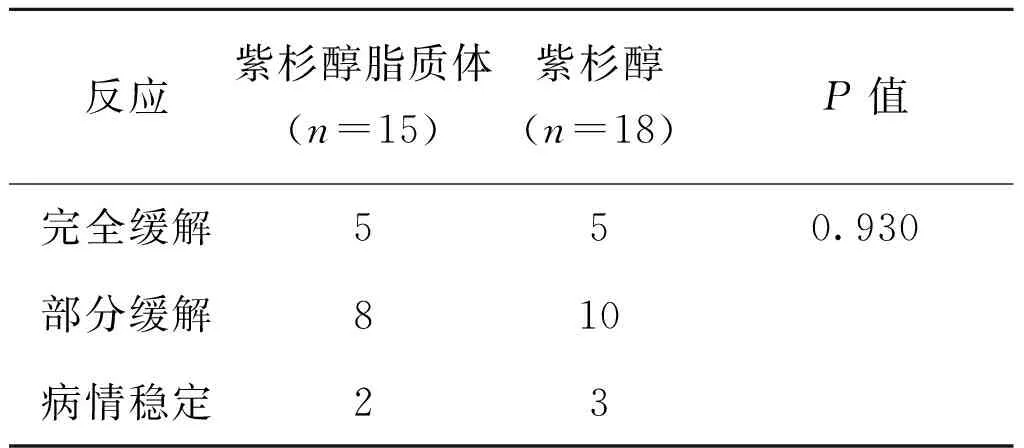
表2 两组患者新辅助化疗后病理反应情况
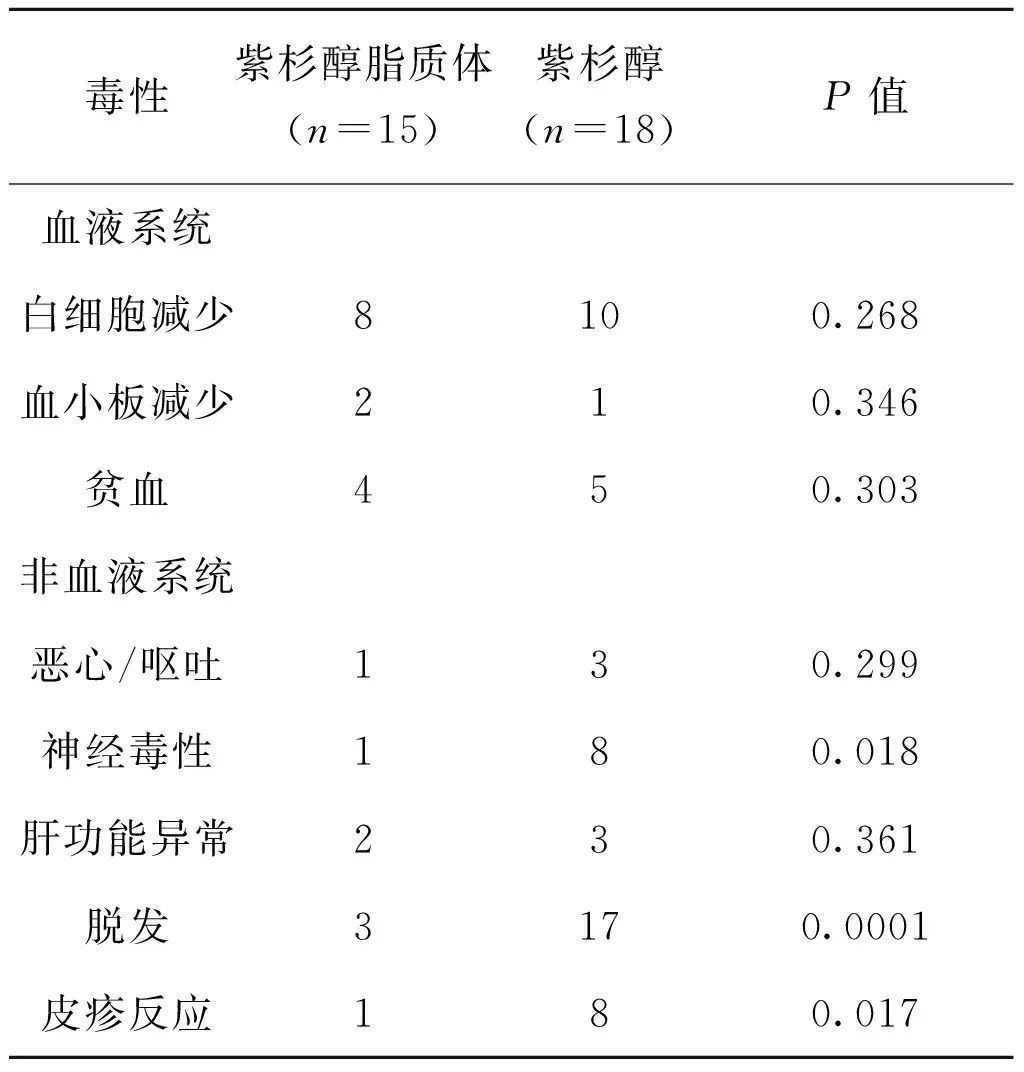
表3 两组患者毒副作用评价表
3 讨 论
紫衫类药物提取自红豆杉植物,是目前为止发现最有效的天然抗肿瘤药物,它通过稳定肿瘤细胞的微管状态,从而影响肿瘤的有丝分裂[4]。但传统剂型的紫杉醇带来的副作用也在困扰着临床医生。因而,紫杉醇脂质体能否在保证疗效的前提下,减少传统紫杉醇带来的副作用,成为学界关注的热点。
新辅助化疗已广泛应用于局部晚期乳腺癌患者,可以提高保乳手术率,得到更好的长期疗效;蒽环类序贯紫杉烷药物被认为是标准化方案。文献报道,化疗方案中使用紫杉醇脂质体,有利于向肿瘤部位输送更高剂量的药物,有可能提高治愈率[5-6]。本研究所纳入的病例均为三阴乳腺癌,此亚型乳腺癌的特点是对化疗敏感,但早期复发率高,预交较差。Sarah等研究报告TNBC新辅助化疗后pCR率为28.7%[7]。本研究发现,紫杉醇脂质体组pCR率为33.3%,略高于紫杉醇组的27.7%,pCR率与既往文献报道一致,但两组的差异无统计学意义(P>0.05)。印证了紫杉醇脂质体在治疗TNBC的疗效等效于传统的紫杉醇。
紫衫类药物最常见的血液学毒性是白细胞减少,苏薇等研究发现紫杉醇化疗相关白细胞减少发生率高达78.4%[8]。本研究发现两组患者化疗后白细胞减少的几率分别为53.3%和55.5%,发生率比既往研究要低,可能因为本研究的患者在出现II度白细胞减少时则使用G-CSF支持治疗。
过敏反应是紫衫类药物最常见的并发症,轻症者常以皮疹为主要表现,严重者会引起喉头水肿甚至窒息,由于紫杉醇的溶媒是聚氧乙基代蓖麻油,该介质容易诱发机体出现超敏反应[9-10]。而紫杉醇脂质体则采用卵磷脂作为溶媒,剔除了引起过敏反应的主要媒介。本研究发现紫杉醇脂质体组仅有1例(6.7%)患者出现皮疹反应,采用地塞米松治疗后症状消失,过敏发生率远低于紫杉醇组的8例 (44.4%),两组的差异具有统计学意义(P=0.017)。
化疗相关性脱发是困扰肿瘤患者主要的烦恼之一,有学者提出可能的机制是化疗药物引起毛囊角质形成细胞的凋亡,但其中的细胞信号通路仍未明确[11]。Dmytriw等研究发现在化疗期间使用冰帽,可有效降低脱发的发生率[12]。改进药物剂型,从源头上减少化疗药物的副作用才是最根本的措施。本研究发现紫杉醇脂质体组发生脱发的几率远低于传统紫杉醇组(20% vs 94.4%,P<0.01)。究其原因有可能是因为紫杉醇脂质体采用了纳米技术工艺,可以穿透肿瘤细胞的细胞壁,对于肿瘤细胞的杀灭更加精准而避免误伤毛囊角质形成细胞,但内在的分子机制仍需要更深入的研究。
当然本研究也存在一定的局限性,由于仅限于观察TNBC亚型乳腺癌的病例,因而入组例数较少,但仍可以观察到紫杉醇脂质体在某些化疗副作用少于传统紫杉醇。另外由于本研究受到回顾性研究设计的限制,不可避免的出现选择偏倚。总之,通过本研究的回顾性分析发现,紫杉醇脂质体与紫杉醇在三阴乳腺癌新辅助化疗的疗效没有差异,但在脱发、神经毒性及皮疹反应等化疗副作用的发生率要少于传统紫杉醇。
[1] Kuerer HM,Newman LA,Smith TL,et al. Clinical course of breast cancerpatients with complete pathologic primary tumor and axillary lymph noderesponse to doxorubicin-based neoadjuvant chemotherapy[J]. J Clin Oncol,1999,17(2):460-469.
[2] Angelucci D,Tinari N,Grassadonia A,et al. Long-term outcome of neoadjuvant systemic therapy for locally advanced breast cancer in routine clinicalpractice[J]. J Cancer Res Clin Oncol,2013,139(2):269-280.
[3] Bear HD,Anderson S,Brown A,et al. The effect on tumor response of addingsequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide:preliminary results from National Surgical Adjuvant Breastand Bowel Project Protocol B-27[J]. J Clin Oncol,2003,21(22):4165-4174.
[4] Mackey JR,Martin M,Pienkowski T,et al. Adjuvant docetaxel,doxorubicin,and cyclophosphamide in node-positive breast cancer:10-year follow-up of the phase 3 randomised BCIRG 001 trial[J]. Lancet Oncology,2013,14(1):72-80.
[5] Straubinger RM,Balasubramanian SV. Preparation and characterization of taxane-containing liposomes[J]. Methods in Enzymology,2005,391(391):97-117.
[6] 薛原,陈永法. 紫杉醇脂质体与紫杉醇在乳腺癌新辅助化疗中随机对照研究的Meta分析[J]. 中国药物经济学,2013,4:29-32.
[7] Mougalian SS,Hernandez M,Lei X,et al. Ten-Year Outcomes of Patients With Breast Cancer With Cytologically Confirmed Axillary Lymph Node Metastases and Pathologic Complete Response After Primary Systemic Chemotherapy[J]. Jama Oncology,2015,2(4):508-516.
[8] 苏薇,张晟,李春艳,等. 紫杉醇脂质体和多西紫杉醇在乳腺癌新辅助化疗中的应用效果及安全性[J]. 中华肿瘤杂志,2015,5:379-382.
[9] Wang H,Cheng G,Yuan DU,et al. Hypersensitivity reaction studies of a polyethoxylated castor oil-free,liposome-based alternative paclitaxel formulation[J]. Molecular Medicine Reports,2013,7(3):947.
[10] 曾庆安,刘星伟,杨光伟,等. 紫杉醇脂质体在28例乳腺癌新辅助化疗中的应用[J]. 中国肿瘤,2008,17(8):726-728.
[11] Koudelka S,Turn J. Liposomal paclitaxel formulations[J]. Journal of the Controlled Release Society,2012,163(3):322-34.
[12] Dmytriw AA,Morzycky W,Green PJ.Prevention of alopecia in medical and interventional chemotherapy patients[J].J Cutan Med Surg,2015,19(1):11-16.
