合生元治疗慢性功能性便秘的疗效及对肠道菌群结构的影响研究
2018-03-22黄林生祝琦高仁元严雪冰李豪屈潇孔程沈通一秦环龙
黄林生 ,祝琦 ,高仁元 ,严雪冰 ,李豪 ,屈潇 ,孔程 ,沈通一 ,秦环龙 *
由于生活习惯和饮食结构的改变,慢性功能性便秘的发病率呈逐年上升趋势。据调查,成年人群便秘的发病率达14%,在老年人群中达到36%[1]。便秘不仅能够引起腹胀、呕吐、肠梗阻和穿孔,还能够造成心理性疾病,如增加焦虑的风险、更加敏感和食欲下降[2]。目前便秘的临床治疗方式主要依靠药物治疗,常用药物包括容积性泻药(乳果糖和聚乙二醇)、刺激性泻剂(比沙可啶和番泻叶)和粪便软化剂(矿物油),但这些药物的疗效并不持久,常带有一定的不良反应[3]。
对肠道微生态的进一步研究和微生态治疗手段的探索发现,便秘患者多存在不同程度的肠道菌群紊乱。因此,对便秘患者采用益生菌、益生元和合生元调节肠道菌群、改善临床症状具有理论基础,而越来越多的临床试验发现微生态治疗能使便秘患者获得良好的收益[4-5]。积极采用合生元制剂等微生态治疗不仅可以降低对传统药物的依赖作用,改善刺激性泻剂对肠道的损伤,还可以促进肠道微生态的恢复。为此,本研究评价合生元对慢性功能性便秘患者临床症状的改善作用,并进一步探讨肠道菌群的改变情况,为促进便秘患者的合理治疗提供依据。
1 对象与方法
1.1 研究对象 选取2016年7月—2017年3月同济大学附属第十人民医院普外科微生态门诊收治的慢性功能性便秘患者24例为研究对象,其中男10例,女14例;年龄51~85岁,平均年龄(71.5±3.1)岁;病程(108.2±22.8)个月。纳入标准:(1)符合慢性功能性便秘罗马Ⅲ诊断标准[6]:①在之前3个月出现以下两种及以上情况,至少25%的排便感到费力,至少25%的排便为干球粪或硬粪,至少25%的排便有不尽感,至少25%的排便有肛门直肠梗阻感和/或堵塞感,至少25%的排便需手法辅助(如用手指协助排便、盆底支持),每周排便少于3次,②在未使用泻剂的情况下很少出现稀便,③未达到肠易激综合征(IBS)的诊断;(2)在确诊之前至少有6个月的临床症状;(3)近3个月未使用抗生素、益生菌和导致便秘的药物;(4)近6个月经结肠镜检查或在入组前加做结肠镜检查排除了肠道器质性病变;(5)在合生元治疗期间未服用其他药物;(6)治疗期间未中断使用合生元以及未添加其他益生菌制剂。排除标准:(1)有心血管疾病、糖尿病、肿瘤、神经系统疾病;(2)预计试验期间有外出计划;(3)体质指数(BMI)<16.0 kg/m2或 >30.0 kg/m2;(4)妊娠或哺乳期;(5)在就诊前1个月使用过其他含益生菌的食品或药品;(6)在就诊前1个月服用抗胆碱能药物、抗腹泻药、抗生素;(7)有胃肠道手术史,有结直肠腺瘤等疾病。研究对象均签署知情同意书,本研究通过本院伦理委员会审核(SHSY-IEC-3.0/16-53/01)。
1.2 方法
1.2.1 治疗方法 患者均采用合生元(商品名:谊畅,上海上药信谊药厂有限公司生产)进行治疗,每条制剂包含1×1010CFU/g的益生菌(长双歧杆菌、嗜酸乳杆菌、植物乳杆菌、乳双歧杆菌、婴儿双歧杆菌以及低聚木糖),饭后30 min温水送服,3次/d,持续1个月。记录治疗前后排便习惯和不良反应发生情况。
1.2.2 菌群检测及分析 门诊收集患者治疗前及治疗1个月后新鲜粪便样本,-80 ℃冰箱保存。粪便样本采用16S rRNA细菌检测技术鉴定肠道菌群,并对治疗前后自身对照的两组样本进行菌群差异分析。(1)16S rRNA细菌检测:首先对样本进行基因组DNA抽提,利用1%琼脂糖凝胶电泳检测抽提基因组DNA;聚合酶链反应(PCR)扩增,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱;参照电泳初步定量结果,将PCR产物用QuantiFluorTMST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合;构建Illumina平台文库,并Illumina平台测序。(2)生物信息学分析:分析前先对原始数据进行过滤处理,得到优化序列;然后在去除嵌合体序列后进行OTU聚类分析,对OTU的代表序列作分类学分析。基于OTU聚类分析结果和分类学信息,再对各个分类水平上进行群落结构的统计分析。
1.3 统计学方法 采用SPSS 17.0、GraphPad Prism 7.0软件进行统计学分析,计量资料采用(x± s)表示,治疗前后比较采用配对样本非参数检验;计数资料的治疗前后比较采用配对χ2检验;采用LEfSe分析、PCoA分析和Heatmap图展示治疗前后菌群结构的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 慢性功能性便秘患者治疗前后体质量、BMI比较,差异无统计学意义(P>0.05)。与治疗前比较,患者治疗后排便次数增加,腹胀、食欲不振、焦虑情绪、泻剂依赖性发生率降低,差异有统计学意义(P<0.05,见表1)。在治疗过程中,没有出现不良反应。
2.2 菌群结构分析
2.2.1 门水平 患者治疗前后Bacteroidetes、Firmicutes和Proteobacteria丰度比较,差异均无统计学意义(见表2)。

表2 慢性功能性便秘患者合生元治疗前后门水平肠道菌群结构比较(%)Table 2 Comparison of the bacterial structure by phylum level before and after synbiotic treatment for CFC
2.2.2 属水平 在属水平,对丰度>1.00%的肠道菌群分析显示,共有21个菌属丰度发生改变。其中,治疗后Faecalibacterium、Prevotella_9、Subdoligranulum、Ruminococcaceae_UCG-002、Bacillus、Roseburia、Pseudobutyrivibrio、Enterobacteriaceae_unclassified、Ruminococcaceae_UCG-014、[Eubacterium]_coprostanoligenes_group丰度较治疗前增高,Bacteroides、Christensenellaceae_R-7_group、Parabacteroides、Alistipes、Escherichia-Shigella、Blautia、Lachnoclostridium、Phascolarctobacterium、Erysipelotrichaceae_UCG-003、Ruminococcus_2、Dialister丰度较治疗前降低(见图1,本文彩图见本刊官网www.chinagp.net电子期刊相应文章)。
LEfSe分析发现,治疗前后Escherichia-Shigella、Bacillus、Lactococcus存在特征性差异,Escherichia-Shigella是治疗前肠道菌群的特异性菌属,Bacillus、Lactococcus是治疗后肠道菌群的特异性菌属(见图2)。PCoA分析和Heatmap显示,慢性功能性便秘患者治疗前后属水平肠道菌群结构存在差异(见图3、4)。

图1 慢性功能性便秘患者合生元治疗前后属水平肠道菌群结构丰度Figure 1 Intestinal bacteria structure by genus level before and after synbiotic treatment for CFC

图2 慢性功能性便秘患者合生元治疗前后肠道菌群LEfSe分析Figure 2 LEfSe analysis of intestinal bacteria before and after synbiotic treatment for CFC

表1 慢性功能性便秘患者合生元治疗前后临床特征比较(n=24)Table 1 Comparison of clinical features before and after synbiotic treatment in patients with CFC
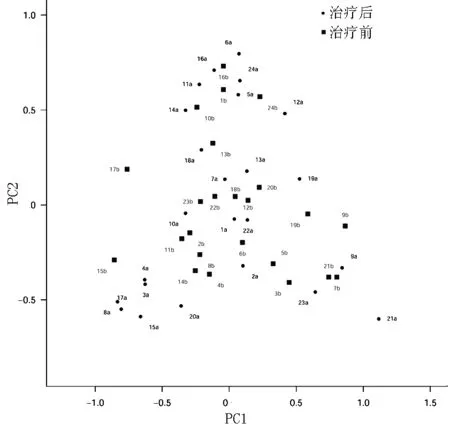
图3 慢性功能性便秘患者合生元治疗前后肠道菌群PCoA分析Figure 3 PCoA analysis of intestinal bacteria before and after synbiotic treatment for CFC

图4 慢性功能性便秘患者合生元治疗前后肠道菌群Heatmap图Figure 4 Heatmap of intestinal bacteria before and after synbiotic treatment for CFC
3 讨论
目前便秘的治疗方式为药物和手术治疗,但由于手术治疗过程并发症多和创伤大而不易被患者接受,合生元制剂因其安全性较高和具有恢复肠道菌群结构的优势逐渐被临床关注。
本研究中,患者经合生元治疗后排便次数增加,症状得到有效控制,肠道菌群显著改善。合生元中补充的益生菌在粪便样本中的丰度没有明显改变,治疗前后门水平菌群结构并没有发生明显改变,但在属水平改变明显。通过治疗前后的肠道菌群结构比较,Escherichia-Shigella是治疗前肠道菌群结构的特征性菌属,Bacillus、Lactococcus为治疗后肠道菌群结构的特征性菌属,Faecalibacterium菌属在治疗后丰度增高。PARTHASARATHY等[7]研究发现,结肠慢传输型便秘患者肠黏膜菌群与其他类型便秘患者、健康对照组不 同,Faecalibacterium、Lactococcus和 Roseburia能够促进结肠传输。本研究显示,患者经合生元治疗后Faecalibacterium、Roseburia丰度升高,与患者的临床症状改善相吻合。既往研究发现,与健康组相比,便秘组Prevotella_9丰度显著降低[8]。本研究中,合生元治疗前后Prevotella_9丰度分别为0.99%、4.67%,较治疗前明显增高,提示该菌属可能在便秘发生中发挥重要作用。有动物研究发现了特定菌群与肠道动力间的关系,Bifidobacterium bifidum、Lactobacillus reuterii和Lactobacillus acidophilus菌群能够促进肠道蠕动,Escherichia对肠道蠕动有抑制作用[9-11]。DE MEIJ等[12]对便秘儿童及健康儿童的肠道菌群进行比较发现,便秘儿童Bacteroides fragilis、Bacteroides ovatus、Bifidobacterium longum丰度升高,而Parabacteroides、Alistipes finegoldii丰度下降。但本研究未发现合生元治疗前后相关益生菌门水平丰度的改变,其可能原因是不同年龄阶段个体菌群结构差异所致。
当前,益生菌用于治疗慢性功能性便秘取得较好效果。WAITZBERG等[13]对便秘患者服用合生元的试验中发现,合生元能够显著改善患者排便情况,便秘AGACHAN评分明显增高。OJETTI等[14]在研究中通过对便秘患者使用Lactobacillus reuteri治疗,发现其能显著改善患者的排便状况。COCCORULLO等[15]报道,Lactobacillus reuteri DSM 17938能促进便秘婴儿的排便,Lactobacillus casei rhamnosus治疗儿童便秘的效果与传统氧化镁相当,但腹痛症状减少[16]。一项纳入14项随机对照试验(RCT),共1 182例患者的Meta分析显示,功能性便秘成年患者使用益生菌治疗,能够降低12 h肠道传输时间和每周增加1.3次排便[17]。另有两项RCT研究显示,益生菌治疗能够增加患者排便次数,但未发现能够改善粪便的黏稠性、性状和排便不 尽 感[14,18]。GRANATA 等[19]采用含 Lactobacillus rhamnosus GG(LGG)和低聚果糖的奶酪治疗便秘,双歧杆菌丰度并没有增加,但发现中年人群粪便中LGG丰度高于老年人群。在洛派丁胺诱导的便秘动物模型中发现,bifidobacterium adolescentis CCFM 669、667可通过黏附在肠上皮细胞和产生丙酸、丁酸来缓解便秘的症状,同时治疗后乳酸杆菌含量增高,梭菌属含量降低[20]。通过对20例功能性便秘患者进行Lactobacillus reuteri DSM 17938治疗,4周后进行呼气试验发现,甲烷的产生量降低,说明治疗后产甲烷梭菌的含量降低[21]。本研究中使用的低聚木糖能够刺激肠道双歧杆菌的生长,维持粪便中的含水量。在对30例便秘的妊娠女性进行低聚木糖(4.2 g/d)治疗4周后发现,27例患者可以自发排便,粪便的黏稠性增高,治疗过程无并发症发生[22]。
益生菌用于治疗也存在一定的风险,特别是早产儿和具有免疫缺陷者[23],在对炎症性肠病(IBD)患者进行益生菌治疗时,活菌可能会通过缺失的肠黏膜功能进入血液导致败血症[24]。
粪菌移植是慢性功能性便秘微生态治疗的另一手段。在一项回顾性研究中,276例便秘患者粪菌移植治疗的临床治愈率达40.2%(111/276)[25]。TIAN等[26]对24例慢性传输型便秘患者进行粪菌移植3 d,第12周时临床缓解率稳定在37.5%,每周排便次数增加1.8次。由于益生菌、益生元种类多,不同的配比方法的治疗结果也不相同。粪菌移植治疗便秘效果确切,但粪菌移植治疗费用较为昂贵,安全性尚有待进一步研究,应用性不如益生菌制剂广泛。
综上所述,随着对肠道微生态的进一步认识,单一有益菌对肠道微生态的改变十分有限,更多的是多联益生菌相互配合的协同作用。目前,益生菌制剂的治疗由单一菌株向复合多联益生菌、合生元方向进行转化,越来越成为临床关注的焦点,本研究相关结果有助于推动合生元制剂对便秘患者的临床应用。由于肠道菌群在不同的个体间存在较大的异质性,因此本研究采用治疗前后的自身对照。但本研究仍存在一定的局限性,首先仅纳入了24例慢性功能性便秘患者,样本量仍然较少;其次本研究未能将饮食结构、生活方式和已采用的治疗方式等可能导致结果偏差的因素纳入分析。
作者贡献:黄林生进行文章的构思与设计,撰写论文及修订;沈通一进行研究的实施与可行性分析;祝琦、李豪、屈潇、孔程进行数据收集;高仁元进行数据整理;李豪进行统计学处理;严雪冰进行结果的分析与解释;沈通一、秦环龙负责文章的质量控制及审校;秦环龙对文章整体负责,监督管理。
本文无利益冲突。
[1]LEMBO A,CAMILLERI M.Chronic constipation[J].N Engl J Med,2003,349(14):1360-1368.DOI:10.1056/NEJMra020995.
[2]MOSTAFA S M,BHANDARI S,RITCHIE G,et al.Constipation and its implications in the critically ill patient[J].Br J Anaesth,2003,91(6):815-819.
[3]TABBERS M M,BOLUYT N,BERGER M Y,et al.Clinical practice:diagnosis and treatment of functional constipation[J].Eur J Pediatr,2011,170(8):955-963.DOI:10.1007/s00431-011-1515-5.
[4]CUDMORE S,DOOLAN A,LACEY S,et al.A randomised,double-blind,placebo-controlled clinical study:the effects of a synbiotic,lepicol,in adults with chronic,functional constipation[J].Int J Food Sci Nutr,2017,68(3):366-377.DOI:10.1080/09637486.2016.1244661.
[5]YU T,ZHENG Y P,TAN J C,et al.Effects of prebiotics and synbiotics on functional constipation[J].Am J Med Sci,2017,353(3):282-292.DOI:10.1016/j.amjms.2016.09.014.
[6]中国医师协会肛肠医师分会.便秘外科诊治指南(2017)[J].中华胃肠外科杂志,2017,20(3):241-243.DOI:10.3760/cma.j.issn.1671-0274.2017.03.001.Anorectal Branch,Chinese Medical Doctor Association.Guidelines for the diagnosis and treatment of constipation(2017)[J].Chinese Journal of Gastrointestinal Surgery,2017,20(3):241-243.DOI:10.3760/cma.j.issn.1671-0274.2017.03.001.
[7]PARTHASARATHY G,CHEN J,CHEN X,et al.Relationship between microbiota of the colonic mucosa vs feces and symptoms,colonic transit,and methane production in female patients with chronic constipation[J].Gastroenterology,2016,150(2):367-379.DOI:10.1053/j.gastro.2015.10.005.
[8]黄林生,高仁元,严雪冰,等.慢性功能性便秘患者的肠道菌群分析[J].中华结直肠疾病电子杂志,2017,6(2):121-126.DOI:10.3877/cma.j.issn.2095-3224.2017.02.008.HUANG L S,GAO R Y,YAN X B,et al.Structure analysis of the gut microbiota in chronic functional constipation patients[J].Chinese Journal of Colorectal Diseases,2017,6(2):121-126.DOI:10.3877/cma.j.issn.2095-3224.2017.02.008.
[9]HUSEBYE E,HELLSTRÖM P M,SUNDLER F,et al.Influence of microbial species on small intestinal myoelectric activity and transit in germ-free rats[J].Am J Physiol Gastrointest Liver Physiol,2001,280(3):G368.
[10]WANG B,MAO Y K,DIORIO C,et al.Lactobacillus reuteri ingestion and IK(Ca) channel blockade have similar effects on rat colon motility and myenteric neurones[J].Neurogastroenterol Motil,2010,22(1):98-107.DOI:10.1111/j.1365-2982.2009.01384.x.
[11]MA X,MAO Y K,WANG B,et al.Lactobacillus reuteri ingestion prevents hyperexcitability of colonic DRG neurons induced by noxious stimuli[J].Am J Physiol Gastrointest Liver Physiol,2009,296(4):868-875.DOI:10.1152/ajpgi.90511.2008.
[12]DE MEIJ T G,DE GROOT E F,ECK A,et al.Characterization of microbiota in children with chronic functional constipation[J].PLoS One,2016,11(10):e0164731.DOI:10.1371/journal.pone.0164731.
[13]WAITZBERG D L,LOGULLO L C,BITTENCOURT A F,et al.Effect of synbiotic in constipated adult women -a randomized,double-blind,placebo-controlled study of clinical response[J].Clin Nutr,2013,32(1):27-33.DOI:10.1016/j.clnu.2012.08.010.
[14]OJETTI V,IANIRO G,TORTORA A,et al.The effect of Lactobacillus reuteri supplementation in adults with chronic functional constipation:a randomized,double-blind,placebocontrolled trial[J].J Gastrointestin Liver Dis,2014,23(4):387-391.
[15]COCCORULLO P,STRISCIUGLIO C,MARTINELLI M,et al.Lactobacillus reuteri (DSM 17938) in infants with functional chronic constipation:a double-blind,randomized,placebocontrolled study[J].J Pediatr,2010,157(4):598-602.DOI:10.1016/j.jpeds.2010.04.066.
[16]BU L N,CHANG M H,NI Y H,et al.Lactobacillus casei rhamnosus Lcr35 in children with chronic constipation[J].Pediatr Int,2007,49(4):485-490.DOI:10.1111/j.1442-200X.2007.02397.x.
[17]DIMIDI E,CHRISTODOULIDES S,FRAGKOS K C,et al.The effect of probiotics on functional constipation in adults:a systematic review and meta-analysis of randomized controlled trials[J].Am J Clin Nutr,2014,100(4):1075-1084.DOI:10.3945/ajcn.114.089151.
[18]FAVRETTO D C,PONTIN B,MOREIRA T R.Effect of the consumption of a cheese enriched with probiotic organisms(Bifidobacterium lactis bi-07) in improving symptoms of constipation[J].Arq Gastroenterol,2013,50(3):196-201.DOI:10.1590/S0004-28032013000200035.
[19]GRANATA M,BRANDI G,BORSARI A,et al.Synbiotic yogurt consumption by healthy adults and the elderly:the fate of bifidobacteria and LGG probiotic strain[J].Int J Food Sci Nutr,2013,64(2):162-168.DOI:10.3109/09637486.2012.718742.
[20]WANG L,HU L,XU Q,et al.Bifidobacterium adolescentis exerts strain-specific effects on constipation induced by loperamide in BALB/c mice[J].Int J Mol Sci,2017,18(2):E318.DOI:10.3390/ijms18020318.
[21]OJETTI V,PETRUZZIELLO C,MIGNECO A,et al.Effect of Lactobacillus reuteri (DSM 17938) on methane production in patients affected by functional constipation:a retrospective study[J].Eur Rev Med Pharmacol Sci,2017,21(7):1702-1708.
[22]TATEYAMA I,HASHII K,JOHNO I,et al.Effect of xylooligosaccharide intake on severe constipation in pregnant women[J].J Nutr Sci Vitaminol (Tokyo),2005,51(6):445-448.
[23]BOYLE R J,ROBINS-BROWNE R M,TANG M L,et al.Probiotic use in clinical practice:what are the risks?[J].Am J Clin Nutr,2006,83(6):1256-1264.
[24]QUIGLEY E M.Prebiotics and probiotics:their role in the management of gastrointestinal disorders in adults[J].Nutr Clin Pract,2012,27(2):195-200.DOI:10.1177/0884533611423926.
[25]李宁,田宏亮,马春联,等.菌群移植治疗肠道疾病406例疗效分析[J].中华胃肠外科杂志,2017,20(1):40-46.DOI:10.3760/cma.j.issn.1671-0274.2017.01.009.LI N,TIAN H L,MA C L,et al.Efficacy analysis of fecal microbiota transplantation in the treatment of 406 cases with gastrointestinal disorders[J].Chinese Journal of Gastrointestinal Surgery,2017,20(1):40-46.DOI:10.3760/cma.j.issn.1671-0274.2017.01.009.
[26]TIAN H,DING C,GONG J,et al.Treatment of slow transit constipation with fecal microbiota transplantation:a pilot study[J].J Clin Gastroenterol,2016,50(10):865-870.DOI:10.1097/MCG.0000000000000472.
