大鼠肝损伤过程中肝组织神经营养因子神经突蛋白水平变化及其意义研究
2018-03-22周涛朱美意周杰曹东欧阳军
周涛,朱美意,周杰,曹东,欧阳军
随着现代工业和交通业的迅猛发展,各类事故所致腹部闭合性损伤日渐增多,而腹部创伤中肝损伤较常见,占腹部创伤发生率>20%[1]。严重肝损伤的伤情复杂,并发症多,病死率为10%[2]。目前对肝损伤的研究主要集中在免疫性、化学性肝损伤,而对机械性肝损伤的研究相对较少。神经突蛋白(Neuritin)作为神经营养因子在多个器官表达,其在肝损伤及修复过程中的变化及作用尚未被研究。因此本研究建立大鼠肝损伤模型,采用免疫组化法观察肝损伤后不同时间点肝组织Neuritin水平,以初步探讨Neuritin在肝损伤修复过程中的作用。
1 材料与方法
1.1 主要试剂 Neuritin免疫组化一抗为多克隆山羊抗体(型号AF283),购于美国R&D公司,相应二抗(型号:PV-9003)购于北京中杉金桥生物技术有限公司,10%水合氯醛购于MERCK,肝素购于南京化学试剂股份有限公司。
1.2 仪器与设备 自制改良型BIM-IV生物撞击机购于第三军医大学;Sartorius电子天平(型号:PRACTUM124-1CN)购自深圳市盛美仪器有限公司;鼠板由本院实验室提供。
1.3 实验动物、分组及造模
1.3.1 实验动物、分组 清洁级SD大鼠126只,由新疆医科大学动物饲养中心〔许可证号XJZZQ(XK)200301〕提供,6周龄,雌雄不限,体质量(200±20)g。2015年11月—2016年11月,采用随机数字表法将SD大鼠分为空白组(42只)、非肝损伤组(42只)、肝损伤组(42只)。
1.3.2 造模 各组大鼠腹腔注射10%水合氯醛(3 ml/kg)麻醉,取仰卧位固定于鼠板。肝损伤组采用自制改良型BIM-IV生物撞击机建立肝损伤模型:将大鼠右侧腹部置于自制改良型BIM-IV生物撞击机打击头下,对其剑突与右肋弓夹角处行2次打击致肝脏钝性撞击破裂伤,肝损伤造模成功与否根据美国创伤外科协会(AAST)肝损伤分级标准[3]评判;非肝损伤组大鼠于同一部位给予同一力度致其股骨骨折;空白组不给予任何处置。
1.4 标本采集 分别于造模后6 h、12 h、1 d、2 d、3 d、5 d采用随机数字表法在各组选取7只大鼠,处死大鼠,完整取下损伤肝组织并使用Sartorius电子天平测量其重量,10%甲醛溶液固定,常规包埋、切片。从股动脉处取静脉血l~2 ml并肝素化,室温静置30 min,3 000 r/min离心10 min(离心半径3 cm),取血清、分装并于4 ℃保存待用。
1.5 肝组织HE染色 取肝组织石蜡块,制备切片(4 μm),进行HE染色,显微镜下(×200)观察肝组织病理情况。
1.6 检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)水平 将血清送往石河子大学医学院第一附属医院检验科,由固定专业检验人员利用全自动生化分析仪检测血清ALT、AST水平。
1.7 检测肝组织Neuritin水平 取肝组织石蜡块,制备切片(4 μm),进行免疫组化染色,采用Envision两步法:切片脱蜡至水,微波加热(95 ℃、15 min)以修复抗原,H2O2孵育10 min以减少背景染色;4 ℃孵育过夜;磷酸盐缓冲液(PBS)震洗3次,5 min/次;滴加二抗,37 ℃孵育30 min;PBS震洗3次,5 min/次;DAB显色后进行苏木素核复染、脱水、透明、封固、干燥。以PBS代替一抗作为阴性对照,阳性对照为损伤肝组织标本。计算免疫组化得分(IS),IS采用AB值法来计算:A为染色面积,按切片中显色细胞比例评分,1分为显色细胞数占切片中细胞总数的1/3以下,2分为显色细胞数占切片中细胞总数的1/3~2/3,3分为显色细胞数占切片中细胞总数的2/3以上;B为染色强度,按切片中细胞有无显色及深浅评分,0分细胞无着色,1分细胞显色为浅黄色,2分细胞显色为深黄色,3分细胞显色为棕褐色;SI=A×B。以SI代表Neuritin水平。
1.8 统计学方法 采用SPSS 17.0统计学软件进行数据分析。计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;两变量间的相关性采用直线相关分析。以p<0.05为差异有统计学意义。
2 结果
2.1 肝组织HE染色结果 空白组、非肝损伤组各时间点均可见肝细胞排列规则整齐,胞质、细胞核大小形态正常,胞质嗜酸性,细胞膜完整,无变性坏死,无炎性细胞浸润。肝损伤组造模后6 h时可见肝细胞排列不规则、胞质疏松化及气球样变;造模后12 h、1 d、2 d时可见肝细胞大片坏死甚至出现细胞核脱失;造模后3 d、5 d时可见肝细胞排列、胞质、细胞核大小形态接近正常(见图1)。
2.2 血清ALT、AST水平 3组造模后6 h、12 h、1 d、2 d血清ALT、AST水平比较,差异有统计学意义(p<0.05);3组造模后3 d、5 d血清ALT、AST水平比较,差异无统计学意义(P>0.05)。其中肝损伤组造模后6 h、12 h、1 d、2 d血清ALT、AST水平高于空白组、非肝损伤组,差异有统计学意义(p<0.05)。空白组、非肝损伤组造模后6 h、12 h、1 d、2 d、3 d、5 d血清ALT、AST水平组内比较,差异无统计学意义(P>0.05);肝损伤组造模后6 h、12 h、1 d、2 d、3 d、5 d血清ALT、AST水平组内比较,差异有统计学意义(p<0.05)。其中肝损伤组造模后12 h血清ALT、AST水平高于造模后6 h,造模后2 d、3 d、5 d血清ALT、AST水平低于造模后6 h、12 h,造模后2 d、3 d、5 d血清ALT、AST水平低于造模后1 d,造模后3 d、5 d血清ALT、AST水平低于造模后2 d,差异有统计学意义(p<0.05,见表1)。
2.3 肝组织Neuritin水平 3组造模后6 h、12 h、1 d、2 d、3 d肝组织Neuritin水平比较,差异有统计学意义(p<0.05);3组造模后5 d肝组织Neuritin水平比较,差异无统计学意义(P>0.05)。其中肝损伤组造模后6 h、12 h、1 d、2 d、3 d肝组织Neuritin水平高于空白组、非肝损伤组,差异有统计学意义(p<0.05)。空白组、非肝损伤组造模后6 h、12 h、1 d、2 d、3 d、5 d肝组织Neuritin水平组内比较,差异无统计学意义(P>0.05);肝损伤组造模后6 h、12 h、1 d、2 d、3 d、5 d肝组织Neuritin水平组内比较,差异有统计学意义(p<0.05)。其中肝损伤组造模后12 h、1 d肝组织Neuritin水平高于造模后6 h,造模后3 d、5 d肝组织Neuritin水平低于造模后6 h,造模后1 d、2 d、3 d、5 d肝组织Neuritin水平低于造模后12 h,造模后2 d、3 d、5 d肝组织Neuritin水平低于造模后1 d,造模后3 d、5 d肝组织Neuritin水平低于造模后2 d,造模后5 d肝组织Neuritin水平低于造模后3 d,差异有统计学意义(p<0.05,见图2、表2)。注:与空白组比较,ap<0.05;与非肝损伤组比较,bp<0.05;与造模后6 h比较,cp<0.05;与造模后12 h比较,dp<0.05;与造模后1 d比较,ep<0.05;与造模后2 d比较,fp<0.05;与造模后3 d比较,gp<0.05

图1 3组肝组织HE染色结果(×200)Figure 1 HE staining results of liver tissue in three groups
表1 3组血清ALT、AST水平比较(,U/L,n=7)Table 1 Comparison of serum ALT and AST levels measured at different measurement times in three groups

表1 3组血清ALT、AST水平比较(,U/L,n=7)Table 1 Comparison of serum ALT and AST levels measured at different measurement times in three groups
注:ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶;与空白组比较,ap<0.05;与非肝损伤组比较,bp<0.05;与造模后6 h比较,cp<0.05;与造模后12 h比较,dp<0.05;与造模后1 d比较,ep<0.05;与造模后2 d比较,fp<0.05
空白组 41.2±9.2 42.2±8.5 44.7±9.4 43.0±5.3 43.2±9.0 39.2±7.6 0.27 0.93非肝损伤组 45.3±7.0 40.7±6.6 42.4±7.4 47.2±6.2 45.0±5.8 42.0±6.4 0.89 0.51肝损伤组 261.2±18.4ab 429.2±8.4abc 242.2±15.3abcd 115.0±11.8abcde 53.0±5.4cdef 47.8±8.0cdef 901.46 <0.01 F值 603.61 4 834.46 627.45 142.49 3.42 2.04 P值 <0.01 <0.01 <0.01 <0.01 0.06 0.16组别 AST F值 P值造模后6 h 造模后12 h 造模后1 d 造模后2 d 造模后3 d 造模后5 d空白组 69.3±9.5 68.8±12.8 71.0±10.7 77.0±9.2 73.7±12.2 65.2±10.6 0.85 0.52非肝损伤组 71.8±12.8 73.7±11.9 75.7±9.5 83.2±9.5 72.5±11.8 67.3±11.7 1.30 0.29肝损伤组 275.3±10.8ab 778.2±30.6abc 410.2±16.9abcd 200.2±17.6abcde 78.2±6.9cdef 70.7±10.1cdef 1 411.9 <0.01 F值 676.43 2 413.08 1 391.64 178.40 0.48 0.39 P值 <0.01 <0.01 <0.01 <0.01 0.63 0.68
表2 3组肝组织Neuritin水平比较(,n=7)Table 2 Comparison of Neuritin levels in liver tissue measured at different measurement times in three groups
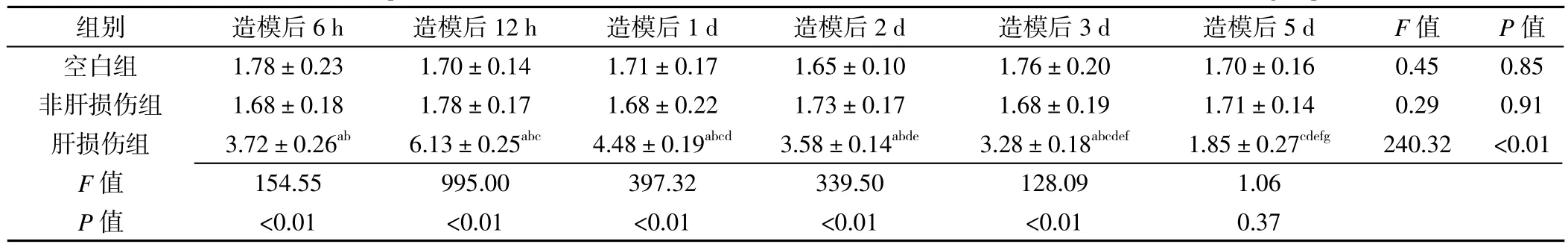
表2 3组肝组织Neuritin水平比较(,n=7)Table 2 Comparison of Neuritin levels in liver tissue measured at different measurement times in three groups
空白组 1.78±0.23 1.70±0.14 1.71±0.17 1.65±0.10 1.76±0.20 1.70±0.16 0.45 0.85非肝损伤组 1.68±0.18 1.78±0.17 1.68±0.22 1.73±0.17 1.68±0.19 1.71±0.14 0.29 0.91肝损伤组 3.72±0.26ab 6.13±0.25abc 4.48±0.19abcd 3.58±0.14abde 3.28±0.18abcdef 1.85±0.27cdefg 240.32 <0.01 F值 154.55 995.00 397.32 339.50 128.09 1.06 P值 <0.01 <0.01 <0.01 <0.01 <0.01 0.37

图2 3组肝组织免疫组化染色结果(×200)Figure 2 Immunohistochemical staining of liver tissue in three groups
2.4 肝损伤组肝组织Neuritin水平与血清ALT、AST水平的相关性 肝损伤组肝组织Neuritin水平与血清ALT、AST水平均呈正相关(r=0.796 2,p<0.001;r=0.769 1,p<0.001;见图 3、4)。
3 讨论

图3 肝损伤组肝组织Neuritin水平与血清ALT水平的相关性Figure 3 Correlation between Neuritin levels and serum ALT levels in rats with liver injury

图4 肝损伤组肝组织Neuritin水平与血清AST水平的相关性Figure 4 Correlation between Neuritin levels and serum AST levels in rats with liver injury
肝脏是再生能力较强的实质性器官,其再生机制异常复杂[4]。肝脏由肝实质细胞及肝非实质细胞组成,其中肝实质细胞数量占全部肝细胞的80%[5]。有研究者通过表达于肝实质细胞中的鸟氨酸循环的关键酶氨基甲酰磷酸合成酶1(CPS-1)以及表达于肝非实质细胞中的组织金属蛋白酶抑制剂2(TIMP-2)对肝实质细胞和肝非实质细胞进行检测分离发现,Neuritin仅在肝实质细胞中有表达[6]。日本研究者发现,在切除成年小鼠70%肝脏后Neuritin水平出现一过性降低,切除手术24 h后,随着肝脏再生的开始,Neuritin水平开始回升,其水平回升的时间与细胞周期蛋白D1(cyclinD1)一致,而cyclinD1是反映肝脏发育成熟和再生的指标[6]。由此可以推测,Neuritin在肝脏中对肝细胞的发育或再生/增殖均有重要作用,其具有潜在的临床价值。Neuritin是NEDIVI等[7]于1993年在谷氨酸类似物红藻氨酸盐的诱导下,从鼠海马cDNA文库中筛选和鉴定出的一系列与长期可塑性相关的候选基因15(CPG15)之一。随后的研究显示,光刺激可诱导CPG15在大鼠的视觉皮质中表达[8];对人类脑皮质cDNA文库筛选得到的CPG15进行初步的功能研究发现,其能促进神经突起的快速生长,故又将其命名为Neuritin[7]。Neuritin是神经营养因子家族中的一种小分子物质,之前有关Neuritin的研究一直集中在神经系统、胃、骨折等[9-11],之后利用免疫组化法对人体正常组织Neuritin水平做了进一步的研究:Neuritin除了在神经系统(脑)表达外,在肝组织中也有明显表达[12],这与NEDIVI等[13]的研究结果基本一致,证实了Neuritin还参与介导神经系统外其他细胞(真皮微血管内皮细胞,DMVEC)的再生和细胞形态学上的生长变化,并在血管领航和网络形成中发挥导向作用[14]。Neuritin作为神经营养因子在多个器官表达,但其在肝损伤及修复过程中的变化及作用尚未被研究。因此本研究建立大鼠肝损伤模型,采用免疫组化法观察肝损伤后不同时间点肝组织Neuritin水平,以初步探讨Neuritin在肝损伤修复过程中的作用。
ALT、AST主要分布于肝细胞的胞质和线粒体中,而血清中ALT、AST水平较低;当肝实质细胞受损或坏死时,细胞膜通透性增加并导致线粒体损伤,胞质中的ALT、AST大量流出,血清中ALT、AST水平明显升高,所以血清ALT、AST是肝细胞损伤的敏感指标[15]。本研究结果显示,非肝损伤组与空白组造模后6 h、12 h、1 d、2 d血清ALT、AST水平无差异;肝损伤组造模后6 h、12 h血清ALT、AST水平高于空白组、非肝损伤组;肝损伤组造模后12 h血清ALT、AST水平高于造模后6 h,造模后2 d、3 d、5 d血清ALT、AST水平低于造模后6 h、12 h;提示造模成功。肝损伤组造模后1 d、2 d血清ALT、AST水平高于空白组、非肝损伤组;3组造模后3 d、5 d血清ALT、AST水平无差异;肝损伤组造模后2 d、3 d、5 d血清ALT、AST水平低于造模后1 d,造模后3 d、5 d血清ALT、AST水平低于造模后2 d;说明ALT、AST水平升高主要由肝损伤引起,从而排除生物撞击引起其他组织损伤对ALT、AST水平的影响。肝组织HE染色结果显示,空白组、非肝损伤组各时间点均可见肝细胞排列规则整齐,胞质、细胞核大小形态正常,胞质嗜酸性,细胞膜完整,无变性坏死,无炎性细胞浸润;肝损伤组造模后6 h时可见肝细胞排列不规则、胞质疏松化及气球样变,造模后12 h、1 d、2 d时可见肝细胞大片坏死甚至出现细胞核脱失;说明本实验建立的肝损伤模型是成功的。肝损伤组造模后6 h、12 h、1 d、2 d、3 d、5d肝组织Neuritin水平高于空白组、非肝损伤组;肝损伤组造模后12 h、1 d肝组织Neuritin水平高于造模后6 h,造模后3 d、5 d肝组织Neuritin水平低于造模后6 h,造模后1 d、2 d、3 d、5 d肝组织Neuritin水平低于造模后12 h,造模后2 d、3 d、5 d肝组织Neuritin水平低于造模后1 d,造模后3 d、5 d肝组织Neuritin水平低于造模后2 d,造模后5 d肝组织Neuritin水平低于造模后3 d;说明在肝损伤后随着时间的变化肝组织Neuritin水平有先从低到高,再从高到低的变化。肝损伤组大鼠肝组织Neuritin水平与血清ALT、AST水平均呈正相关,说明大鼠肝损伤后随着ALT、AST水平升高肝细胞周围Neuritin水平也上升。因此,推测Neuritin与肝损伤程度、修复密切相关:肝损伤后Neuritin水平升高,可能与肝细胞凋亡有关,同时Neuritin对受损肝细胞有一定的修复作用,其可能参与了肝挫裂伤后的修复过程。Neuritin抗细胞凋亡或促进肝细胞再生的机制可能是:(1)Neuritin通过阻断半胱氨酸蛋白酶(Caspase)3激活抗凋亡[16];(2)Neuritin显著增强衰老大鼠肝脏中过氧化物歧化酶、过氧化氢酶以及过氧化物酶的活性,能较好地清除自由基、抑制脂质过氧化反应、降低丙二醛水平及延缓细胞衰老[17];(3)Neuritin通过改善线粒体功能,增加能量合成[16],从而发挥保护肝细胞作用;(4)Neuritin可能通过抑制一氧化氮合酶(NOS)活性[18],从而发挥抗细胞凋亡及保护细胞膜的作用。
本研究的局限性在于其他物理或化学因素也能引起肝损伤,这些引起肝损伤的因素会不会对Neuritin也有一定影响需进一步研究证实。肝损伤后Neuritin水平升高可能是肝损伤修复作用的结果,也可能是其保护作用中的一环节,推测Neuritin可能参与肝损伤后修复,但具体机制仍需进一步研究。因此,进一步探明肝损伤的发生机制,把握肝损伤修复保护的时间规律及最佳时间窗,并且进行相应的药物预处理,则会给肝损伤的防治带来很好的前景。
综上所述,大鼠肝损伤后,肝组织中神经营养因子Neuritin水平先升高再降低,与血清中ALT、AST水平变化一致,其可能在肝损伤后肝细胞的再生或增殖过程中发挥一定的作用,但其具体机制仍需进一步研究。本研究组初步推测Neuritin有可能作为急性肝损伤的分子标志物,为肝损伤的防治发挥一定的临床价值。
作者贡献:周涛进行丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、Neuritin水平检测;朱美意进行组织学检查;周杰进行动物实验;曹东进行信息检索、论文修改;欧阳军进行项目设计及指导、质量控制及审核,对文章负责。
本文无利益冲突。
[1]艾涛,高劲谋,胡平.严重肝脏损伤伴大失血的损害控制性复苏救治[J].创伤外科杂志,2015,17(1):25-27.AI T,GAO J M,HU P.Damage control resuscitation in the treatment of severe liver trauma with great blood loss[J].Journal of Traumatic Surgery,2015,17(1):25-27.
[2]陈伯棠,刘臻玉,黄擎雄,等.90例肝外伤手术预后的临床分析[J].中国临床实用医学,2010,4(1):84-85.DOI:10.3760/cma.j.issn.1673-8799.2010.01.46.CHEN B T,LIU Z Y,HUANG Q X,et al.The analysis about the clinical prognosis of 90 patients with blunt hepatic injuries after surgieal management[J].China Clinical Practical Medicine,2010,4(1):84-85.DOI:10.3760/cma.j.issn.1673-8799.2010.01.46.
[3]MOORE E E,SHACKFORD S R,PACHTER H L,et al.Organ injury scaling:spleen,liver,and kidney[J].J Trauma,1989,29(12):1664-1666.
[4]杨龙,张雅敏,崔子林,等.肝细胞生长因子激活抑制因子在肝硬化大鼠部分肝切除后肝再生过程中的表达[J].中华肝胆外科杂志,2015,21(5):324-327.DOI:10.3760/cma.j.issn.1007-8118.2015.05.011.YANG L,ZHANG Y M,CUI Z L,et al.HGFA and its inhibitors manifested differential expressions during liver regeneration after partial Hepatectomy in cirrhotic rat model[J].Chinese Journal of Hepatobiliary Surgery,2015,21(5):324-327.DOI:10.3760/cma.j.issn.1007-8118.2015.05.011.
[5]FRIEDMAN S L.Seminars in medicine of the Beth Israel Hospital,Boston.The cellular basis of hepatic fibrosis.Mechanisms and treatment strategies[J].N Engl J Med,1993,328(25):1828-1835.DOI:10.1056/NEJM199306243282508.
[6]WIBRAND K,MESSAOUDI E,HÅVIK B,et al.Identification of genes co-upregulated with Arc during BDNF-induced long-term potentiation in adult rat dentate gyrus in vivo[J].Eur J Neurosci,2006,23(6):1501-1511.DOI:10.1111/j.1460-9568.2006.04687.x.
[7]NEDIVI E,HEVRONI D,NAOT D,et al.Numerous candidate plasticity-related genes revealed by differential cDNA cloning[J].Nature,1993,363(6431):718-722.DOI:10.1038/363718a0.
[8]NEDIVI E,FIELDUST S,THEILL L E,et al.A set of genes expressed in response to light in the adult cerebral cortex and regulated during development[J].Proc Natl Acad Sci U S A,1996,93(5):2048-2053.
[9]李晓天,赵冬,代林志,等.Neuritin 对大鼠蛛网膜下腔出血后早期脑损伤影响的研究[J].中国全科医学,2016,19(24):2908-2915.DOI:10.3969/j.issn.1007-9572.2016.24.008.LI X T,ZHAO D,DAI L Z,et al.Effects of Neuritin in early brain injury after subarachnoid hemorrhage of rats[J].Chinese General Practice,2016,19(24):2908-2915.DOI:10.3969/j.issn.1007-9572.2016.24.008.
[10]李维嘉,钟晨,王锦国,等.Neuritin在胃癌中的表达水平及意义[J].重庆医学,2014,43(22):2845-2847.DOI:10.3969/j.issn.1671-8348.2014.22.005.LI W J,ZHONG C,WANG J G,et al.Expression of Neuritin and its clinical significance in gastric cancer[J].Chongqing Medicine,2014,43(22):2845-2847.DOI:10.3969/j.issn.1671-8348.2014.22.005.
[11]刘京敏,董金波,王维山,等.不同途径给予Neuritin对大鼠骨折愈合的影响[J].重庆医学,2013,42(10):1128-1131,1133.DOI:10.3969/j.issn.1671-8348.2013.10.018.LIU J M,DONG J B,WANG W S,et al.Effect of Neuritin given in different ways on promoting rats frcture healing[J].Chongqing Medicine,2013,42(10):1128-1131,1133.DOI:10.3969/j.issn.1671-8348.2013.10.018.
[12]KOJIMA N,SHIOJIRI N,SAKAI Y,et al.Expression of neuritin during liver maturation and regeneration[J].FEBS Lett,2005,579(21):4562-4566.DOI:10.1016/j.febslet.2005.07.015.
[13]NEDIVI E,WU G Y,CLINE H T.Promotion of dendritic growth by CPG15,an activity-induced signaling molecule[J].Science,1998,281(5384):1863-1866.
[14]RAGGO C,RUHL R,MCALLISTER S,et al.Novel cellular genes essential for transformation of endothelial cells by Kaposi's sarcomaassociated herpesvirus[J].Cancer Res,2005,65(12):5084-5095.DOI:10.1158/0008-5472.CAN-04-2822.
[15]雷箴,温韬.松果菊苷对刀豆蛋白A所致急性肝损伤小鼠的保护作用及对细胞外组蛋白的影响[J].解放军医学杂志,2016,41(2):97-102.DOI:10.11855/j.issn.0577-7402.2016.02.03.LEI Z,WEN T.Effect of echinacoside on the protection of acute liver injury induced by concanavalin A in mice and its effect on extracellular histones[J].Medical Journal of Chinese People's Liberation Army,2016,41(2):97-102.DOI:10.11855/j.issn.0577-7402.2016.02.03.
[16]吴思荣,王之敏,李向东,等.caspase-3在创伤性脑损伤诱导神经细胞凋亡中的作用[J].苏州大学学报(医学版),2007,27(1):49-51.DOI:10.3969/j.issn.1673-0399.2007.01.016.WU S R,WANG Z M,LI X D,et al.Effects of caspase-3 during traumatic brain injury for inducing neuronal apoptosis in rats[J].Journal of Soochow University (Medical Science Edition),2007,27(1):49-51.DOI:10.3969/j.issn.1673-0399.2007.01.016.
[17]KARAMOYSOYLI E,BURNAND R C,TOMLINSON D R,et al.Neuritin mediates nerve growth factor-induced axonal regeneration and is deficient in experimental diabetic neuropathy[J].Diabetes,2008,57(1):181-189.DOI:10.2337/db07-0895.
[18]ALME M N,WIBRAND K,DAGESTAD G,et al.Chronic fluoxetine treatment induces brain region-specific upregulation of genes associated with BDNF-induced long-term potentiation[J].Neural Plast,2007,2007:26496.DOI:10.1155/2007/26496.
