注射用尿促卵泡素治疗严重少弱精子症的多中心临床研究
2018-03-22杨宇卓刘德风辉戴继灿沈昌理褚庆军卢少明
杨宇卓 刘德风 姜 辉戴继灿 沈昌理 褚庆军 赵 勇 卢少明
1. 北京大学第三医院泌尿外科(北京 100191);2. 北京大学第三医院生殖医学中心;3. 北京大学第三医院人类精子库;4. 上海交通大学医学院附属仁济医院泌尿外科;5. 中山大学孙逸仙纪念医院泌尿外科;6. 南方医科大学南方医院泌尿外科;7. 中国人民解放军海军总医院生殖中心;8. 山东大学附属生殖医院
随着现代社会的迅速发展,不育症的发病率正逐年提高,目前约有15%的育龄期夫妇面临生育难题,并且有不断增加趋势[1,2]。少弱精子症是男性不育最常见的病因,其中严重少弱精子症的发病机制尚未完全明确,且有明确疗效的药物仍不多见,是临床医生最为棘手的问题之一。众所周知,促卵泡刺激素(follicle stimulating hormone, FSH)在调节和维持人类生精过程中的必要性,FSH在维持支持细胞功能以及精子发生过程中起着重要作用[3,4]。国外学者已有报道FSH可改善精子质量,显著提高辅助生殖的临床妊娠率[5,6],但FSH对严重少精子症及无精子症治疗效果的研究还较少。本研究拟通过随机、开放、多中心临床试验评价尿促卵泡素(uFSH,产品名丽申宝)治疗严重少精子症的疗效和安全性,现报告如下。
资料和方法
一、试验设计
1. 试验方法:采用随机、开放性、多中心、自身前后对照的临床研究方法。
2. 试验程序:根据治疗前检查筛选合格病例,严重少弱精子症初诊患者或采用其他药物治疗过的复诊患者需经过1个月洗脱期方能给予治疗,治疗8、16及24周后复查,评价药物的疗效和安全性。
3. 给药方案:采用尿促卵泡素uFSH(产品名:丽申宝;生产厂家:珠海丽珠医药股份有限公司;国药准字:h20052130)治疗,用药方式:将75单位的FSH溶于2mL氯化钠注射液中,肌肉注射,每3天1次,连续治疗24周。
二、病例选择
本研究中44例治疗患者为北医三院等6家男科、泌尿外科门诊就诊的男性不育患者。
1. 入选标准:(1)夫妇婚后同居1年以上,性生活正常而未采取任何避孕措施,由于男方因素导致的女方不孕,女方生殖功能检查正常;(2)符合男性不育症严重少精子症诊断标准(禁欲3~7d,精液常规分析3次以上者,精子浓度低于5×106/mL而查不出任何病因,可考虑为严重少精子症);(3)年龄20~35岁之间;(4)受试者在观察前1个月未用改善精子数目或活力的中西药物,或虽然用过,但同意进行1个月的洗脱。
2. 排除标准:(1)精液细菌培养阳性, 或沙眼衣原体、溶脲脲原体、人型支原体阳性;(2)毒品、烟草和酗酒者;(3)近一年内有高温、化学、物理、毒物接触史者;(4)正在进行药物治疗者(促性腺激素、促蛋白合成类固醇、化疗药物、非甾体类抗炎药等);(5)合并心血管、肝、肾和造血系统严重原发性疾病,精神病患者;(6)过敏体质或对本药有过敏者;应用其他药物治疗不育者;(7)不符合纳入标准、未按规定用药、无法判断疗效或资料不全, 影响疗效或安全性判断。
3. 剔除标准:(1)发生严重不良反应者;(3)研究期间由于不良反应以外的原因未按规定服用药物者;(3)因各种原因必须停药者;(4)研究中途失访者。
三、观察指标
1. 疗效指标:主要疗效指标为精液参数的改变情况,包括精液量、精子浓度、前向运动精子比例,次要指标为激素水平。采用WLJY-9000型伟力彩色精子质量检测系统(CASA,北京伟力新世纪发展有限公司)检测精液相关参数。
2. 安全性指标:治疗前后分别进行心、肝、肾功能及血尿常规检查。
四、统计学分析
所有数据均采用SPSS 20.0统计分析软件进行分析。计量资料使用(±s)进行统计描述。采用配对t检验比较治疗前后差异,P<0.05表示差异具有统计学意义。
结 果
一、入组患者的基本情况
连续入选2014年至2015年北京大学第三医院等6个中心收治的严重少、弱精子症患者44例,所纳入患者的平均年龄(29.89±4.34)岁,患者无高血压、心血管系统疾病,所有患者均无合并用药。
二、uFSH治疗前后精液参数的变化情况
如表1所示,丽申宝治疗前后患者精液量无明显变化。精子浓度在用药8周、16周、24周后均呈上升趋势(与治疗前相比分别增加了334%、258%和460%),在用药24周后精子浓度上升到(7.79±8.44)×106/mL,与治疗前(1.39±1.58)×106/mL相比,差异具统计学意义(P<0.05);精子总数在用药8周、16周、24周后均有明显升高(分别增加了324%、276%和278%),在用药24周后精子总数上升到(17.39 ±25.04)×106,与治疗前(4.60±7.26)×106相比,差异具统计学意义(P<0.05)。前向运动精子比例在用药8周、16周、24周后也均有显著改善(分别增加了70.5%、135%和143%),在用药24周后前向运动精子比例达到(18.77±17.16)%,与治疗前(7.74±11.41)%相比,差异具统计学意义(P<0.05);精子总活力在用药8周、16周和24周后分别提升了59.8%、105%和123%,与治疗前相比,差异具有统计学意义(P<0.05)。
表1 严重弱精子症患者采用丽申宝治疗前后精液参数的比较(±s)
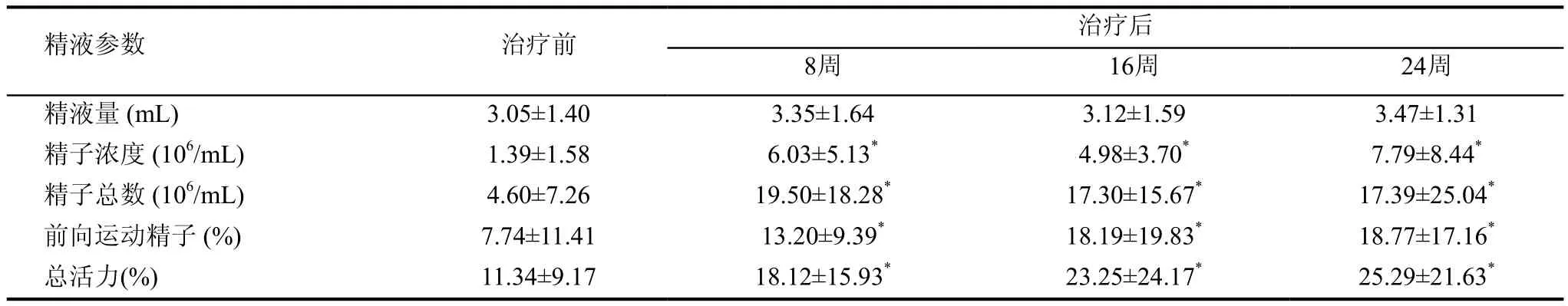
表1 严重弱精子症患者采用丽申宝治疗前后精液参数的比较(±s)
*与治疗前相比,P<0.05
精液参数 治疗前治疗后8周 16周 24周精液量 (mL) 3.05±1.40 3.35±1.64 3.12±1.59 3.47±1.31精子浓度 (106/mL) 1.39±1.58 6.03±5.13* 4.98±3.70* 7.79±8.44*精子总数 (106/mL) 4.60±7.26 19.50±18.28* 17.30±15.67* 17.39±25.04*前向运动精子 (%) 7.74±11.41 13.20±9.39* 18.19±19.83* 18.77±17.16*总活力(%) 11.34±9.17 18.12±15.93* 23.25±24.17* 25.29±21.63*
三、uFSH治疗前后激素的变化情况
与治疗前相比,丽申宝治疗8周、16周和24周后严重少弱精子症患者血清中促卵泡素(FSH)水平逐渐增加(P<0.05),但用药前后黄体生成素(LH)、催乳素(PRL)、睾酮(T)和雌二醇(E2)的水平均无明显变化(表2)。
表2 严重弱精子症患者采用丽申宝治疗前后生殖激素的比较(±s)

表2 严重弱精子症患者采用丽申宝治疗前后生殖激素的比较(±s)
*与治疗前相比,P<0.05
治疗后8周 16周 24周FSH (mIU/ml) 6.30±4.18 8.55±2.98* 9.63±3.13* 9.02±1.51*LH (mIU/ml) 3.87±1.45 4.21±1.54 4.45±1.81 3.81±1.85 PRL (ng/ml) 9.68±4.12 8.40±3.63 8.73±2.70 8.64±3.27 T (nmol/L) 9.85±4.56 11.55±5.32 12.22±6.15 11.03±5.66 E2 (pmol/L) 85.11±46.79 114.99±69.51 96.41±50.72 96.94±46.54生殖激素 治疗前
四、随访情况和安全性分析
其中1例严重少精子症患者在用药期间发生临床妊娠。用药随访观察期间所有受试患者治疗前后血、尿常规及心、肝、肾功能检查未见异常。研究过程中所有患者均未有不良事件报道。
讨 论
目前不育症已经成为一个全球性的公共问题,其中男性不育约占一半。在与男性生育能力密切相关的精液常规参数中,精子浓度和运动能力是其主要影响因素,只有前向运动的精子达到一定数量才能确保精子能够顺利抵达输卵管壶腹与卵子结合[7]。近年来,严重少弱精子症的发病率逐年增加,此在临床诊治过程中往往采用经验性治疗的办法,FSH注射治疗是治疗方法之一,且其确切疗效未达到一致共识[8,9]。因此,本研究通过多中心的临床研究来观察uFSH对严重少精子症的安全性和有效性。
在生理状态下FSH是雄性哺乳动物精子发育及Sertoli细胞生长的基础[4,10]。正常的精子发生依赖于生精上皮的Sertoli细胞,Sertoli细胞的数量决定了睾丸大小、生殖细胞和成熟精子的数量,而FSH对Sertoli细胞的生长发育和功能维持都起着重要作用。FSH在精原细胞分裂和精原细胞、精母细胞抗凋亡的过程中起着重要作用[11]。有研究报道直接给公猴使用重组人FSH,可促进精原细胞、精母细胞和精子细胞数量的增加[12]。使用GnRH-Ant处理的猴或垂体切除后,由于缺乏FSH的刺激,减数分裂被抑制,处于减数分裂期的Ap型精原细胞数量减少,B型精原细胞的减数分裂活动减少,细胞凋亡增加。未成年大鼠摘除垂体后,可以诱导生精细胞凋亡;在给予促性腺激素则可逆转生精细胞凋亡的现象,并且发现FSH的作用比人绒毛膜促性腺激素的效果更好[13]。
多项临床研究均发现外源性FSH能通过启动生殖细胞的发育分化和促进Sertoli细胞分泌营养物质等途径促进精子发生,从而提高少精子症患者的精液质量[5,14,15]。我们的研究发现,FSH不仅能显著提高精子浓度、总数,还能明显促进精子快速前向运动比例等精子活力参数。在本次研究中,uFSH注射治疗2个月时,精子总数提升明显,由原来的(4.60±7.26)×106提升至(19.50±18.28)×106,相应的精子浓度也提高了334%,同时我们还发现随着用药时间的增加,精子总数和精子浓度提升愈发明显,在用药4个月后,精子总数增加速度开始趋于稳定,其原因还需通过增加患者入组数量以及改变用药剂量进行进一步研究讨论。本次试验表明uFSH治疗严重少精子症可以明显改善患者精子活力和前向运动精子比例。因此,通过本次研究我们可以证实,精子总数、精子浓度在外源性FSH的作用下明显提高。因此,FSH可以促进精子的发生,疗效明确。国外有学者荟萃分析了自1983年至2012年共计69篇文献,对使用FSH治疗少精子症患者的治疗结果进行分析讨论,结果显示,18组实验对象共1 633例患者,其中有13组(1 467/1 663)较治疗前有明显效果[5]。同时他们还发现FSH治疗后女方辅助生育结局情况也有改善。这也证实了FSH治疗不育症的临床意义。
生殖激素与男性不育密切相关,下丘脑-垂体-睾丸轴通过调节生殖激素水平影响睾丸的生精功能[15-19]。而在本研究中,丽申宝治疗后严重少精子症患者血清中FSH水平在8、16和24周均明显增加,其余生殖激素指标无明显变化,这一结果与国外多数学者报道的治疗结果相一致[20-22],此外,Foresta等还发现FSH治疗后患者血清中inhibin B的水平也有所升高[20]。更有意义的是在我们的研究中,FSH治疗过程中有1名严重少精子症患者配偶出现自然妊娠。之前有研究发现外源性FSH可提高男性不育患者的辅助生殖妊娠结局,Ashkenazi等发现在严重少精子症患者中,FSH可明显提高IVF的受精率、临床妊娠率和胚胎质量,FSH虽然对患者的自然妊娠率无明显影响,但可增加其辅助生殖结局,这些疗效可能与FSH对精子质量和功能的影响有关[21,23,24]。在男性少弱精子症患者中,重组人FSH可降低精子DNA碎片率,它还可改善精子顶体发育不全和头部畸形,降低精子非整倍体数目和精子内氧化应激水平。此外,精子头部染色体凝集状态在使用FSH后也有所改善[25,26]。因此我们可以推测,外源性FSH可能是通过改善精子形态、DNA质量和氧化应激水平来提高男性不育患者的配偶妊娠率。
综上所述,本研究初步证实了外源性FSH可提高严重少弱精子症患者的精子浓度和前向运动能力,疗效显著,且具有良好的安全性和耐受性,值得临床进一步推广。但由于本研究样本例数相对较少,且未对男性生育能力改善的具体机制进行阐明,仍需要大样本、多中心的随机对照试验进一步深入研究。
1 Practice Committee of the American Society for Reproductive Medicine. Diagnostic evaluation of the infertile male: a committee opinion. Fertil Steril 2015;103(3): e18-e25
2 Winters BR, Walsh TJ. The epidemiology of male infertility.Urol Clin North Am 2014; 41(1): 195-204
3 Simoni M, Weinbauer GF, Gromoll J, et al. Role of FSH in male gonadal function. Ann Endocrinol(Paris) 1999; 60(2):102-106
4 Walker WH, Cheng J. FSH and testosterone signaling in Sertoli cells. Reproduction 2005;130(1):15-28
5 Valenti D, La Vignera S, Condorelli RA, et al. Folliclestimulating hormone treatment in normogonadotropic infertile men. Nat Rev Urol 2013;10(1):55-62
6 Acosta AA, Khalifa E, Oehninger S. Pure human follicle stimulating hormone has a role in the treatment of severe male infertility by assisted reproduction: Norfolk's total experience. Hum Reprod 1992;7(8):1067-1072
7 Yoshida M, Kawano N, Yoshida K. Control of sperm motility and fertility: diverse factors and common mechanisms. Cell Mol Life Sci 2008;65(21):3446-3457
8 Foresta C, Bettella A, Garolla A, et al. Treatment of male idiopathic infertility with recombinant human folliclestimulating hormone: a prospective, controlled, randomized clinical study. Fertil Steril 2005;84(3):654-661
9 Palomba S, Falbo A, Espinola S, et al. Effects of highly purified follicle-stimulating hormone on sperm DNA damage in men with male idiopathic subfertility: a pilot study. J Endocrinol Invest 2011;34(10):747-752
10 Ramaswamy S, Weinbauer GF. Endocrine control of spermatogenesis: Role of FSH and LH/ testosterone.Spermatogenesis 2014; 4(2): e996025
11 Ding LJ, Yan GJ, Ge QY, et al. FSH acts on the proliferation of type A spermatogonia via Nur77 that increases GDNF expression in the Sertoli cells. FEBS Lett 2011; 585(15): 2437-2444
12 Ramaswamy S, Plant TM. Operation of the folliclestimulating hormone (FSH)-inhibin B feedback loop in the control of primate spermatogenesis. Mol Cell Endocrinol 2001;180(1-2):93-101
13 McLachlan RI, O'Donnell L, Meachem SJ, et al.Identification of specific sites of hormonal regulation in spermatogenesis in rats, monkeys, and man. Recent Prog Horm Res 2002;57:149-179
14 Foresta C, Selice R, Ferlin A, et al. Hormonal treatment of male infertility: FSH. Reprod Biomed Online 2007; 15(6):666-672
15 陈晓会, 孙伟. FSH治疗特发性少、弱精子症的临床疗效观察. 中国性科学 2012; 21(7): 12-13, 29
16 Sairam MR, Krishnamurthy H. The role of folliclestimulating hormone in spermatogenesis: lessons from knockout animal models. Arch Med Res 2001;32(6):601-608 17 崔毓桂, 陈子庆, 沙家豪. 激素对精子发生的调控. 中华男科学杂志 2004; 10(6): 465-467
18 李江源. 精子发生的内分泌激素调节. 生殖医学杂志2014; 23(9): 697-702
19 杨念钦, 王国民. HCG、FSH联合治疗低促性腺激素性性腺功能减退症29例报告. 中国男科学杂志 2009;23(12): 39-41
20 Foresta C, Bettella A, Merico M, et al. Use of recombinant human follicle-stimulating hormone in the treatment of male factor infertility. Fertil Steril 2002;77(2):238-244
21 Paradisi R, Busacchi P, Seracchioli R, et al. Effects of high doses of recombinant human follicle-stimulating hormone in the treatment of male factor infertility: results of a pilot study. Fertil Steril 2006;86(3):728-731
22 Paradisi R, Natali F, Fabbri R, et al. Evidence for a stimulatory role of high doses of recombinant human follicle-stimulating hormone in the treatment of male-factor infertility. Andrologia 2014;46(9):1067-1072
23 Ashkenazi J, Bar-Hava I, Farhi J, et al. The role of puri fi ed follicle stimulating hormone therapy in the male partner before intracytoplasmic sperm injection. Fertil Steril 1999;72(4):670-673
24 Dirnfeld M, Katz G, Calderon I, et al. Pure folliclestimulating hormone as an adjuvant therapy for selected cases in male infertility during in-vitro fertilization is beneficial. Eur J Obstet Gynecol Reprod Biol 2000; 93(1):105-108
25 Colacurci N, Monti MG, Fornaro F, et al. Recombinant human FSH reduces sperm DNA fragmentation in men with idiopathic oligoasthenoteratozoospermia. J Androl 2012; 33(4): 588-593
26 Bartoov B, Eltes F, Lunenfeld E, et al. Sperm quality of subfertile males before and after treatment with human follicle-stimulating hormone. Fertil Steril 1994;61(4):727-734
