菌草绿洲3号快繁及遗传转化体系的初步研究
2018-03-21宋昭昭林志魁林占熺福建农林大学生命科学学院福建福州35000国家菌草工程技术研究中心福建福州35000
梅 兰,宋昭昭,刘 波,林志魁,林占熺(1.福建农林大学生命科学学院,福建 福州 35000; .国家菌草工程技术研究中心,福建 福州 35000)
菌草是指经过三级系统筛选法筛选出来的,经试验证明适合用于栽培食药用菌的草本植物,包括芒萁(Dicranopterisdichotoma)、五节芒(Miscanthusfloridulus)、绿洲1号(Arunddonax‘Lvzhou No.1’)、绿洲3号(A.donax‘Lvzhou No.3’)、巨菌草(Pennisetumsp.)等[1]。其中,绿洲3号原产于我国福建省福州市永泰县[2],现主要分布于我国福建、台湾、安徽等地,以及在巴布亚新几内亚、斐济、卢旺达均有种植。绿洲3号系单子叶禾本科芦竹属植物,植株高大直立,根系发达,为多年生丛生草本植物[2]。其茎杆直立、挺拔、中空,株高通常为7 m,茎粗约3 cm,叶长68.0~73.5 cm,叶宽6.6~8.0 cm,可分枝,每个节均能长芽[2]。
芦竹属(Arundo)植物是低洼盐碱地的“先锋植物”,主要是由于它耐旱、耐盐碱的特性,且在贫瘠的土壤里具有一定的忍耐力[3-4]。绿洲3号作为芦竹属植物,是荒漠化地区恢复植被的优良草种,在沼泽地、河滩地、河岸、沙荒或旷野地都能生长,近年来被用于福建长江地区的崩岗,内蒙古阿拉善地区以及西藏林芝地区的防沙固沙,与巨菌草结合,当年就可见效。绿洲3号还是栽培多种食药用菌的优质栽培料,用禾本植物栽培食药用菌可以大量节约木料,有效缓解菌林矛盾。除了可作为培养食药用菌的栽培料,绿洲3号还可作为牲畜的青贮饲料,可用于生产乙醇、沼气、纤维板等,同时还是优质的造纸原料。绿洲3号适宜在中国南方如福建等气候温暖的地区种植,在寒冷的北方,如无人工覆膜、大棚遮盖等措施很难自然越冬。在低温条件下生长缓慢甚至停止生长,导致生长周期变短,产量及经济效益降低,这使得绿洲3号在北方的种植和推广受到限制,传统的育种技术暂时无法解决此难题。生物技术如转基因、体细胞杂交等是改良绿洲3号耐寒性的有效途径,必须首先建立绿洲3号的组织培养技术体系及转基因体系。为此,对绿洲3号的遗传转化体系进行初步研究,旨在为绿洲3号遗传改良奠定基础,以便对绿洲3号在极端环境下的推广应用提供理论指导。
1 材料与方法
植物材料芦竹属绿洲3号,由国家菌草工程技术研究中心提供。
根瘤农杆菌菌株LBA4404感受态细胞(含有利福平抗性基因Rif)和质粒pCAMBIA1301(含有卡那霉素抗性基因Kan)分别购买于上海北诺生物科技有限公司和上海捷兰生物科技有限公司。该质粒中Hyg基因为选择标记基因,GUS基因为报告基因。
1.1 绿洲3号快繁体系的建立
1.1.1培养基成分及培养条件 愈伤组织培养基:MS+0.5mg·L-16-BA+1.0 g·L-1PVP+3.0 mg·L-12,4-D。参考林志魁等[2]的方法。
培养温度控制在(25±2)℃,光照强度800~1 200 lx,每天光照时间为12 h。保持培养室清洁及定期消毒。
1.1.2不定芽和不定根的诱导 在无菌条件下将培养的质地相同,均匀一致的绿洲3号愈伤组织切成0.5~1 cm2的小块,分别接种于含有不同浓度的6-BA和NAA的MS培养基中(表1)。每瓶中接种4块愈伤组织,每个处理20瓶,重复3次,培养25 d后观察记录。
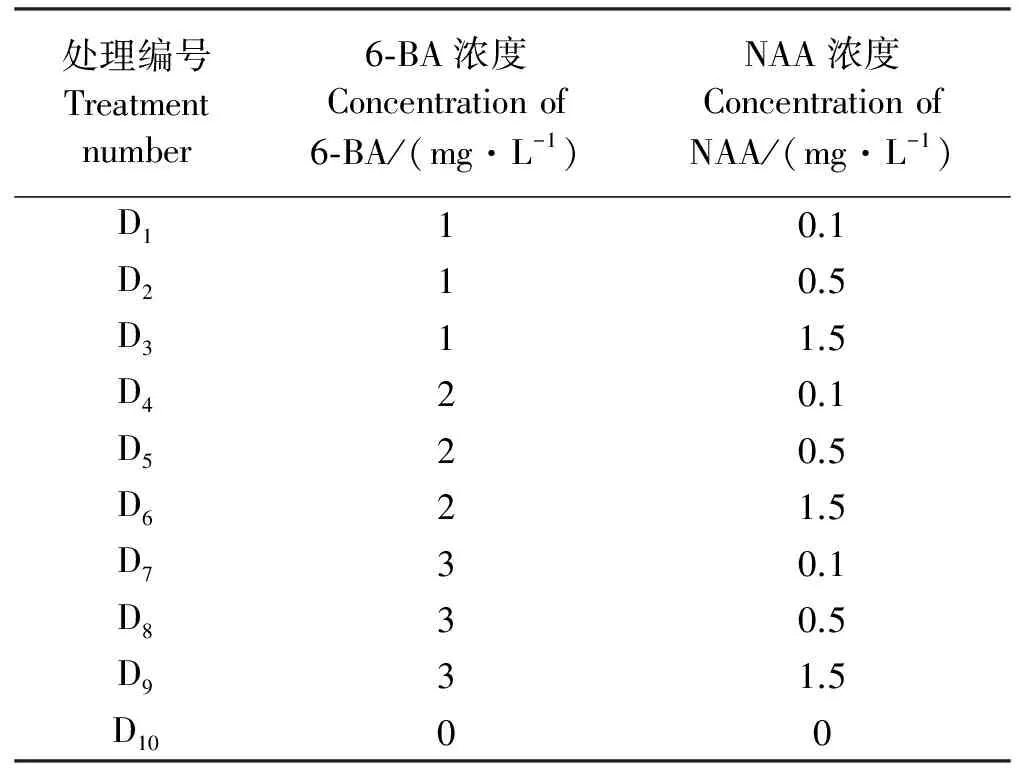
表1 不定芽分化和生根培养基配方Table 1 Medium formula of adventitious bud differentiation and rooting
1.1.3不定芽的继代增殖 在无菌条件下将上述培养的长势良好、大小一致的绿洲3号不定芽分别接种于含有不同浓度6-BA和IBA的MS培养基中(表2)。每瓶中接种4块愈伤组织,每个处理20瓶,重复3次,培养30 d后观察记录不定芽增殖情况和生长状况。

表2 不同浓度的生长素对不定芽增殖培养基Table 2 Different culture media used for proliferation of adventitious buds
1.1.4苗的移栽 将生长良好并长出3~4 cm根的绿洲3号组培苗从培养室移出,在室温环境下闭瓶练苗3 d后,将瓶盖打开加入水至淹没培养基,继续练苗3 d。随后取出小苗,洗净根部培养基进行移栽。分别移栽至沙河、黄泥、菜园土、泥炭、菌糟、沙河∶泥炭(1∶2)、黄泥∶泥炭(1∶2)、菜园土∶泥炭(1∶2)、菌糟∶泥炭(1∶2)共9个基质中,每个处理12株,重复3次。3周后统计成活率。
1.2 绿洲3号遗传转化体系的初步研究
1.2.1试剂配制以及培养基的准备 头孢酶素(Cef)、潮霉素B(Hyg)、卡那霉素(Kan)、利福平(Rif)和乙酰丁香酮(AS)分别用0.22 μm滤膜过滤灭菌后保存于-20 ℃。
LB固体、液体培养基,试验其他主要培养基及组成如表3所列。

表3 绿洲3号愈伤组织转化所用的各种培养基Table 3 Media used in the transformation of calli of Lvzhou No. 3
MS,培养基;6-BA,6-苄氨基腺嘌呤; PVP,聚乙烯吡咯烷酮;AS乙酰丁香酮。
MS, culture medium; 6-BA, 6-benzylaminopurine; PVP,polyvinyl pyrrolidone; AS, acetosyringone.
1.2.2转化受体愈伤组织的准备 愈伤组织的诱导参考林志魁等[2]的方法。
1.2.3冻融法转化根瘤农杆菌 无菌条件下,在刚刚化冻的LBA4404农杆菌感受态细胞悬液中分别加入2 μL需要转化的质粒DNA和2 μL无菌水(空白对照),轻轻混匀,冰上放置10 min。
将离心管转入到液氮中速冻5 min,再转移至37 ℃水浴中,放置5 min,期间不要晃动离心管,然后冰浴5 min。无菌条件下加入800 μL不加抗生素的LB液体培养基,于28 ℃摇床上震荡培养2.5 h,使菌体复苏。
吸取50 μL菌液加到含有抗生素的LB固体培养基上,用细胞涂布器涂布均匀,对照菌液也均匀涂布于培养基,28 ℃倒置培养72 h。对长出来的菌落进行PCR分析。
1.2.4潮霉素(Hyg)敏感性试验 将诱导出基本一致的淡黄色致密的愈伤组织分别接种到含有0、15、30、45、60、80 mg·L-1潮霉素的继代培养基和分化培养基上,每个处理接入30块愈伤组织,3次重复。暗培养30 d后观察比较不同浓度的潮霉素对愈伤组织增殖和分化的影响。综合试验结果,以确定转化过程中适合的潮霉素筛选浓度。
1.2.5头孢霉素(Cef)抑菌浓度的确定 分别将过夜培养的LBA4404菌液20 μL接种到含头孢霉素0、100、200、300、400、500 mg·L-1的液体LB培养基中,每个处理重复3次。在28 ℃,200 r·min-1条件下摇床培养48 h后,观察记录并用分光光度计测菌液OD600值。同时将淡黄色致密的愈伤组织接种在含有0、100、200、300、400、500 mg·L-1头孢霉素的分化培养基上,每个处理接入30块愈伤组织,3次重复。光照培养30 d后观察比较愈伤组织分化情况。
1.2.6农杆菌侵染与共培养 挑取转化后的农杆菌单菌落于100 mL LB液体培养基(50 mg·L-1Rif+50 mg·L-1Hyg+50 mg·L-1Kan)中。28 ℃,200 r·min-1摇床上培养24 h,然后取一定量的菌液于烧杯中,按LB∶MS=1∶1比例稀释菌液,使菌液OD600值调节到一定值(0.1、0.2、0.4、0.6 OD600)。
将预培养的愈伤组织置于上述准备好的悬浮培养基中浸泡,期间慢慢摇动侵染一定时间(5、10、20、30 min)后倒去菌液,用无菌滤纸吸干愈伤组织表面多余的菌液,转接于铺有2~3层无菌滤纸的共培养基中,于暗处28 ℃共培养一定时间(1、2、3、4 d)。
1.2.7正交实验设计绿洲3号的转化体系 本研究选用5因素4水平的L16(45)正交实验(表4),其五因素分别是预培养时间(0、1、2、3 d)、菌液浓度OD600(0.1、0.2、0.4、0.6)、共培养AS浓度(0、100、200、300 μmol·L-1)、农杆菌侵染时间(5、10、20、30 min)及共培养时间(1、2、3、4 d)。试验参数参照预备试验设计,每个试验组和接种400个绿洲3号愈伤组织,共培养后的愈伤组织进行GUS表达率统计。

表4 L16(45)正交实验的处理Table 4 The orthogonal experiment treatments
1.3 数据处理
不定芽诱导率=产生不定芽的愈伤组织数/接种的愈伤组织总数×100%;
不定芽生根率=分化出根的不定芽数/接种的不定芽总数×100%;
愈伤组织增殖率=增殖的愈伤组织块数/接种的愈伤组织块数×100%;
成活率=成活的组培苗数/移栽的组培苗总数×100%。
取以上各处理3次重复的平均值为结果数据,运用统计分析软件SPSS 20.0进行数据的显著性检验和分析。
2 结果与分析
2.1 绿洲3号快繁体系的建立
2.1.16-BA和NAA对绿洲3号愈伤组织诱导不定芽和根的影响 以MS为基础培养基,分别添加不同浓度的6-BA和NAA进行芽和根分化培养(图1)。结果表明,D8处理的不定芽诱导率显著低于另外9个处理,不定芽的诱导率仅为65.000%(表5),其他9个处理之间差异不显著(P>0.05),以D1和D4处理的发芽率最高,达100%,但D4的长势差于D1。D10处理生根率显著高于其他9个处理,为91.7%,这说明6-BA和NAA抑制绿洲3号愈伤组织根的诱导。综上分析可得出,绿洲3号愈伤组织不定芽的最适诱导培养基MS+1.0 mg·L-16-BA +0.1 mg·L-1NAA,根的最适诱导培养基为MS。
2.1.26-BA和NAA对绿洲3号不定芽增殖的影响 试验结果表明,在不添加6-BA和IBA的MS的基本培养基中,都没有不定芽的增殖。在添加有6-BA和IBA的9个处理增殖明显差异不大,增殖率均达到了100%,增殖多且长势健壮。因此,MS+1.0 mg·L-16-BA +0.5 mg·L-1IBA为绿洲3号不定芽增殖的最佳培养基(图2)。
2.1.3组培苗的移栽结果 不同移栽基质对绿洲3号组培苗移栽成活的效果不同(图3)。移栽成活率大小依次为泥炭(存活率为100%)>河沙∶泥炭(1∶2)>黄泥∶泥炭(1∶2)>河沙=菜园土>黄泥>菌糟∶泥炭(1∶2)>菜园土∶泥炭(1∶2)>菌糟(存活率为20.4%);苗的长势在含有泥炭或菌糟的土壤基质中明显的好于其他基质(表6)。可见,泥炭基质为绿洲3号组培苗最适移栽基质。

图1 绿洲3号愈伤组织诱导出的不定芽和根Fig. 1 Shoot and roots regenerated from Lvzhou No. 3 callus

表5 不定芽分化和生根培养基配方Table 5 Medium formula of adventitious bud differentiation and rooting
不同小写字母表示不同处理间差异显著(P<0.05)。下表同。+++:生长最好最快;++:生长一般;+:生长较差。
Different lowercase letters indicate significant differences at the 0.05 level; similarly for the following tables. +++:Best; ++:Good; +:Poor.
2.2 绿洲3号的遗传转化
2.2.1愈伤组织增殖对潮霉素的敏感性 15~45 mg·L-1的Hyg可促使绿洲3号根分化,在不加Hyg和Hyg浓度在60~80 mg·L-1的培养基中均无根的分化(表7)。接种在含Hyg的培养基上的愈伤组织增殖块数与不含Hyg的培养基相比显著(P<0.05)下降,15~80 mg·L-1的Hyg浓度使愈伤组织的增殖块数低于40%,在80 mg·L-1时愈伤组织增殖块数为0(图4)。因此,Hyg比较理想的选择压浓度为80 mg·L-1。
2.2.2愈伤组织分化对潮霉素的敏感性 在无Hyg添加的培养基中,愈伤组织中不定芽分化率较高,在含有Hyg添加的培养基中愈伤组织不定芽分化率为0。随着Hyg浓度的升高,生根率先升后降且差异显著(P<0.05)。当Hyg浓度大于60 mg·L-1时,愈伤组织停止生长和分化,并出现黄褐色(图5)。在45 mg·L-1的Hyg浓度下愈伤组织先增大后焦褐死亡(图5)。所以,Hyg的最适浓度为60 mg·L-1。

图2 绿洲3号芽在G10和含有激素的培养基上的增殖情况Fig. 2 The propagation of Lvzhou No. 3 buds was in G10 medium and the medium with hormone

图3 移栽的植株及生长30 d后的植株Fig. 3 Transplanted seedlings and plants after 30 d

表6 不同基质对绿洲3号组培苗移栽成活率的影响Table 6 Effect of different planting media on plantlet survival rates
++表示苗短,瘦弱;+++表示苗短,粗壮;++++表示苗长,粗壮。
++, the bud is short and weak; +++, the bud is short and strong; ++++, the bud is long and strong.
2.2.3抑菌抗生素浓度的筛选 随着抑菌剂Cef浓度的增加,菌液OD600值显著下降(P<0.05)。Cef分别为100、200、300、400、500 mg·L-1时,OD600值分别为0.038、0.021、0.010、0.004和0,其抑菌效果无显著差异,且农杆菌LBA4404的数量极少,在500 mg·L-1时能完全达到抑制农杆菌生长(表9)。
随着Cef浓度的增加,绿洲3号愈伤组织芽和根的分化受到的影响不大,芽的分化率均大于88%(表10)。为更好地抑制农杆菌生长,降低试验成本并避免浪费,选用Cef的抑菌浓度为200mg·L-1时,绿洲3号愈伤组织仍能高效分化出芽。由此说明,Cef可作为抑菌剂[5-7]。
2.2.4农杆菌转化的结果 将经冻融法转化的根瘤农杆菌菌株LBA4404分别涂抹于LB基本培养基和添加50 mg·L-1利福平、50 mg·L-1潮霉素及50 mg·L-1卡那霉素的LB培养基,同时把未经转化的根瘤农杆菌菌株LBA4404涂抹于含抗生素(利福平、潮霉素、卡那霉素)的LB培养基,经3 d培养后观察生长情况。含有抗生素的培养基中未经转化的菌株LBA4404无生长的迹象,而经转化的菌株LBA4404在含抗生素的LB培养基中生长速度明显低于在不含抗生素的LB培养基,因此在含抗生素的培养基中,菌株LBA4404成功导入质粒pCAMBIA1301。
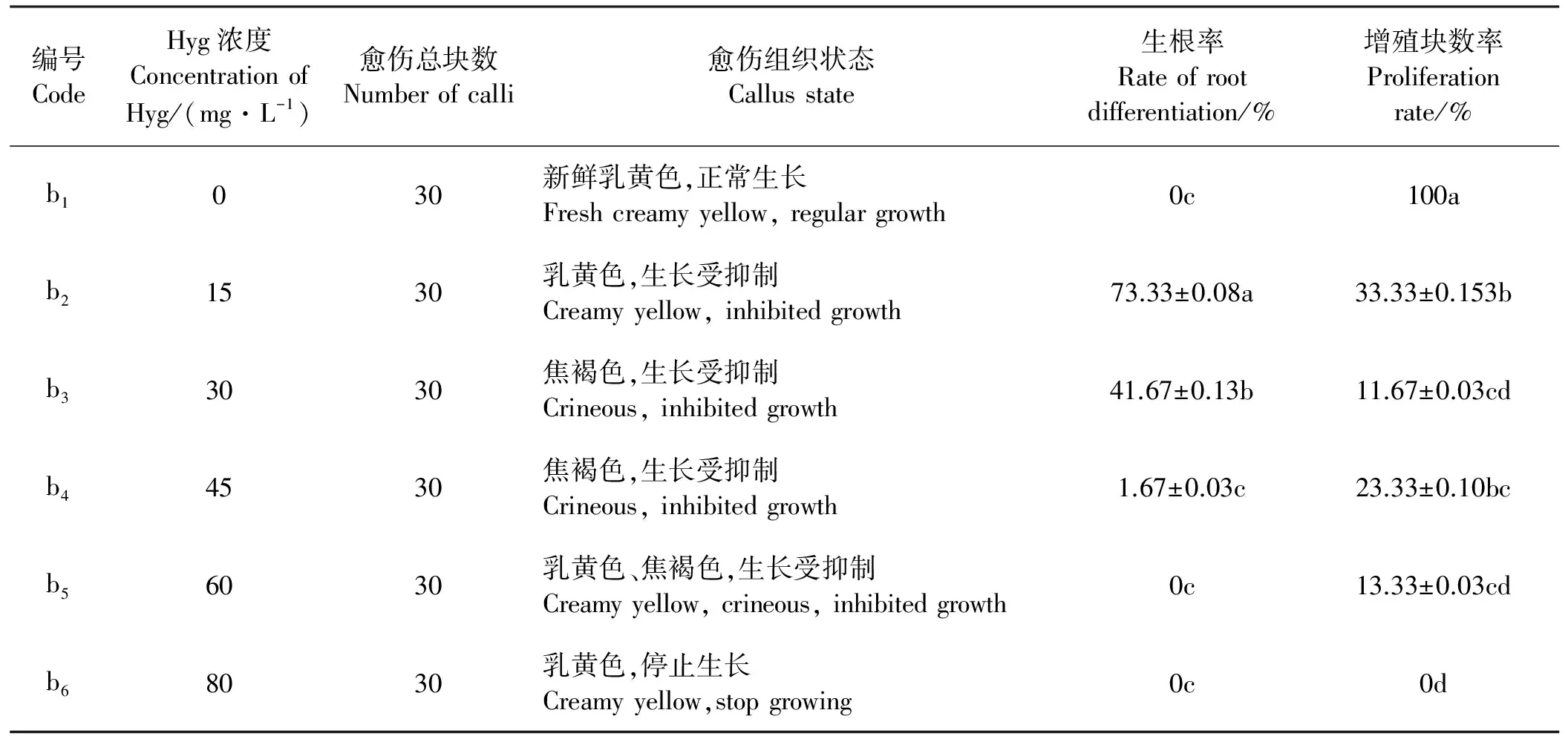
表7 不同浓度的潮霉素对愈伤组织增殖的影响Table 7 Effects of different concentrations of Hyg on callus proliferation
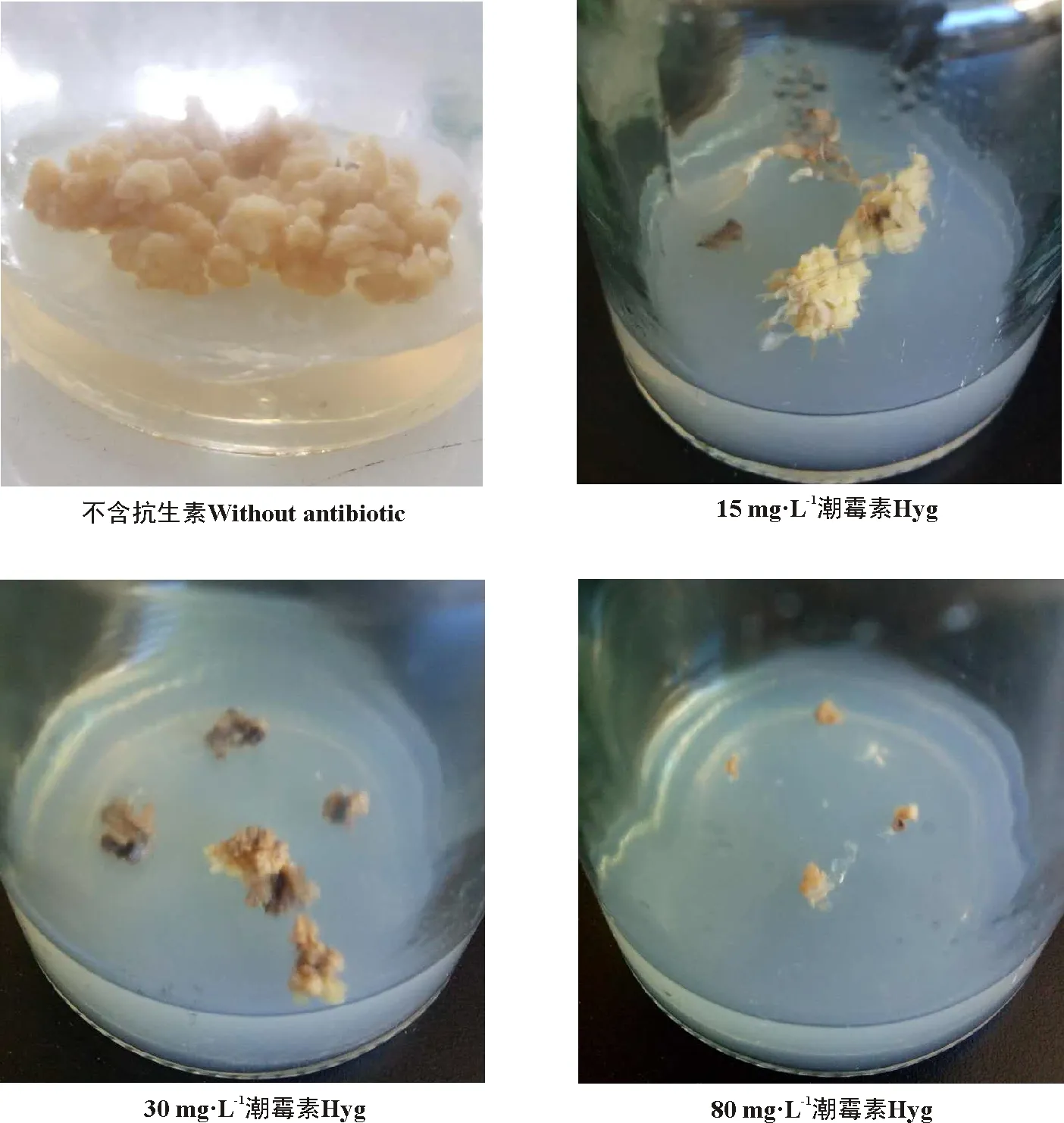
图4 不同浓度的潮霉素对愈伤组织增殖的情况Fig. 4 Effects of different concentrations of Hyg on callus proliferation

表8 不同浓度的潮霉素对愈伤组织分化的影响Table 8 Effects of different concentrations of Hyg on callus differentiation

图5 不同浓度的潮霉素对愈伤组织分化的情况Fig. 5 Effects of different concentrations of Hyg on callus differentiation
2.2.5正交实验设计结果 将共培养的愈伤组织和未转化处理的愈伤组织进行GUS染色,结果表明,抗性愈伤组织表面呈蓝色,经共培养无抗性愈伤组织呈黄色,而未经农杆菌侵染的愈伤组织呈白色。在本研究中,当预培养时间为3 d、OD600为0.1、添加AS浓度为300 μmol·L-1、农杆菌侵染时间为10 min及共培养时间为1 d时,GUS表达率最高,为1.5%,其他条件均未发现抗性愈伤组织。
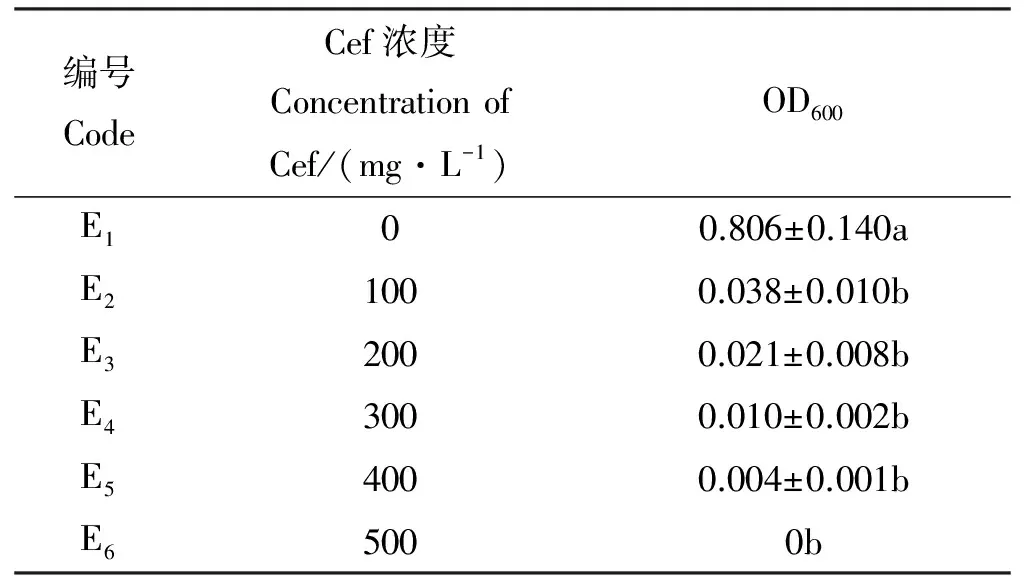
表9 头孢霉素对抑菌效果的影响Table 9 Effect of cefotaxime on suppression of Agrobacterium tumefaciens

表10 不同浓度的Cef对愈伤组织分化的影响Table 10 Effects of different concentrations of Cef on callus differentiation

图6 GUS表达Fig. 6 GUS expression
a: 农杆菌侵染的愈伤组织;b:未经农杆菌侵染的愈伤组织。
a: Calli infected byAgrobacteriumtumefaciens; b: Calli withoutAgrobacteriuminfection.
3 讨论与结论
分化与激素的关系同植物的遗传性有密切的关系,而细胞分裂素与生长素的比值能影响植物的分化能力,从而影响愈伤组织的根、芽等器官的分化[8]。唐玉林等[9]研究表明,细胞分裂素/生长素比值高不利于根的分化,从而也证实本研究中6-BA和NAA抑制绿洲3号愈伤组织的根分化。当添加的6-BA和NAA浓度均为0 mg·L-1时,生根率高于其他9个处理。添加1.0 mg·L-16-BA和0.1 mg·L-1NAA,愈伤组织的不定芽诱导率和生根率均最高,且长势良好。许多作物器官先长出根系后很难分化出不定芽[10],故应先分化出不定芽后再进行根的诱导。综合分析,诱导绿洲3号不定芽分化的最佳培养基为:MS+1.0 mg·L-16-BA+0.1 mg·L-1NAA,最佳生根培养基为MS。
吲哚丁酸(IBA)属于生长素类物质,它可以促进细胞分裂,诱导愈伤组织形成组织块。6-BA属于细胞分裂素类物质,可以促进细胞的分裂和不定芽的形成,打破顶端优势,有利于形成丛生芽并增殖[11]。在植物的组织培养中,添加的激素种类和配比对细胞的诱导分化与生长起着决定性的作用,在一般情况下高浓度的细胞分裂素与低浓度的生长素配合使用可直接诱导外植体再生不定芽或诱导生成胚状体[12]。本研究发现,一定浓度的6-BA和IBA均可促进绿洲3号不定芽的增殖,在添加有6-BA和IBA的9个处理中,不定芽的增殖差异不大,且都达到了100%。结合成本考虑,以MS+1.0 mg·L-16-BA+0.5 mg·L-1IBA为最佳增殖培养基。
通过苗的移栽试验发现,绿洲3号组培苗移栽入9种基质中培养一段时间后,除含有菌糟基质的苗生长良好,其余的均植株矮小、叶下部成紫红色。李晓强等[13]利用菌渣为原料的育苗基质,通过加入不同体积配比的珍珠岩、蛭石,进行番茄(Lycopersiconesculentum)、甜椒(Capsicumannuumvar.grossum)、黄瓜(Cucumissativus)的育苗,发现菌渣和珍珠岩复合基质中菌渣含量与蔬菜壮苗指数极显著相关(P<0.01)。在土壤中添加菌渣,可改变土壤有机质、腐殖质含量,有助于改善土壤结构,促进土壤团粒结构的形成,提高土壤肥力[14]。因此在育苗时,应注意科学合理地组配无机基质和有机基质,可以更好地调节育苗基质的水分和营养状况。
转化受体系统必备的条件是较强重复性、高频率的再生率和诱导率[15]。Firoozabady等[16]利用带GUS报告基因质粒的农杆菌转化Rosahybrida‘Royalty’的茎、叶柄、花、叶及愈伤组织等,结果表明,只有愈伤组织转化成功。高莉萍和包满珠[17]选择月季品种‘萨曼莎’的愈伤组织和试管苗叶作为转化受体,结果显示,只有愈伤组织成功转化。因此,本研究以绿洲3号愈伤组织为转化受体材料。
植物的遗传转化体系研究中,选择剂既不可杀死植物细胞,又需对细胞生长起到抑制作用[18-19]。转化受体材料对抗生素有一定耐受力,而非转化受体材料对抗生素敏感,从而筛选出转化成功的植株。本研究所用载体质粒pCAMBIA1301含有潮霉素抗性,绿洲3号愈伤组织对潮霉素较为敏感,潮霉素浓度在60 mg·L-1几乎就抑制愈伤组织的分化,在80 mg·L-1愈伤组织几乎停止生长。因此,在绿洲3号遗传转化过程中,选择60~80 mg·L-1潮霉素为适宜的选择剂。
植物的遗传转化中,侵染后的受体材料表面附着有大量的农杆菌,如果不加抗生素会使农杆菌大量的生长,从而使受体材料死亡。抗生素能使经农杆菌侵染共培养后的受体材料脱菌,且不影响受体材料的分化[20]。本研究采用的抑菌剂是头孢霉素(Cef),头孢霉素是较为常用的抗生素。对抑菌剂的研究表明,200 mg·L-1的头孢霉素浓度即可抑制农杆菌的滋生,且对绿洲3号愈伤组织的分化没有表现出明显的毒害作用,与姜清彬[21]使用200 mg·L-1的头孢霉素对细枝木麻黄(Casuarinacunninghamiana)遗传转化基本一致。
许多研究表明,受体材料在农杆菌侵染之前进行预培养具有重要的意义,可以促进伤口处的细胞分裂,从而使外源DNA更容易整合进组织或细胞,有利于提高转化效率[22]。在转化过程中,通过预培养可以减少污染率,如转化受体材料上带有病菌等,则在预培养中可被筛选掉。预培养的时间对转化率影响显著,如果预培养时间过长,会使转化率下降,可能是由于转化受体材料伤口的愈合。因此,本研究对绿洲3号组织分别进行0、1、2、3 d的预培养时间设定,从而进行正交实验筛选,结果表明,预培养时间为3 d为最适时间。
农杆菌在侵染的过程中菌液浓度过低或侵染时间过短时,会使受体材料与农杆菌不能充分接触,从而使转化率降低。在菌液浓度过高或侵染时间过长时会使受体材料伤口软腐坏死、褐化死亡,且筛选培养时农杆菌不易去除,从而影响转化率[23]。不同受体材料对菌液浓度的敏感性有一定的差异,一般菌液浓度范围OD600在0.05~0.70之间,侵染时间掌握在数分钟内。本研究设计的菌液浓度OD600(0.1、0.2、0.4、0.6)及农杆菌侵染时间(5、10、20、30 min),而进行正交实验筛选。结果表明筛选的最适菌液浓度OD600为0.1,最适农杆菌侵染时间为10 min。
研究表明,共培养是决定遗传转化能否成功的关键,农杆菌附着在受体材料表面后不能立即转化,只有在受体材料伤口部位生存16 h后农杆菌才能诱发肿瘤[24]。使外源基因整合进植物基因组中需适宜的共培养时间。因此,本研究需要对愈伤组织进行共培养,设计共培养时间(1、2、3、4 d)。乙酰丁香酮(AS)广泛应用于农杆菌介导植物遗传转化中,是一种酚类化合物[25]。乙酰丁香酮能诱导农杆菌VIr基因表达及活化,从而促进T-DNA的转移[26]。由于单子叶植物伤口细胞不能释放酚类化合物,因此本研究在共培养基中加入AS浓度(0、100、200、300 μmoL·L-1),而进行正交实验筛选。结果表明,在共培养基中加入的最适AS浓度为300 μmoL·L-1。
关于转化体系建立的报道已有不少,但研究者大都针对单因素试验的效应开展研究各个因素的最佳水平[27],而单因素试验结果的判断缺乏一定的标准和量化,且试验过程繁琐,从整体上考虑各因素的交换作用与综合影响不能兼顾[28]。本研究以绿洲3号愈伤组织为材料,采用正交设计,对农杆菌介导的绿洲3号愈伤组织遗传转化体系中的预培养时间、菌液浓度、共培养AS浓度、农杆菌侵染时间和共培养时间5因素4水平进行系统研究。最终建立农杆菌介导的绿洲3号愈伤组织转化体系:绿洲3号愈伤组织预培养3 d、菌液浓度OD600测定值为0.1、共培养的AS浓度为300 μmol·L-1、农杆菌侵染时间为10 min、共培养时间1 d为最佳遗传转化体系。
本研究以绿洲3号愈伤组织为转化受体,头孢霉素(Cef)最适抑菌浓度为200 mg·L-1,潮霉素(Hyg)对愈伤组织增殖和分化最佳筛选浓度分别为80和60 mg·L-1。经农杆菌LBA404侵染和筛选培养基筛选,最后经过GUS表达,表达率为1.5%。与发展较完善的谷子(Setariaitalica)转基因体系和水稻(Oryzasativa)转基因体系等相比,绿洲3号的转基因成功率有待进一步的提高。
References:
[1] 林占熺.菌草学.第三版.北京:国家行政学院出版社,2013:4.
Lin Z X.JUNCAO Science.3rd Edition.Beijing:National School of Administration Press,2013:4.(in Chinese)
[2] 林志魁,罗宗志,梅兰,刘宏伟,吴金寿,林占熺.芦竹属新材料绿洲3号的愈伤组织诱导.草业科学,2016,33(10):2012-2018.
Lin Z K,Luo Z Z,Mei L,Liu H W,Wu J S,Lin Z X.Study on callus introductions of Lvzhou No.3:A new material of arundo.Pratacultural Science,2016,33(10):2012-2018. (in Chinese)
[3] 赵丽萍,许卉.芦竹在滨海盐碱地的开发应用及栽培技术.北方园艺,2007(7):164-165.
Zhao L P,Xu H.The application and cultivation techniques ofArundodonaxin the coastal saline-alkali soil.Northern Horticulture,2007(7):164-165.(in Chinese)
[4] 宋宏伟,秦韧,郑存虎.野生植物芦竹在黄河三角洲盐碱地的人工栽培技术.当代生态农业,2003(1):68-71.
Song H W,Qin R,Zhen C H.The artificial cultivation techniques ofArundodonaxinthe saline alkali land of Yellow River Delta.Contemporary Eco-Agriculture,2003(1):68-71.(in Chinese)
[5] 高洁.萱草再生体系的优化及农杆菌介导的遗传转化体系的建立.成都:四川农业大学硕士学位论文,2012.
Gao J.Optimization of regeneration system and establishment of agrobacterium-mediated transformation system of daylily.Master Thesis.Chengdu:Sichuan Agricultural University,2012.(in Chinese)
[6] Wang J D,Shi L,Chen X J,Zhang L,Song Y X.Removal of endosymbiosis agrobacterium from transgenic potato.Agricultural Science &Technology,2011,12(11):1576-1579.
[7] 苏秀娟,王莉萍,代培红,陈全家,曲延英.英国薰衣草叶盘遗传转化体系的创建.新疆农业科学,2015,52(3):517-522.
Su X J,Wang L P,Dai P H,Chen Q J,Qu Y Y.Agrobacterium tumefactions-mediated genetic transformation of leaf in English Lavender.Xinjiang Agricultural Sciences,2015,52(3):517-522.(in Chinese)
[8] 崔澂.植物激素与细胞分化及形态发生的关系.中国细胞生物学学报,1983,5(2):3-8.
Cui C.The relationship between plant hormones and cell differentiation and morphogenesis.Chinese Journal of Cell Biology,1983,5(2):3-8.(in Chinese)
[9] 唐玉林,陈婉芬,周燮.烟草叶块根芽过程中内源激素水平变化.南京农业大学学报,1996,19(2):12-16.
Tang Y L,Chen W F,Zhou X.The changes of endogenous level of plant hormones during root and bud formation in tobacco leaf explants.Journal of Nanjing Agricultural University,1996,19(2):12-16.(in Chinese)
[10] Bhaskaran S,Smith R H.Regeneration in cereal tissue culture:A review.Crop Science,1990,30:1328-1337.
[11] 吴丽芳,陆伟东,丁伟,张鸭关.不同激素配比对红掌叶片愈伤组织诱导的影响.贵州农业科学,2012,38(8):17-18.
Wu L F,Lu W D,Ding W,Zhang Y G.Effect of different hormones combination on callus induction ofAnthuriumandraeanum.Guizhou Agricultural Sciences,2012,38(8):17-18.(in Chinese)
[12] 仝爱群.桑树组培快繁技术研究.泰安:山东农业大学硕士学位论文,2007.
Tong A Q.The tissue culture and the fast propagation for mulberry.Master Thesis.Tai’an:Shangdong Agricultural University,2007.(in Chinese)
[13] 李晓强,卜崇兴,郭世荣.菇渣复合基质栽培对蔬菜幼苗生长的影响.沈阳农业大学学报,2006,37(3):517-520.
Li X Q,Bu C X,Guo S R.Effects of compound substrate of mushroom residue on growth of some vegetables seedlings.Journal of Shenyang Aricultural University,2006,37(3):517-520.(in Chinese)
[14] 梁丽红,杨春鹏.食用菌菌糠的循环利用.蔬菜,2012(8):25-26.
Liang L H,Yang C P.The recycle utilization of spent mushroom substrates.Vegetables,2012(8):25-26.(in Chinese)
[15] 朱华芳,罗玉兰,胡永红,史益敏.萱草属部分种和园艺品种的SSR多态性分柝.上海交通大学学报(农业科学版),2009,27(2):143-148.
Zhu H F,Luo Y L,Hu Y H,Shi Y M.Analysis of a section ofHemerocallisspecies and varieties by SSR-PCR.Journal of Shanghai Jiaotong University(Agricultural Science),2009,27(2):143-148.(in Chinese)
[16] Firoozabady E,Moy Y,Courtneygutterson N,Robinson K.Regeneration of transgenic rose (Rosahybrid) plants from embryogenic tissue.Nature Biotechnology,1994,12:609-613.
[17] 高莉萍,包满株.月季的植株再生及遗传转化研究进展.植物学通报,2005,22(2):231-237.
Gao L P,Bao M Z.Advances in plant regeneration and genetic transformation of roses.Chinese Bulletin of Botany,2005,22(2):231-237.(in Chinese)
[18] 梁美霞,许向阳,李景富.抗生素对番茄愈伤组织诱导和分化的影响.东北农业大学学报,2005,36(1):19-22.
Liang M X,Xu X Y,Li J F.Effect of antibiotics on the induction and differentiations of tomato callus.Journal of Northeast Agricultural University,2005,36(1):19-22.(in Chinese)
[19] 蒋卫东.川芎组织培养及不同抗生素种类和浓度对川芎培养影响的研究.成都:四川大学硕士学位论文,2007.
Jiang W D.Studies on tissue culture and effects of different antibiotics at various concentrations on culture ofLigusticumchuanxionghort.Master Thesis.Chengdu:Sichuan Agricultural University,2007.(in Chinese)
[20] 康杰芳,王喆之.头孢霉素类抗生素在转基因烟草中作用的初步研究.西北植物学报,2003,23(1):60-63.
Kang J F,Wang Z Z.Primary studies on function of cephalosporins antibiotics in transgenic tobacco.Acta Botanica Boreali-Occidentalia Sinica,2003,23(1):60-63.(in Chinese)
[21] 姜清彬.细枝木麻黄再生体系及农杆菌介导遗传转化研究.北京:中国林业科学研究院博士学位论文,2011.
Jiang B Q.Studies on regeneration system andAgrobacteriumtumefaciens-mediated genetic transformation inCasuarinacunninghamianamiq.PhD Thesis.Beijing:Chinese Academy of Forestry,2011.(in Chinese)
[22] 王凯,车代弟,王金刚,樊金萍.百合遗传转化体系的建立.东北农业大学学报,2008,39(5):39-43.
Wang K,Che D D,Wang J G,Fan J P.Establishment of genetic transformation system of Lily.Journal of Northeast Agricultural University,2008,39(5):39-43.(in Chinese)
[23] 柴燕文.PBI121-Lyz-GFP基因表达载体的构建及其对紫花苜宿愈伤组织的转化.兰州:甘肃农业大学硕士学位论文,2008.
Chai Y W.Construction ofPBI121-Lyz-GFPexpression vector and its expression in the callus of alfalfa.Master Thesis.Lanzhou:Gansu Agricultural University,2008.(in Chinese)
[24] 王关林,方宏筠.植物基因工程原理与技术.北京:科学出版社,1998:179-634.
Wang G L,Fang H Y.Principles and Techniques of Plant Genetic Engineering.Beijing:Science Press,1998:179-634.
[25] 邓艺,曾炳山,赵思东,刘英,裘珍飞,李湘阳,王曙.乙酰丁香酮在农杆菌介导的遗传转化中的作用机制及应用.安徽农业科学,2010,38(5):2229-2232.
Deng Y,Zeng B S,Zhao S D,Liu Y,Qiu Z F,Li X Y,Wang S.Mechanism and application of acetosyringone inAgrobacterium-mediated transformation.Journal of Anhui Agricultural Sciences,2010,38(5):2229-2232.(in Chinese)
[26] Sakae S,Kanyaratt S,Masahiro M.Masaru N.Production of transgenic plants of the Liliaceous ornamental plantAgapanthuspraecoxssp. orientials (Leighton) Leighton viaAgrobacterium-mediated transformation of embryogenic calli.Plant Science,2001,161:89-97.
[27] 汪结明,项艳,吴大强,孙志娟,蔡诚.杨树ISSR反应体系的建立及正交设计优化.核农学报,2007,21(5):470-473.
Wang J M,Xiang Y,Wu D Q,Sun Z J,Cai C.Establishment of an ISSR reaction system for poplar and optimization using orthogonal design.Journal of Nuclear Agricultural Sciences,2007,21(5):470-473.(in Chinese)
[28] 谢运海,夏德安,姜静,林静.利用正交设计优化水曲柳ISSR-PCR反应体系.分子植物育种,2005,3(3):445-450 .
Xie Y H,Xia D A,Jiang J,Lin J.Optimization for ISSR-PCR system ofFraxinusmandshuricaRupr. using orthogonal design.Molecular Plant Breeding,2005,3(3):445-450.(in Chinese)
