花椒麻素对SD雄性大鼠骨骼肌蛋白质代谢的影响及机理
2018-03-20任廷远阚建全
任廷远,阚建全*
(西南大学食品科学学院,重庆 400715)
花椒(Zanthoxylum bungeanum Maxim.)是芸香科(Rutaceae)花椒属(Zanthoxylum)植物,其果实是我国传统的“八大调味品”之一,也是我国传统中药。花椒在全世界约有250 种,主要分布在非洲、亚洲、美洲及大洋洲的热带和亚热带地区[1]。现在研究报道的花椒麻素主要有山椒素等14 种[2],主要包括α-山椒素、β-山椒素、γ-山椒素以及它们在氨基部分含有一个羟基的同系物[3-4]。
目前关于花椒麻素对机体功能的研究主要集中在减肥、降脂、抗氧化、降血糖等方面[5-7]。其中关于花椒麻素促进体内脂肪的氧化,减少脂肪沉积和血浆中甘油三酯浓度的效果的研究较多。2014年,陈朝军等[8]发现灌胃不同配比的花椒麻素与辣椒素能延缓大鼠的体质量增加,降低大鼠的血脂和肝脂水平,减轻大鼠的脂肪肝症状,对胆固醇代谢循环有较好效果;2014年,吕娇[9]研究表明,麻味麻素可升高高脂血症大鼠回肠胆汁酸代谢基因表达和降低高脂血症大鼠肝脏内胆固醇代谢基因表达,降低其体内血脂、肝脂含量,从而调节胆固醇在体内的代谢循环作用;2014年,任文瑾[10]研究表明,花椒精、花椒挥发油和花椒麻素均有调节血脂的作用,作用效果花椒麻素>花椒精>花椒挥发油,花椒麻素与花椒精调节肝脏胆固醇代谢的效果相近,但花椒麻素降低甘油三酯的效果优于花椒精。然而花椒麻素降脂过程中如何促进蛋白沉积并不明确,严重防碍了花椒麻素生理功能的全面评价,因此有必要研究花椒麻素对机体蛋白质代谢的影响及机理,为花椒麻素在医药上的应用提供科学的理论参考。肝脏是哺乳动物蛋白质代谢最活跃的器官,蛋白质代谢的许多重要反应都是在肝脏中进行的;肌肉是贮存氨基酸的主要场所,其氨基酸含量占氨基酸代谢库的50%~75%[11]。现已研究证实,胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ,IGF-Ⅰ)是主要由肝脏分泌的调控动物生长发育的关键因子,对蛋白质代谢具有重要的调节作用[12]。肌肉质量的增长是蛋白质沉积的最直观表现之一,而肌肉的发育受到肌细胞生成素(myogenin,MyoG)等肌肉生长调控因子的调节[13]。前期的实验发现花椒麻素可以增加SD大鼠相对骨骼肌的质量,但具体机理十分不清楚。因此,本实验以健康SD雄性大鼠为动物模型,采用荧光实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)方法,研究花椒麻素对机体蛋白质代谢相关基因的影响,初步探讨花椒麻素对SD大鼠蛋白质代谢的机理。
1 材料与方法
1.1 动物、材料与试剂
SD雄性大鼠(动物许可证号:SCXK(渝)20120008,体质量120~140 g,40 只) 重庆腾鑫生物技术有限公司。
花椒麻素由实验室自制,纯度为95.7%。
大鼠基础饲料 重庆腾鑫生物技术有限公司;总蛋白质(total protein,TP)、血尿素氮(blood urine nitrogen,BUN)、肌酐(creatinine,Cr)等指标测定试剂盒 南京建成生物工程研究所;IGF-Ⅰ的测定试剂盒美国ADL公司;[14C]-苯丙氨酸 中国原子能科学研究院。
1.2 仪器与设备
3-18K冷冻离心机 德国Sigma公司;7020全自动生化分析仪、L-8800全自动氨基酸分析仪 日本日立公司;H1MG酶标仪 美国基因有限公司;UV-2450紫外分光光度计 日本岛津公司;NanoDrop 1000微量紫外分光光度计 美国Thermo公司;S1000梯度PCR仪美国Bio-Rad公司;Light Cycler Nano qPCR仪 美国罗氏公司。
1.3 方法
1.3.1 动物饲养与样品采集
动物实验过程遵循现行的经西南大学动物保护委员会批准的动物保护法。将40 只SD雄性大鼠按体质量随机分为空白对照组、花椒麻素高剂量组(8 mg/(kg·d))、中剂量组(4 mg/(kg·d))和低剂量组(2 mg/(kg·d)),各组10 只。每只大鼠分别饲养在不锈钢笼里(25 cm×15 cm×15 cm),控制恒温恒湿的房间,温度保持在(25±1)℃,相对湿度55%,从早上7点开始12 h为周期循环昼夜。每天15:00对实验组灌胃花椒麻素,花椒麻素需溶于大豆油中配成溶液。灌胃剂量均为0.1 mL/100 g(以体质量计),空白对照组灌胃等剂量的大豆油。饲养期间自由采食基础饲料和饮水,每3 d称量一次大鼠体质量,同时调整灌胃量,每天记录大鼠采食量。喂养28 d,禁食12 h后称体质量。颈椎脱臼法处死大鼠。采集大鼠的血液于离心管中进行离心后采集血清。取肝脏、左侧骨骼肌、肾脏等,样品称质量后用液氮冷冻于-80 ℃备用。
3天后,王敬凯等开车去山上查看情况。他们看到第一棵松树下土面上的记号没被破坏,说明瓶子没动,第二棵松树下的土壤变松,表面记号已不在。王敬凯从土中抠出了一个小瓶。
1.3.2 腹脂率、组织相对质量和饲料效率的测定
腹脂率、组织相对质量和饲料效率分别根据公式(1)~(3)计算。

1.3.3 生理生化指标分析
饲料和粪便TP的测定采用凯氏定氮法测定。血清和骨骼肌中TP、BUN、Cr水平采用试剂盒测定,血清中胰岛素和IGF-Ⅰ的含量根据试剂盒,采用酶联免疫法测定,血清及组织中氨基酸分析采用全自动氨基酸分析仪进行。
1.3.4 花椒麻素对大鼠骨骼肌蛋白质合成代谢与分解代谢的分析
蛋白质合成代谢采用离体培养骨骼肌肉,检测单位时间内掺入[14C]-苯丙氨酸(0.05 μCi/mL)的放射性含量[14]。新鲜的左测骨骼肌称质量后,置于5 mL DMEM细胞培养基中37 ℃充氧孵育30 min,然后在含有[14C]-苯丙氨酸的DMEM中继续孵育1 h。磷酸盐缓冲液洗3 次,肌肉进行匀浆,加入10%三氯乙酸(trichloroacetic acid,TCA)沉淀蛋白质,吸弃上清液,加入0.5 mol/L NaOH溶解沉淀的蛋白,取90%加入闪烁液进行液闪计数据,取10%采用BCA法测蛋白质量浓度。
采用检测量培养液中酪氨酸释放率分析骨骼蛋白质分解代谢[15]。左则骨骼肌称质量后,浸没在Basal-Krebs-Ringer缓冲液中,37 ℃充氧孵育2 h,取培养液用TCA沉淀后,取0.5 mL上清液于2 mL离心管中,然后加入1.0 mL 5% TCA混匀后,依次加入0.75 mL硝酸、0.75 mL 1-亚硝基-2-萘酚,混匀,55 ℃温育30 min,加入二氯乙烷萃取,提取上清液200 μL进行测定。
1.3.5 肝脏和骨骼肌中关键基因qPCR的分析
利用试剂盒提取和反转录获得cDNA,紫外分光光度计测定RNA浓度和纯度(OD260nm/OD280nm)。采用qPCR分析肝脏和骨骼肌中关键基因;内参基因为β-肌动蛋白基因(β-actin);qPCR引物序列见表1。10 μL qPCR反应体系包含:4.2 μL SYBR Green Supermix,4.2 μL DEPC水,100 ng/μL cDNA模板1.0 μL,20 μmol/L上、下游引物各0.3 μL。qPCR反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,65 ℃ 5 s,40 次循环;95 ℃ 5 s。每个样品均设置3 次重复。

表1 qPCR引物序列Table1 Primers used for qPCR analysis
1.4 数据统计分析
2 结果与分析
2.1 花椒麻素对SD大鼠生长的影响
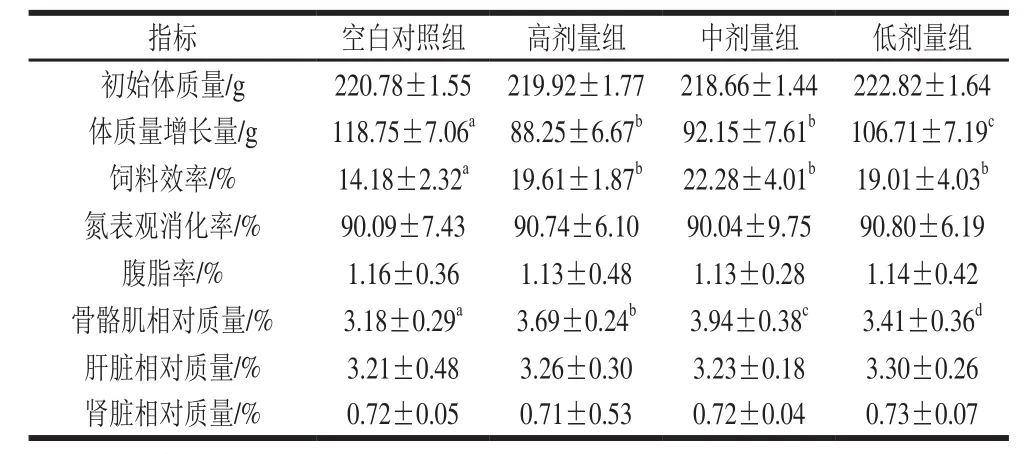
表2 花椒麻素对大鼠生长率的影响Table2 Effect of alkylamides on the growth rate of rats
由表2可知,与空白对照组相比,3 个剂量花椒麻素均显著降低实验大鼠体质量(P<0.05);花椒麻素显著增加大鼠饲料效率(P<0.05);花椒麻素对大鼠的氮表观消化率均没有显著影响。花椒麻素中可显著提高大鼠骨骼肌相对质量(P<0.05),对其他脏器的相对质量没有明显影响。花椒麻素有降低腹脂率的趋势,但未达到统计学的显著水平。
2.2 生理生化指标
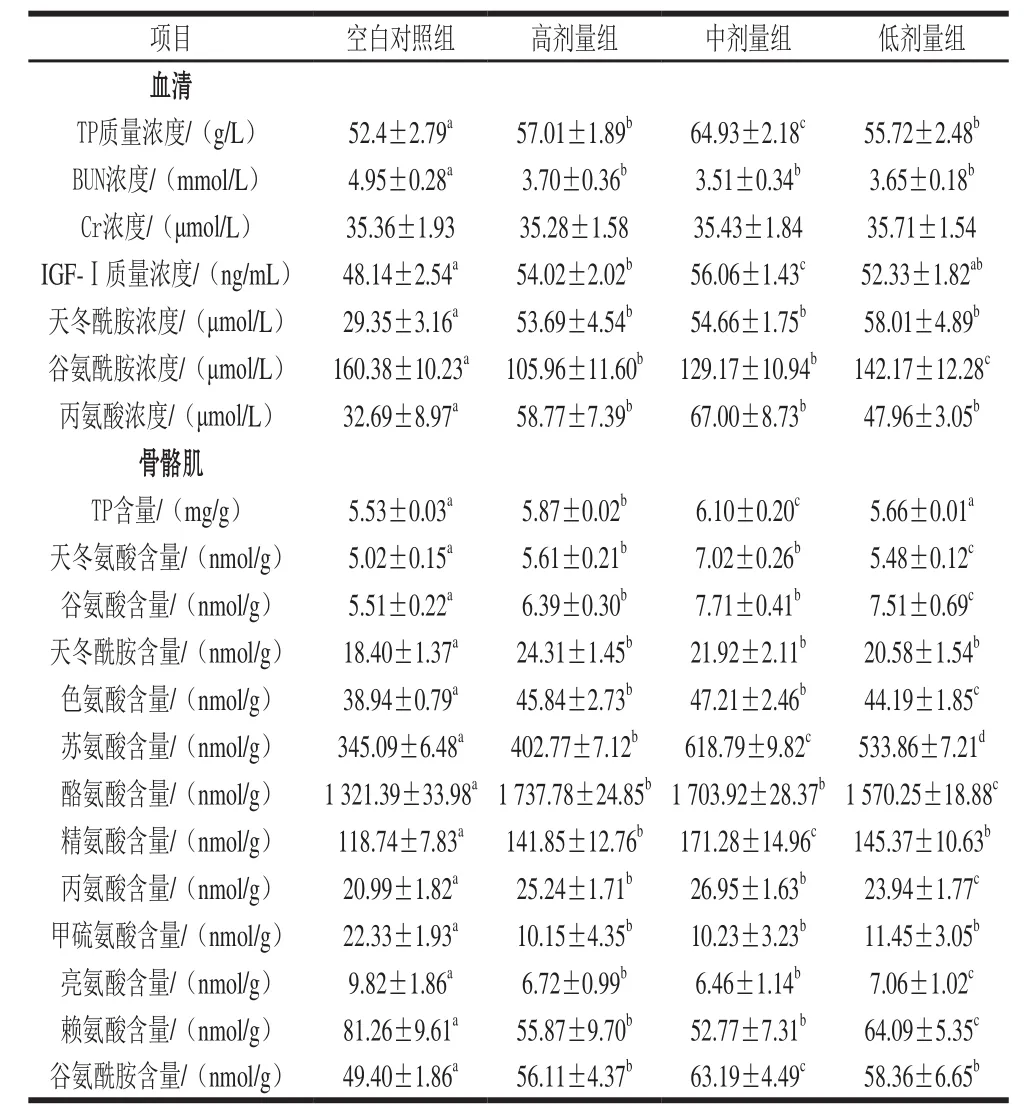
表3 花椒麻素对大鼠血清生理生化及组织氨基酸的影响Table3 Effect of alkylamides on plasma parameters in serum and amino acids in muscle
由表3可知,与空白对照组相比,花椒麻素显著升高血清和骨骼肌中TP水平(P<0.05);显著升高血清中IGF-Ⅰ的质量浓度(P<0.05);显著降低BUN浓度(P<0.05);对实验大鼠血清Cr浓度影响不显著。推测花椒麻素有降低机体蛋白分解,增加蛋白质沉积的可能。
另外与空白对照组比,花椒麻素显著上调血清中天冬酰胺(Asn)和丙氨酸(Ala)浓度,显著下调谷氨酰胺(Gln)的浓度(P<0.05);显著上调大鼠骨骼肌中多数生糖氨基酸含量,其中,高剂量显著上调天冬氨酸(Asp)、Asn、色氨酸(Ser)、Ala、Gln、谷氨酸(Glu)、苏氨酸(Thr)、酪氨酸(Tyr)、精氨酸(Arg)的含量(P<0.05);中剂量显著上调Asp、Glu、Sre、Tyr、Arg、Ala、Asn、Thr、Gln的含量(P<0.05);低剂量显著上调Glu、Asp、Asn、Sre、Ala、Thr、Tyr、Arg、Gln的含量(P<0.05);3 个剂量花椒麻素均显著降低甲硫氨酸(Met)的含量(P<0.05)。与生糖氨基酸有所不同,灌胃花椒麻素对大鼠骨骼肌中兼生氨基酸、生酮氨基酸和支链氨基酸的影响主要表现在下调其含量。对大鼠血清和骨骼肌中其他各种检测到的氨基酸含量无显著影响。
2.3 花椒麻素对骨骼蛋白质合成与分解代谢的影响
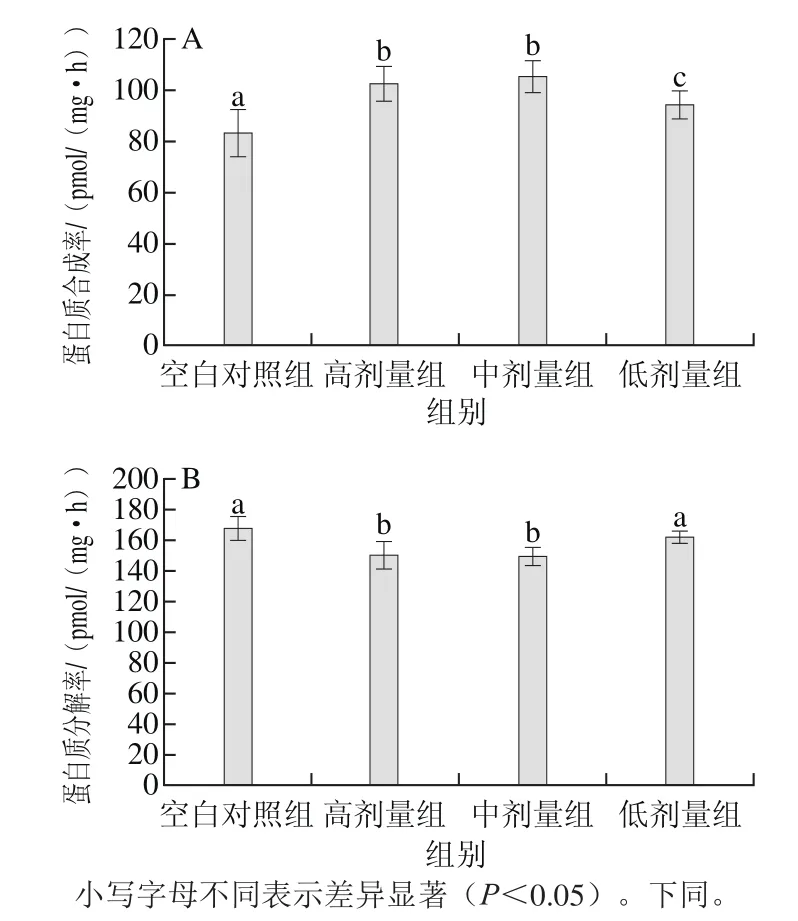
图1 花椒麻素对骨骼蛋白质合成(A)与分解代谢(B)的影响(n= 10)Fig.1 Effect of alkylamides on protein synthesis (A) and degradation (B) (n = 10)
由图1可知,与空白对照组相比,经过28 d花椒麻素灌胃后,高剂量组、中剂量组、低剂量组大鼠骨骼肌中蛋白质合成率分别增加了23.06%、26.39%、13.41%(P<0.05);而蛋白质分解代谢分别降低了10.44%、10.99%、3.46%。体外实验同样说明花椒麻素使大鼠骨骼肌中蛋白质合成代谢增加,分解代谢降低。
2.4 花椒麻素对肝脏及骨骼中IGF-Ⅰ和IGF-ⅠR mRNA相对表达量的影响
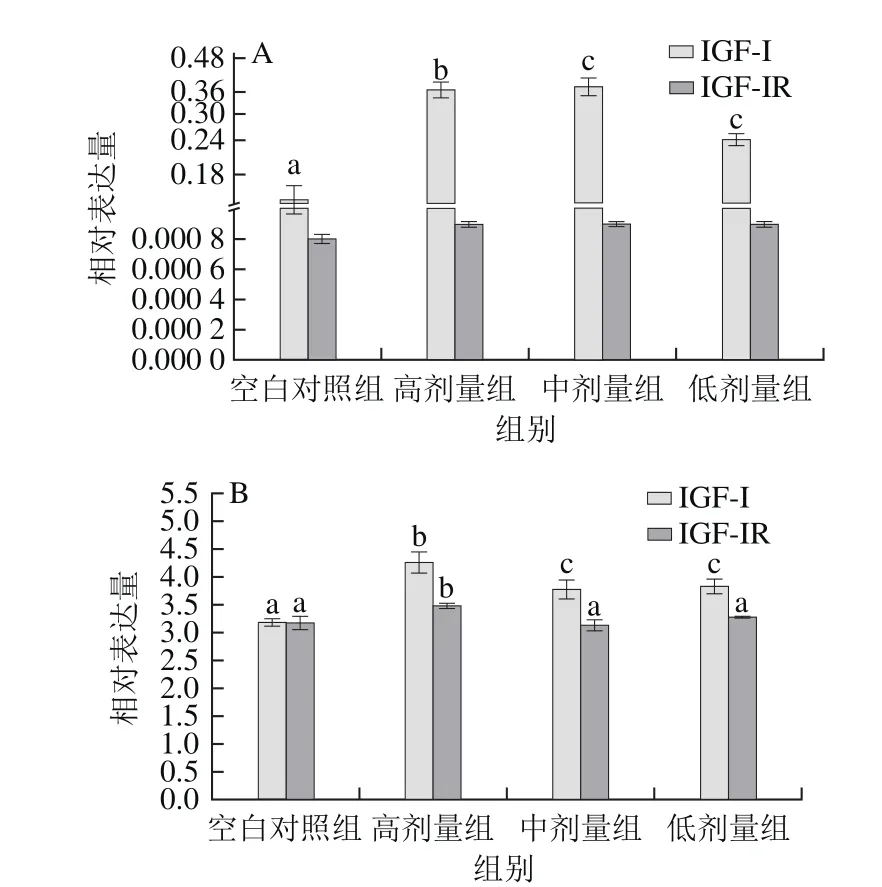
图2 花椒麻素对肝脏(A)及骨骼组织(B)中IGF-Ⅰ和IGF-ⅠR的mRNA相对表达量的影响Fig.2 Effect of alkylamides on mRNA expression of IGF-I and IGF-IR in liver (A) and muscle (B) of healthy SD rats
与空白对照组比较,3 个剂量的花椒麻素显著上调大鼠肝脏中IGF-Ⅰ基因mRNA的相对表达量(P<0.05);花椒麻素对大鼠肝脏胰岛素样生长因子受体-Ⅰ(insulin growth factor receptor,IGF-ⅠR)基因mRNA相对表达量有上调趋势,但不显著(图2A)。另外花椒麻素显著上调大鼠骨骼肌中的IGF-Ⅰ mRNA相对表达量(P<0.05);高剂量的花椒麻素显著上调大鼠骨骼肌中IGF-ⅠR mRNA相对表达量(P<0.05),中剂量和低剂量影响不显著(图2B)。
2.5 花椒麻素对健康SD大鼠骨骼肌中关键生长因子基因mRNA相对表达量的影响
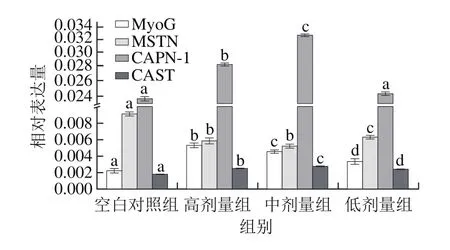
图3 花椒麻素对健康SD大鼠骨骼肌中关键生长因子mRNA表达量的影响Fig.3 Effect of alkylamides on mRNA expression of critical growth factor genes in skeletal muscle tissue of healthy SD rats
由图3可知,3 个剂量的花椒麻素显著上调大鼠骨骼肌中MyoG和钙蛋白酶抑制蛋白(calpastatin,CAST)mRNA相对表达量(P<0.05);显著下调大鼠骨骼肌中肌肉生长抑制素(myostatin,MSTN)mRNA相对表达量(P<0.05);3 个剂量的花椒麻素均上调钙蛋白酶-1(μ-calpain,CAPN-1)基因mRNA表达量,其中,高剂量组和中剂量组上调显著(P<0.05),低剂量组有上调趋势,但不显著。
3 讨 论
花椒麻素对大鼠生长性能的影响主要体现在两个方面:一是能够降低大鼠体内脂肪的沉积;二是显著地提高实验组大鼠骨骼肌相对质量。大鼠体质量的降低可能是由于脂肪沉积的减少所致,说明花椒麻素具有降低脂肪含量、增强蛋白质沉积作用。另外灌胃花椒麻素对大鼠主要脏器相对质量没有显著影响(表2),这也间接说明实验设计的花椒麻素剂量不影响大鼠正常的生理机能。该结果从表观水平上说明花椒麻素对大鼠蛋白质代谢具有积极的调节作用。
BUN的水平可反映动物蛋白质代谢状况,并可作为机体氮利用和蛋白质沉积的指标,BUN水平降低可增加氮沉积,提高蛋白质合成量[17]。本实验结果表明,3 个剂量的花椒麻素对实验大鼠BUN水平均有显著降低的影响(P<0.05)(表3);Cr是肌细胞中磷酸肌酸的代谢终产物,正常情况下,机体内血清Cr水平保持基本稳定[18]。实验结果表明,3 个剂量的花椒麻素对实验大鼠血清Cr水平影响不显著(表3),表明实验设计剂量不影响大鼠的肾小球排泄。血清TP作为动物重要的生化指标,其水平在一定程度上反映了体内蛋白沉积的水平[19]。以上结果表明,花椒麻素可以显著升高大鼠血清TP水平,说明其蛋白质沉积增强(表3)。
灌胃花椒麻素可显著升高大鼠血清中(Asn、Ala)浓度和骨骼肌中(Asp、Glu、Ser、Tyr、Arg、Ala、Asn、Thr、Gln)的含量,这些氨基酸多为非必需性氨基酸,其来源主要是机体蛋白质的分解或者利用相应α-酮酸自身合成,结合表观水平的蛋白质合成增加,推测花椒麻素对实验大鼠生糖氨基酸含量的升高主要是由于自身合成增加。α-酮酸是机体糖代谢的中间产物,是机体供能充足的情况下,氨基酸通常不参与或很少参与供能[20],而是作为合成蛋白质的原料,最终导致蛋白质合成增加。同时实验组大鼠血清中Gln含量显著降低、骨骼肌中Gln含量显著升高,提示蛋白质分解减弱、在骨骼肌中沉积增强,最终表现为骨骼肌相对质量的增加。另外,体外实验同样说明花椒麻素可显著增加大鼠蛋白质合成代谢,降低蛋白质分解代谢(图2A、B)。
血清中的IGF-Ⅰ主要由肝脏产生,之后分泌进入血液,与血液中胰岛素样生长因子结合蛋白结合后,被运输到周边组织发挥作用[21-22]。IGF-Ⅰ能促进骨骼肌中蛋白质的合成,刺激卫星细胞分化与增殖,有增强骨骼肌创伤后再生的作用[23]。IGF-Ⅰ能增进鸟氨酸脱羧酶的活性,促进DNA、RNA和蛋白质合成,最终导致细胞增殖[24]。花椒麻素可显著上调肝脏和骨骼肌中IGF-ⅠmRNA的表达量,并对肝脏和骨骼肌IGF-ⅠR mRNA表达量有上调趋势(图2A、B)。结合血清中IGF-Ⅰ的含量显著增加(表3),由此推测,花椒麻素生物作用的发挥可能由IGF-Ⅰ介导。
MyoG在肌肉的萎缩、生长发育以及肌肉的再生中起作重要作用,并在肌肉分化过程中起中心调节作用[25-26]。由图3可知,与空白对照组比较,3 个剂量的花椒麻素显著(P<0.05)上调大鼠骨骼肌中MyoG mRNA表达量。说明花椒麻素对肌细胞的生长具有一定的促进作用。而MSTN具有抑制肌肉生长的功能,其表达量与肌肉质量呈负相关[27]。花椒麻素对大鼠骨骼肌中MSTN mRNA表达量有显著(P<0.05)下调作用。MyoG的上调有利于肌肉的生长发育,而MSTN的下调有利于MyoG作用的发挥。因此,花椒麻素促进大鼠骨骼肌蛋白质沉积的作用与MyoG/MSTN系统有关。
CAPN-1对骨骼肌蛋白沉积有重要的调节作用,它能降解大量的肌原纤维和细胞的骨架蛋白,这一特性对肌肉蛋白质代谢更新起重要的作用[28]。由图3可知,花椒麻素均上调CAPN-1基因mRNA表达量,其中高剂量组和中剂量组上调显著(P<0.05),低剂量组有上调趋势,但不显著。CAST可调节骨骼肌中钙蛋白酶系统的活性[29]。CAST大量表达会抑制肌细胞的分解,减慢蛋白质的降解速率,有利于骨骼肌的生长[30]。从图3可知,与空白对照组相比较,3 个剂量组的花椒麻素均显著上调节CAST基因mRNA表达量(P<0.05)。CAPN-1基因的mRNA转录水平提示高、中剂量组大鼠的蛋白质代谢更新旺盛,CAST的显著上调说明对肌细胞分解减弱,蛋白质沉积作用加强,与骨骼肌相对质量的增加相吻合。因此,花椒麻素可能由CAPN-1/CAST系统加强骨骼肌蛋白质的更新,促进蛋白质的沉积。
4 结 论
灌胃花椒麻素可显著增加实验大鼠的骨骼肌相对质量,减少腹脂的沉积;显著提高实验大鼠血清和骨骼肌中TP水平,表明实验大鼠骨骼肌相对质量的增加是由蛋白质沉积所致。另外,花椒麻素可增加大鼠机体内蛋白质的合成速率,减少蛋白质的分解速率,骨骼肌蛋白质的增加是机体内蛋白质合成与分解的综合结果。花椒麻素促进实验大鼠骨骼肌蛋白质沉积的机理是由IGF-Ⅰ介导的,MyoG/MSTN系统和CAPN-1/CAST系统参与的最终结果。
此外,本研究发现花椒麻素对大鼠血清和骨骼肌中氨基酸组成有一定的影响,花椒麻素以何种细胞刺激信号来影响蛋白质合成与分解的机理还有待进一步研究。
[1] 蔡名雄. 四川花椒[M]. 成都: 四川大学出版社, 2013: 14-15.
[2] KASHIWADA Y, ITO C, KATAGIRI H, et al. Amides of the fruit of Zanthoxylum spp.[J]. Phytochemistry, 1997, 44(6): 1125-1127.DOI:10.1016/S0031-9422(96)00683-8.
[3] BAUTISTA D M, SIGAL Y M, MILSTEIN A D, et al. Pungent agents from Szechuan peppers excite sensory neurons by inhibiting two-pore potassium channels[J]. Nature Neuroscience, 2008, 11(7): 772-779.DOI:10.1038/nn.2143.
[4] 罗凯, 胡江, 黄秀芳, 等. 花椒麻味物质的提取分离及其组分分析[J].食品科学, 2013, 34(24): 88-91. DOI:10.7506/spkx1002-6630-201324018.
[5] TANG W Z, XIE Q M, GUAN J, et al. Phytochemical profiles and biological activity evaluation of Zanthoxylum bungeanum Maxim seed against asthma in murine models[J]. Journal of Ethnopharmacology,2014, 152(3): 444-450. DOI:10.1016/j.jep.2014.01.013.
[6] WU T T, ZHONG L J, HONG Z Y, et al. The effects of Zanthoxylum bungeanum extract on lipid metabolism induced by sterols[J]. Journal of Pharmacological Sciences, 2015, 127(3): 251-259. DOI:10.1016/j.jphs.2014.12.002.
[7] 游玉明, 周敏, 王倩倩, 等. 花椒麻素的抗氧化活性[J]. 食品科学,2015, 36(13): 27-31. DOI:10.7506/spkx1002-6630-201513006.
[8] 陈朝军, 刘芸, 陆红佳, 等. 花椒麻素与辣椒素的不同质量比对大鼠降血脂的协同作用[J]. 食品科学, 2014, 35(19): 231-235.DOI:10.7506/spkx1002-6630-201419046.
[9] 吕娇. 花椒麻素降血脂的功能性评价及作用机理的研究[D]. 重庆:西南大学, 2014: 21-48.
[10] 任文瑾. 花椒精调节体内脂质代谢机理的研究[D]. 重庆: 西南大学,2014: 29-57.
[11] YOU Yuming, REN Ting, ZHANG Shiqi, et al. Hypoglycemic effects of Zanthoxylum alkylamides by enhancing glucose metabolism and ameliorating pancreatic dysfunction in streptozotocin-induced diabetic rats[J]. Food and Function, 2015, 9(6): 3144-3154. DOI:10.1039/c5fo00432b.
[12] FRONTERA W R, OCHALA J. Skeletal muscle: a brief review of structure and function[J]. Calcif i ed Tissue International, 2015, 96(3):183-195. DOI:10.1007/s00223-014-9915-y.
[13] TANNENBAUM G S, GURD W, LAPOINTE M. Leptin is a potent stimulator of spontaneous pulsatile growth hormone (GH) secretion and the GH response to GH-releasing hormone 1[J]. Endocrinology,1998, 139(9): 3871-3875. DOI:10.1210/endo.139.9.6206.
[14] VOLTARELLI F A, DE MELLO M A. Spirulina enhanced the skeletal muscle protein in growing rats[J]. European Journal of Nutrition, 2008,47: 393-400. DOI:10.1007/s00394-008-0740-9.
[15] LI X, JUNG J J, NIE L, et al. The neuropilin-like protein ESDN regulates insulin signaling and sensitivity[J]. American Journal of Physiology, 2016, 310(9): 1184-1193. DOI:10.1152/ajpheart.00782.2015.
[16] CHANG Z, LING C, YAMASHITA M, et al. Microarray-driven validation of reference genes for quantitative real-time polymerase chain reaction in a rat vocal fold model of mucosal injury[J].Analytical Biochemistry, 2010, 406(2): 214-221. DOI:10.1016/j.ab.2010.07.021.
[17] 王兴涛, 雷耀庚, 李碧波, 等. 日粮蛋白水平和采精频率对绒山羊血清生化指标及生殖激素的影响[J]. 西北农林科技大学学报(自然科学版), 2016, 44(12): 45-50. DOI:10.13207/j.cnki.jnwafu.2016.12.007.
[18] MOHABBATI-KALEJAHI E, AZIMIRAD V, BAHRAMI M, et al.A review on creatinine measurement techniques[J]. Talanta, 2012,97(15): 1-8. DOI:10.1016/j.talanta.2012.04.005.
[19] FRIESEN O D, GUENTER W, MARQUARDT R R, et al. The effect of enzyme supplementation on the apparent metabolizable energy and nutrient digestibilities of wheat, barley, oats, and rye for the young broiler chick[J]. Poultry Science, 1992, 71(10): 1710-1721.
[20] WU G Y. Amino acids: metabolism, functions, and nutrition[J].Amino Acids, 2009, 37(1): 1-17. DOI:10.1007/s00726-009-0269-0.
[21] MOORMAN B P, YAMAGUCHI Y, LERNER D T, et al. Rearing Mozambique tilapia in tidally-changing salinities: effects on growth and the growth hormone/insulin-like growth factor I axis[J].Comparative Biochemistry and Physiology, 2016, 198: 8-14.DOI:10.1016/j.cbpa.2016.03.014.
[22] RUTANEN E M. Insulin-like growth factor and insulin-like growth factor binding proteins in the endometrium. effect of intrauterine levonorgestrel delivery[J]. Human Reproduction, 2000, 15: 173-181.
[23] HUSMANN I, SOULET L, GAUTRON J, et al. Growth factors in skeletal muscle regeneration[J]. Cytokine and Growth Factor Reviews,1996, 7(3): 249-258. DOI:10.1016/S1359-6101(96)00029-9.
[24] BONJOUR J P. The dietary protein, IGF-Ⅰ, skeletal health axis[J].Hormone Molecular Biology and Clinical Investigation, 2016, 28(1):39-53. DOI:10.1515/hmbci-2016-0003.
[25] YIN H D, LI D Y, WANG Y, et al. Myogenic regulatory factor(MRF) expression is affected by exercise in postnatal chicken skeletal muscles[J]. Gene, 2015, 561(2): 292-299. DOI:10.1016/j.gene.2015.02.044.
[26] BAMMAN M M, HILL V J, ADAMS G R, et al. Gender differences in resistance-training-induced myofiber hypertrophy among older adults[J]. Journals of Gerontology, 2003, 58(2): 108-116.
[27] KORNEGAY J N, BOGAN D J, BOGAN J R, et al. Dystrophindeficient dogs with reduced myostatin have unequal muscle growth and greater joint contractures[J]. Skeletal Muscle, 2016, 4(6): 1-17.DOI:10.1186/s13395-016-0085-7.
[28] POMPEANI N, RYBALKA E, LATCHMAN H, et al. Skeletal muscle atrophy in sedentary Zucker obese rats is not caused by calpainmediated muscle damage or lipid peroxidation induced by oxidative stress[J]. Journal of Negative Results in Biomedicine, 2014, 13(1):1-11. DOI:10.1186/1477-5751-13-11.
[29] NORTH M K, FRYLINCK L, HOFFMAN L C. The physical and biochemical changes in springbok (Antidorcas marsupialis)Longissimus thoracis et lumborum and Biceps femoris muscle during ageing[J]. Meat Science, 2015, 110: 145-152. DOI:10.1016/j.meatsci.2015.07.009.
[30] WENDT A, THOMPSON V F, GOLL D E. Interaction of calpastatin with calpain: a review[J]. Biological Chemistry, 2004, 385(6): 465-472. DOI:10.1515/BC.2004.054.
