乳源酪蛋白糖巨肽对结肠癌HT-29细胞抗炎及血管生成因子表达水平的影响
2018-03-20王秋萍曹江鸣崔文静马新颖赵林森闫亚丽陈庆森
王秋萍,贾 彦,曹江鸣,赵 培,崔文静,马新颖,赵林森,闫亚丽,*,陈庆森,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.河北一然生物科技有限公司,河北 石家庄 050899)
乳源酪蛋白糖巨肽(casein glycomacropeptide,CGMP)除了具有良好的营养特性之外,还有提高智力发育、促益生菌增殖以及免疫调节等活性[1-8]。结直肠癌是人类常见的消化道恶性肿瘤之一,其发生发展和转移是一个由遗传和环境等诸多因素经过多步骤及内外因交互作用的结果,目前大多数学者认为结直肠癌的主要发病机制分为原癌基因和抑癌基因的突变、基因组的不稳定性[9];其中基因组不稳定性包括染色体不稳定、微卫星不稳定和核苷酸对(CpG island,GPG)、甲基化表型[10]、锯齿状途径[11]。部分研究学者还认为炎症、肿瘤与结直肠癌密切相关,尤其是炎症性肠病最可能发展成结直肠癌,有报道指出约20%的溃疡性结肠炎患者在发病后的30 年左右可发展成结直肠癌[12]。核转录因子(nuclear transcription factor,NF)-κB广泛存在于哺乳动物细胞中,在60%~80%的结肠癌细胞中都有所表达,约40%的结肠癌细胞中表现有NF-κB的活性,处于活性状态的NF-κB开启了调控一系列炎症靶基因的工作,使其在细胞周期、凋亡和代谢病理过程中发挥重要作用[5-6,10]。近年来,本实验室系统地从乳源CGMP对肠道免疫调控系统、肠道菌群变化的影响以及和肠道炎症反应的相关性等方面进行了研究。证实乳源CGMP具有抗炎活性,在一定程度上可以改善、缓解和治愈炎症性肠病。朱晨晨等[13]用恶唑酮诱导建立溃疡性结肠炎小鼠模型,研究乳源CGMP对其结肠黏膜固有层CD4、CD8、SIgA及免疫信号通路MEKK1、Smad7表达的影响,发现乳源CGMP也可显著降低结肠黏膜固有层中CD4、CD8的表达,促进SIgA的表达。同时抑制MEKK1和Smad7蛋白的表达,说明乳源CGMP具有维持肠黏膜免疫调节的平衡和保护肠黏膜免疫屏障功能。李伟等[14]研究了乳源CGMP对小鼠脾脏淋巴细胞亚群、肠系膜淋巴结中淋巴细胞亚群和派尔集合淋巴结(peyer patch,PP)淋巴细胞亚群的影响,通过实验结果分析,长期灌胃乳源CGMP能够介导肠黏膜免疫,促进脾脏和PP结T淋巴细胞亚群显著增多,说明乳源CGMP能够引起这些外周免疫器官产生相应的免疫应答。脾淋巴细胞的增殖是感染反应的一个环节,抑制脾淋巴细胞增殖表现为抑制免疫应答,Otani等[15]发现在小鼠的食物中加入乳源CGMP,可抑制脂多糖(lipopolysaccharide,LPS)诱导小鼠脾脏细胞的增殖,进而表明乳源CGMP具有调节免疫系统的作用。Monnai等[16]发现乳源CGMP干预后的细胞,家族细胞因子白细胞介素(interleukin,IL)-lra通过与IL-1的受体结合从而阻止了IL-1的作用,因此不能启动脾脏细胞的扩增。Requena等[17]研究指出NF-κB及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号可由牛乳糖巨肽(bovine glycomacropeptide,BGMP)激活,从而使人体巨噬细胞(human acute monocytic leukemia cell line,THP)-1的肿瘤坏死因子(tumor necrosis factor,TNF)-α、IL-8和IL-1b的含量增加。Requena等[18]研究还发现,BGMP可激活NF-κB和MAPK信号通路,上调人单核细胞TNF、IL-1β和IL-8的分泌,并认为BGMP在肠道中可能起到抗炎的作用。Requena等[19]研究也证BGMP可以降低肠道炎症的发生,BGMP可以抑制由刀豆蛋白诱导的脾细胞TNF-α和干扰素(interferon,IFN)-γ的表达。Rhoades等[20]证实了乳源CGMP可以抑制3 株肠致病性大肠杆菌对结直肠癌HT-29细胞株的黏附能力,从而缓解结直肠癌的发展。这些都充分说明乳源CGMP在结肠炎方面具有一定的抗炎作用。Yun等[21]通过研究乳源CGMP对LPS刺激的脾脏细胞产生免疫球蛋白的影响,发现免疫球蛋白(immunoglobulin,Ig)A的浓度升高。乳源CGMP能够促进正常B淋巴细胞的增殖,所以能够增强机体的体液免疫系统。李荣华等[22]利用乳源CGMP刺激体外培养的小鼠骨髓源树突细胞(dendritic cell,DCs),发现乳源CGMP可刺激DCs的成熟,并强烈地刺激生物相容复合体抗原(major histocompatibility complex,MHC)-Ⅱ,在DCs对外源抗原的提呈过程中,MHC-Ⅱ发挥了至关重要的作用,说明乳源CGMP通过调节DCs中MHC-Ⅱ来发挥免疫调节作用。
基于以上的研究成果,本研究主要从炎症因子和信号通路两方面入手,以结肠癌HT-29细胞为研究对象,探究乳源CGMP的抗炎性能和免疫调节作用。通过免疫荧光法确定LPS刺激HT-29细胞激活NF-κB信号通路,确定乳源CGMP通过抑制炎症因子和血管生成因子的表达,从而达到减缓炎症的程度,更为乳源CGMP作为功能性物质应用于结肠的健康提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
CGMP 新西兰Tatua公司;人类结肠癌HT-29细胞江苏齐氏生物科技有限公司。
LPS 美国Sigma公司;胎牛血清 美国Gibco公司;NF-κB激活-核转运检测试剂盒、Nc-细胞核/浆蛋白抽提试剂盒、BCA蛋白质量浓度测定试剂盒 北京康为世纪科技有限公司;兔抗人p65多克隆抗体 英国Abcam公司;免疫荧光染色试剂盒-抗兔Cy3 上海碧云天生物技术有限公司;4',6-联脒-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI) 北京索莱宝有限公司;人8 种炎症因子酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、人8 种血管生成因子ELISA试剂盒 美国Signosis公司。
1.2 仪器与设备
HERAcell 240iCO2培养箱 美国Thermo公司;SpectraMax M5多功能读板机 美国Molecular Devices公司;TE2000倒置拍照显微镜 日本Nikon公司;X-OMAT医用X射线胶片 锐珂(厦门)医疗器材有限公司;3K15高速冷冻离心机 美国Sigma公司;DYCZ-24DN迷你双垂直电泳槽、DYCZ-40D迷你转印电泳槽、DYY-2C电泳仪 北京六一仪器厂;QB-9001多孔振荡器海门市其林贝尔仪器;Gel doc XR凝胶成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 细胞的复苏、培养、传代及乳源CGMP溶液制备
结直肠癌HT-29细胞复苏、培养、传代及乳源CGMP溶液制备等方法参见文献[7]。
1.3.2 免疫荧光法确定LPS刺激HT-29细胞激活NF-κB信号通路
1.3.2.1 LPS细胞实验分组
LPS溶液的配制:准确称取50 mg LPS于5 mL的DMEM高糖培养基中,针头过滤器过滤,-20 ℃冻存,使用时用DMEM培养基梯度稀释至相应质量浓度。
HT-29细胞正常培养,传代进行2~3 次,然后进行分组:正常对照组、LPS组1(0.01 μg/mL)、LPS组2(0.1 μg/mL)、LPS组3(1 μg/mL)、LPS组4(10 μg/mL),每组3 个复孔。
1.3.2.2 细胞爬片的制备
在48 孔板内滴入2 μL磷酸盐缓冲液(phosphate buffer saline,PBS),然后用镊子放入玻片以确保其固定在孔板内。取对数生长期的细胞,弃去培养基,PBS洗涤3 次,胰酶消化后用于计数;用完全培养基调整细胞浓度为5×105个/mL,均匀接种细胞爬片,每孔100 μL,置于培养箱内培养24 h。取出孔板弃去培养基,PBS洗涤1 次,正常对照组加100 μL完全培养基,LPS组加入不同质量浓度的LPS溶液100 μL,在培养箱内孵育30 min。用弯针头挑出细胞爬片置于培养皿盖上,PBS洗涤1 次。
1.3.2.3 免疫荧光图的观测
1)固定:每个细胞爬片加入100 μL 4%多聚甲醛固定液固定10 min。2)洗涤:吸除固定液,用洗涤液洗涤3 次,每次4 min,注意每次在洗涤过程中尽量吸尽残余液体,同时要保证表面的湿润度,最后一次完全去除洗涤液。3)封闭:加入100 μL的免疫染色封闭液,室温封闭1 h。4)一抗反应:吸除免疫染色封闭液,加入封闭液稀释的NF-κB p65抗体(封闭液与抗体体积比为80∶1),在4 ℃条件下孵育过夜。5)洗涤:重复步骤2)。6)二抗反应:加入免疫染色封闭液稀释抗兔Cy3抗体(封闭液与抗体体积比为100∶1)100 μL,避光室温孵育1 h。随后的步骤都要避光进行操作。7)洗涤:重复步骤2)。8)细胞核染色:加入细胞核染色液DAPI,室温染色5 min。9)洗涤:重复步骤2)。10)荧光倒置显微镜观察。
1.3.3 乳源CGMP对炎症因子和血管生成因子表达的影响
HT-29细胞正常培养,传代进行2~3 次,然后进行分组:正常对照组、LPS组、实验组(CGMP组1:10-6mg/mL、CGMP组2:10-5mg/mL、CGMP组3:10-4mg/mL、CGMP组4:10-3mg/mL、CGMP组5:10-2mg/mL)。37 ℃、5% CO2培养箱内孵育24 h,PBS洗5 min,洗2 次,正常组加入完全培养基,LPS组和实验组均加入LPS(1 μg/mL),均在培养箱内孵育30 min,然后LPS组和实验组吸去LPS,之后LPS组加入完全培养基,实验组加入不同质量浓度的乳源CGMP溶液,在培养箱内培养24 h,收集细胞培养液,1 200 r/min离心2 次,每次5 min。将得到的上清液直接进行8 种炎症因子的检测,对于血管生成因子检测前用截留分子质量为3 ku的蛋白超滤管进行浓缩,10 000 r/min条件下离心5 次,每次10 min,将细胞上清液浓缩至1 mL后进行测定。其余操作按照试剂盒说明书,在多功能读板机测量每个孔在450 nm波长处的吸光度(A450nm)。
1.4 统计学分析
采用SPSS 19.0软件中的Duncan模型进行方差分析与多重比较,处理结果以表示,P<0.05表示差异显著。
2 结果与分析
2.1 免疫荧光法确定LPS刺激HT-29细胞激活NF-κB信号通路
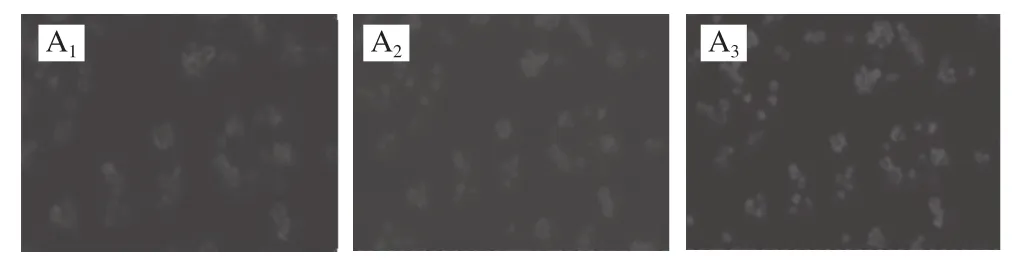

图1 不同LPS质量浓度刺激下HT-29细胞免疫荧光图Fig.1 immunof l uorescence images of HT-29 cells under LPS stimulation at different concentrations
NF-κB开启转录功能的前提是NF-κB(p65)从细胞质转移到细胞核中,而目前研究NF-κB的活化方法主要有凝胶电泳迁移实验、荧光素酶报告基因测定NF-κB DNA结合活性以及免疫荧光技术等技术。其中免疫荧光技术可更为简单直观地观察到p65的核移位情况。本研究采用DAPI和Cy3双色荧光进行标记。DAPI是一种可以透过完整细胞膜与DNA强力结合的蓝色荧光染料,即可对细胞核内的DNA染色而显示出细胞核;因此,在荧光显微镜下蓝色荧光图像指示的为细胞核区;Cy3(箐类染料)是标记NF-κB(p65)抗体的红色荧光染色剂。
细胞静息状态下,细胞内的NF-κB很少被激活而存在细胞质中,这时的红色主要为细胞质的NF-κB。而激活后的NF-κB会转移到细胞核,这时细胞核区也会出现红色的荧光,核区红色荧光越多,说明转位的NF-κB(p65)越多,以此来代表NF-κB活化的程度。图1显示不同质量浓度LPS刺激下的免疫荧光图,不同的滤光镜分别采取同一视野。由免疫荧光检测发现,在正常对照组图1A1中,可清晰地看到呈现红色荧光的细胞质(图中未显示,下同),中间内依稀可见空心的部分为细胞核,在图1A3中通过与细胞核的蓝色荧光染色叠加后,发现细胞核的颜色与叠加前几乎无差别,说明NF-κB(p65)没有发生核移位。而通过观察经LPS刺激后的各组叠加后的图片,发现出现了p65从细胞质内不同程度地转移到细胞核内的现象。LPS组1叠加图的胞核区染色不再是单一的蓝色,伴随轻微的紫色,原因是NF-κB的核移位使得细胞核内也表现出红色荧光,当红、蓝颜色叠加后,便出现了蓝紫色。NF-κB活化的程度越大,即核移位越多,胞核区的染色就越向紫色偏移,比较LPS组1~组4,发现LPS组3的胞核区叠加后的紫色更明显,表明胞核内的红色荧光更多;所以,LPS组3(1 μg/mL)是刺激HT-29细胞活化NF-κB信号通路的最适剂量。在此基础上继续考察了乳源CGMP对炎症因子和血管生成因子表达的影响。
2.2 乳源CGMP对炎症因子和血管生成因子表达的影响
2.2.1 乳源CGMP干预激活后的HT-29细胞的8 种炎症因子表达水平
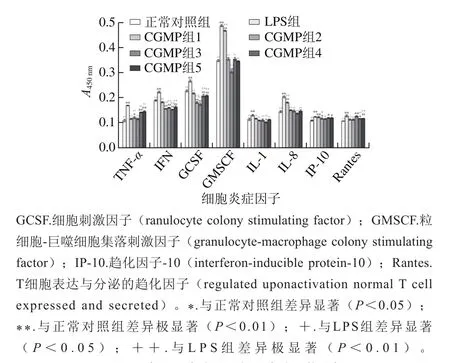
图2 各细胞炎症因子相对表达量的比较Fig.2 Comparison of relative expression levels of inf l ammatory factors
免疫因素是结肠癌发病机制的重要因素之一,大量的T淋巴细胞分泌各种促炎(TNF-α、IFN、IL-1、IL-6、IL-8)和抑炎(IL-4、IL-10)的炎症因子,还包括趋化因子和集落刺激因子等,这些因子的反馈性又加重炎症的损伤。采用ELISA试剂盒的方法测定细胞中炎症因子相对表达量的结果如图2所示,其中表达量相对较多的是GMCSF、GCSF、INF-γ、TNF-α、IL-8 5 种因子,剩余3 种因子的表达量一般。LPS组各种因子都明显高于对照组和乳源CGMP组。同时综合8 种因子经乳源CGMP的调节后,发现CGMP组2、CGMP组3和CGMP组4的对炎症因子表达有明显的影响。
2.2.2 乳源CGMP干预激活后的HT-29细胞的8 种血管生成因子表达水平
肿瘤持续性生长必须要依赖于血管,血管是肿瘤营养的运输系统,亦是肿瘤转移的重要途径。采用ELISA的方法测定的细胞中血管生成因子相对表达结果如图3所示,发现血管内皮生长因子(vascular endothelial growth factor,VEGF)与转化生长因子(transforming growth factor,TGF)β表达量最突出,乳源CGMP组不仅极显著地下调了LPS刺激后的VEGF分泌,其表达量也低于正常对照组,具有极显著性差异。其余的因子也呈现出LPS组的表达量最大,乳源CGMP均不同程度地抑制了各种因子的表达,总体趋势均是先降低后升高。
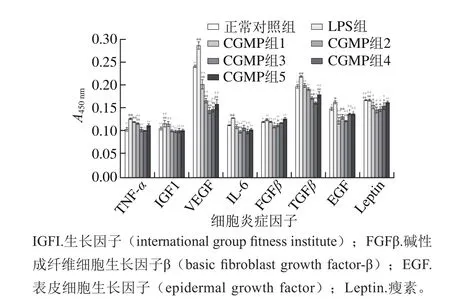
图3 各细胞血管生成因子相对表达量的比较Fig.3 Comparison of relative expression levels of angiogenic factors
3 讨 论
NF-κB是一种高度保守的核转录因子,因其在细胞内参与了炎症因子的调控和表达,所以亦称之为炎症反应链上的“基因开关”。在受到外界的刺激时,NF-κB可迅速产生反应而影响机体。研究指出,NF-κB与结直肠癌的关系密切[23],因此研究NF-κB信号通路在结肠癌的发展中具有重大意义。
本研究以体外人源结肠癌HT-29细胞为模型,通过观测p65核移位的现象确定NF-κB信号通路激活状态,研究用LPS刺激细胞以确保NF-κB(p65)从细胞质转移到细胞核内。由图1发现,细胞内红色荧光的强弱依赖于LPS的质量浓度,LPS的质量浓度越高,叠加后的紫色荧光越明显,充分说明NF-κB信号通路的激活越彻底。Hwang等[24]用LPS(20 μg/mL)刺激人脐静脉内皮血管细胞,同样采用荧光技术,发现LPS可以激活NF-κB。Perkins等[25]以0.01、0.10、1.00 μg/mL的LPS刺激结肠癌SW620细胞1、3、6、12 h后测定Toll样受体、NF-κB,结果显示NF-κB的活化与LPS的质量浓度和时间均呈现依赖性,表明1 μg/mL是最适的剂量,与本实验结果相同。本研究为乳源CGMP干预后的HT-29细胞在体外细胞模型中处于激活状态提供了保障。事实表明,炎症反应过程中细胞因子及相关蛋白质的表达往往与特定免疫信号通路的激活有着必然的联系。肠黏膜受到外界刺激后造成NF-κB激活,过量表达部分炎症细胞因子,如前列腺素E2、IL炎症因子不断刺激肿瘤细胞加剧了其发展转移;进一步认识炎症因子对结直肠癌及其他免疫相关性疾病的影响机制有助于降低炎症性肠病诱发肠道肿瘤的概率[12]。近年来,转录因子NF-κB已被研究得较为透彻,绝大多数人认为其在细胞核内出现才代表NF-κB已具备转录活性,也有部分人认为只有核内磷酸化才能证明NF-κB被激活,对于p65的解释更是充满争议。p65的磷酸化可以通过经典通路中的细胞内免疫反应中NF-κB激酶抑制剂(inhibitor of nuclear factor kappa-B kinase,IKK)的作用也可直接与酪氨酸激酶结合,然后将其磷酸化。在国内的研究中发现p65蛋白的磷酸化位点具有多个,不同的位点磷酸化可产生不同的效果,其中研究较多的是第536位和第276位的丝氨酸(Ser)。Ser536的磷酸化都被解释为有助于核因子的转录,在大鼠肉瘤(ratsarcoma,ras)、蛋白激酶(extracellular regulated protein kinases,ERK)、核糖体S6蛋白激酶(ribosomal S6 kinase,RSK)通路增强核蛋白体S6能够直接把核内的p65的Ser536磷酸化,通过降低与抑制蛋白IκB的结合从而增强NF-κB的活性[25-26]。磷酸化p65不仅仅只存在于细胞核内,在细胞质内也同样存在,并且影响着p65在细胞质和细胞核内的定位。有研究发现276位的Ser磷酸化的p65能够减少p65在细胞核内的积累,基因敲除磷酸化p65的Ser276的蛋白激酶(protein kinases,PKA)会使p65在核内的积累增多[27],但也有学者认为Ser276被PKA磷酸化后增强了NF-κB与DNA的亲和性。结合四唑盐比色法[7]和免疫荧光测定的结果,并测定了不同质量浓度的CGMP对LPS刺激后的细胞核内p65蛋白的表达,结果表明实验组均下调被LPS刺激的HT-29细胞内p65的表达,质量浓度10-5mg/mL和10-4mg/mL的乳源CGMP对p65的作用极其显著;而低质量浓度10-5、10-4mg/mL和10-3mg/mL的乳源CGMP对p65的影响极显著;其他质量浓度CGMP虽也在不同程度上降低了部分蛋白的表达,但与正常对照组相比,都没有显著性[7]。Ming Zhu等[8]研究了乳源CGMP对溃疡性小鼠的影响,测定结肠组织的核蛋白内的p65,揭示了乳源CGMP可以降低模型组的蛋白的表达,本实验的结果与其结论一致。
目前国内外研究CGMP对结肠癌的抗炎方面还比较少,而大多数的研究集中在生物活性肽方面,Håversen等[28]的实验结果表明乳铁蛋白可以抑制NF-κB的活性和细胞因子的表达量。Jørgensen等[29]以小鼠的肠道细胞为模型,用LPS刺激细胞发现,0.1 μg/mL LPS可最大程度活化NF-κB,牛初乳蛋白处理可显著降低p65的转录。同时,Majumder[30]和Huang Wuyang[31]等从鸡蛋清中提取的三肽可以抑制由细胞因子诱导的关键NF-κB信号通路,从而下调了在血管内皮中表达的炎症蛋白。本研究的结果也与以上众多研究结论相符,进一步说明了乳源CGMP可在炎症相关的信号通路中发挥一定的作用,其作用机制为乳源CGMP进入细胞内直接作用到经典信号通路中的结点蛋白IKK上,在细胞质内就阻断了p65的核移位和Ser536的磷酸化,使得细胞核的p65在不同程度上降低[6,8]。
无论是炎症的产生还是血管的生成终归咎于促炎因子与抑炎因子、血管生成因子与抑制血管生成因子之间的平衡被打破,导致免疫系统紊乱[3]。研究显示有近25%的肿瘤是由慢性炎症引发的,如部分结肠癌的形成就是由炎症反复刺激结肠黏膜导致溃疡性结肠炎演变的。肠上皮屏障的损伤增加了上皮的通透性,细菌等进入黏膜下层,刺激巨噬细胞、DCs产生促炎因子(TNF-α、IL-8、IL-1β)。这样的炎症微环境使肿瘤细胞分泌更多趋化因子和炎症因子,招募免疫细胞并激活下游的信号通路。TNF-α可促使NF-κB途径被激活,趋化巨噬细胞积累并转录大量的促炎因子而诱发结肠癌;中和TNF-α可以降低结肠癌的发生率[32]。肿瘤血管的生成是机体原有血管直接的实体瘤生长再血管化,血管形成的关键步骤是血管生成因子诱发细胞的增殖和游走。1971年Folkman等[33]从Walker256瘤细胞中提取了一种诱发血管生成物质,并正式命其为肿瘤血管生成因子。至今,已发现10多种血管生成因子,代表有TGF、VEGF、EGF、TNF-α及纤维蛋白等,这些血管生成因子不断促进血管的生成。炎症因子与血管生成因子存在一定的关联,TNF-α不仅具有促炎因子的作用而且还发挥诱发血管生成因子的作用。更有研究证明粒细胞-巨噬细胞集落刺激因子CMSCF在肠炎恶性转化过程中高度表达,在LPS刺激结肠上皮细胞后可分泌CMCSF,更重要的是CMCSF又可促进肠道肿瘤上皮细胞直接释放VEGF[34]。本结果显示LPS刺激HT-29细胞后,促炎因子中CMCSF的表达量最高,对应的血管生成因子中VEGF也最为明显,与前人的结果一致。结肠癌中的这些因子的转录由活化的NF-κB控制[35]。对于CMCSF促进VEGF的表达可能与ERK通路存在关联,已有研究证明ERK通路也可调控VEGF的表达,CMCSF通过促进缺氧诱导因子1α的入核而诱导VEGF的表达[36]。
4 结 论
乳源CGMP具有调节激活后的NF-κB信号通路的能力,能有效抑制和改善结肠癌细胞的炎症状态,其机制为乳源CGMP可通过显著下调结肠癌细胞中NF-κB信号通路的炎症因子和血管生成因子的表达,从而达到减缓炎症的程度。
[1] FARRELL H M J R, JIMENEZ-FLORES R, BLECK G T, et al.Nomenclature of the proteins of cows’ milk: sixth revision[J]. Journal of Dairy Science, 2004, 87(6): 1641-1674. DOI:10.3168/jds.S0022-0302 (04)73319-6.
[2] 王华, 陈庆森. 乳源酪蛋白糖巨肽抗细胞凋亡干预小鼠溃疡性结肠炎效应研究[J]. 食品科学, 2012, 33(1): 230-234.
[3] 朱晨晨, 陈庆森. 乳源酪蛋白糖巨肽改善炎症性肠病的研究进展[J].食品科学, 2012, 33(1): 262-266.
[4] 王金凤, 陈庆森, 闫亚丽. 酪蛋白糖巨肽对大鼠肠黏膜屏障的保护作用[J]. 食品科学, 2013, 34(7): 254-257. DOI:10.7506/spkx1002-6630-201307053.
[5] 龚建苗, 陈庆森, 阎亚丽, 等. 生物活性肽调节NF-κB信号通路的研究进展[J]. 食品科学, 2013, 34(21): 379-388. DOI:10.7506/spkx1002-6630-201321075.
[6] GONG J M, CHEN Q S, YAN Y L, et al. Effect of casein glycomacropeptide on subunit p65 of nuclear transcription factor-кB in lipopolysaccharide-stimulated human colorectal tumor HT-29 cells[J].Food Science and Human Wellness, 2014, 3(2): 51-55. DOI:10.1016/j.fshw.2014.04.001.
[7] 曹江鸣, 陈庆森, 阎亚丽, 等. 乳源酪蛋白糖巨肽对结肠癌HT-29细胞中COX-2、iNOS、GST-π表达的影响[J]. 食品科学, 2014,35(13): 213-217. DOI:10.7506/spkx1002-6630-201413041.
[8] MING Zhu, JIA Yan, YAN Yali, et al. Amelioration effect of bovine casein glycomacropeptide on ulcerative colitis in mice[J]. Food and Agricultural Immunology, 2015, 26(5): 717-728. DOI:10.1080/095401 05.2015.1018874.
[9] 毛盈颖, 李迎君, 陈坤. 散发型结直肠癌发病分子机制研究进展[J]. 中国肿瘤, 2014, 23(2): 97-102. DOI:10.11735/j.issn.1004-0242.02.A004.
[10] CHEN Q S, LIANG Y, ZHU C C, et al. Effects of casein glycomacropeptide on the early development of primary colorectal cancer in rats[J]. Food Science and Human Wellness, 2013, 2(3/4):113-118. DOI:10.1016/j.fshw.2013.09.001.
[11] HARRISON S, BENZIGER H. The molecular biology of colorectal carcinoma and its implications: a review[J]. Surgeon Journal of the Royal Colleges of Surgeons of Edinburgh and Ireland, 2011, 9(4):200-210. DOI:10.1016/j.surge.2011.01.011.
[12] LAKATOS P L, LAKATOS L. Risk for colorectal cancer in ulcerative colitis: changes, causes and management strategies[J]. World Journal of Gastroenterol, 2008, 14(25): 3937-3947. DOI:10.3748/wjg.14.3937.
[13] 朱晨晨. 乳源CGMP对IBD相关信号通路途径影响的研究[D]. 天津: 天津商业大学, 2013: 5-27.
[14] 李伟, 陈庆森. 酪蛋白糖巨肽对小鼠肠道免疫系统的影响[J]. 食品科学, 2010, 31(15): 240-243.
[15] OTANI H, HATA I. Inhibition of proliferative responses of mouse spleem lympho-cytes and rabbit Peyer’s path cells by bovine milk caseins and their digests[J]. Journal of Dairy Research, 1995, 62(2):339-348. DOI:10.1017/S0022029900031034.
[16] MONNAI M, OTANI H. Effect of bovine-caseinoglycopeptideon secretion of interleukin-1 family cytokines by P388D1, a line de-rived from mouse monocyte/macrophage[J]. Milchwissenschaft-Milk Science International, 1997, 52(4): 23-27.
[17] REQUENA P, DADDAOUA A, MARTNEZ-PLATA E, et al.Bovine glycomacrope-peptide ameliorates experimental ratileitis by mechanisms involving downregulation of interleukin 17[J]. British Journal of Pharmacology, 2008, 154(4): 825-832. DOI:10.1038/bjp.2008.138.
[18] REQUENA P, DADDAOUS A, GUADIX E, et al. Bovine glycomacropeptide induces cytokine production in human monocytes through the stimulation of the MAPK and the NF-κB signal transduction pathways[J]. British Journal of Pharmacology, 2009,157(7): 1232-1240. DOI:10.1111/j.1476-5381.2009.00195.x.
[19] REQUENA P, GONZÁLEZ R, LÓPEZ-POSADAS R, et al. The intestinal antiinflammatory agent glycomacropeptide has immunomodulatory actions on rat splenocytes[J]. Biochemical Pharmacology, 2010, 79(12):1797-1804. DOI:10.1016/j.bcp.2010.02.008.
[20] RHOADES J R, GIBSON G R, FORMENTIN K, et al.Caseinoglycomacropeptide inhibits adhesion of pathogenic Escherichia coli strains to human cells in culture[J]. Journal of Dairy Science,2005, 88(10): 3455-3459. DOI:10.3168/jds.S0022-0302(05)73029-0.
[21] YUN S S, SUGITA K Y, KUMAGAI S, et al. Glycomacropeptide from cheese whey protein concentrate enhances IgA production by lipopolysaccharide-stimulated murine spleen cells[J]. Animal Science and Technology, 1996, 67(5): 458-462. DOI:10.2508/chikusan.67.458.
[22] 李荣华, 庞广昌, 陈庆森. 酪蛋白糖巨肽通过树突细胞发挥免疫调节作用的初步研究[J]. 食品科学, 2011, 32(21): 233-242.
[23] KOUMAKPAYI I H, LE P C M A, SAAD F, et al. Hierachical clustering of immunohisto chemical analysis of the activated ErbB/PI3K/Akt/NF-κb signaling pathway and prognostic significance in prostate cancer[J]. British Journal of Cancer, 2010, 102(7): 1163-1173.DOI:10.1038/sj.bjc.6605571.
[24] HWANG H J, JUNG T W, HONG H C, et al. progranulin protects vascular endothelium against atherosclerotic inf l ammatory reaction via Akt/eNOS and nuclear factor-κB pathways[J]. PLoS ONE, 2013, 8(9):1-7. DOI:10.1371/journal.pone.0076679.
[25] PERKINS N D. Post-translational modif i cations regulating the activity and function of the nuclear factor kappa B pathway[J]. Oncogene,2006, 25(51): 6717-6730.
[26] ZHANG L P, MA Y W, ZHANG J Q, et al. A new cellular signaling mechanism for angiotensin II activation of NF-κB: an IκB-independent,RSK-mediated phosphorylation of p65[J]. Arteriosclerosis Thrombosis and Vascular Biology, 2005, 25(6): 1148-1153. DOI:10.1161/01.ATV.0000164624.00099.e7.
[27] KING C C, SASTRI M, CHANG P, et al. The rate of NF-kB nuclear translocation is regulated by PKA and A kinase interacting protein 1[J].PLoS ONE, 2011, 6(4): e18713. DOI:10.1371/journal.pone.0018713.
[28] HÅVERSEN L, OHLSSON B G, HAHN-ZORIC M, et al. Lactoferrin down-regulates the LPS-induced cytokine production in monocytic cells via NF-kappa B[J]. Cellular Immunology, 2002, 220(2): 83-95.DOI:10.1016/S0008-8749(03)00006-6.
[29] JØRGENSEN A L W, JUUL-MADSEN H R, STAGSTED J.Colostrum and bioactive, colostral peptides differentially modulate the innate immune response of intestinal epithelial cells[J]. Journal of Peptide Science, 2010, 16(1): 21-30. DOI:10.1002/psc.1190.
[30] MAJUMDER K, CHAKRABARTI S, DAVIDGE S T, et al. Structure and activity study of egg protein ovotransferrin derived peptides(IRW and IQW) on endothelial inf l ammatory response and oxidative stress[J]. Journal of Agricultural and Food Chemistry, 2013, 61(9):2120-2129. DOI:10.1021/jf3046076.
[31] HUANG Wuyang, SUBHADEEP C, KAUSTAV M, et al. Eggderived peptide IRW inhibits TNF-α-Induced inf l ammatory response and oxidative stress in endothelial cells[J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 10840-10846. DOI:10.1021/jf102 120c.
[32] POPIVANOVA B K, KITAMURA K, WU Y, et al. Blocking TNF-α in mice reduces colorectal carcinogenesis associated with chronic colitis[J]. Journal of Clinical Investigation, 2008, 118(2): 560-570.DOI:10.1172/JCI32453.
[33] FOLKMAN J, MERLER E, ABERNATHY C, et al. Isolation of a tumor factor responsible for angiogenesis[J]. Journal of Experimental Medicine, 1971, 133(2): 275-288.
[34] 王一. 粒细胞-巨噬细胞集落刺激因子(GM-CSF)和白介素(IL)-1β在慢性肠炎恶性转化中的作用及机制研究[D]. 北京: 中国人民解放军军事医学科学院, 2014: 2-5.
[35] LUO J L, KAMATA H, KARIN M. IKK/NF-κB signaling: balancing life and death: a new approach to cancer therapy[J]. Journal of Clinical Investigation, 2005, 115(10): 2625-2632. DOI:10.1172/JCI26322.
[36] HU D, FUKUHARA A, MIYATA Y, et al. Adiponectin regulates vascular endothelial growth factor-C expression in macrophages via Syk-ERK pathway[J]. PLoS ONE, 2013, 8(2): e56071. DOI:10.1371/journal.pone.0056071.
