体外模拟胃、肠消化对6 种黑色食品抗氧化成分及其活性的影响
2018-03-20敦惠瑜向孝哲富春亚莫凯迪
陆 俊,敦惠瑜,向孝哲,富春亚,莫凯迪,曾 献,2
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.稻谷及副产物深加工国家工程实验室,湖南 长沙 410004;3. 特医食品加工湖南省重点实验室,湖南 长沙 410004)
黑色食品主要指自然颜色相对较深,营养较丰富平衡,并具有一定调节人体生理功能的食物。黑色食品中含有较多的蛋白质和不饱和脂肪酸,必需氨基酸比例高,微量元素丰富、全面,并且含有丰富的VB1、VB2、VC、VA、VE等维生素[1],是人类保持自身健康的重要食品之一[2]。研究表明黑米、黑大豆、黑荞麦等的蛋白质、微量元素和多酚含量与其浅色同类相比分别高出10%~60%[3]、1~3 倍[4]和4 倍[5]。孙玲等[6]研究表明黑米中黄酮含量平均为0.305 g/100 g,分别为红米和白米的18 倍和34 倍。Zhang Mingwei等[7]检测了12 种黑米的多酚、黄酮、花青素含量以及它们的抗氧化活性,并与白米进行对比,发现黑米的多酚、黄酮和花青素含量显著高于白米,抗氧化活性比白米高出5 倍。食物中的多酚和黄酮等活性成分在经过人体消化后,其含量和抗氧化能力会发生改变,Ti Huihui等[8]运用体外模拟胃、肠消化的方法处理稻米,通过检测发现粳米的多酚、黄酮及抗氧化值分别增加了195.6%、34.6%和185.7%,糙米的多酚、黄酮及抗氧化值分别增加了403.3%、13.3%和293.4%。刘冬等[9]比较研究了小麦不同部位在体外模拟消化过程中的抗氧化活性,发现小麦的各个部位经过模拟消化后抗氧化值均增加,其中精面的增加量最高,为9.17 倍。
黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆均属杂粮,对人体有着不同的滋补作用,具有很高的食用价值。但对其研究大多数基于化学试剂提取活性成分进行含量测定,而未考虑活性成分在胃、肠道中的释放量和可能发生的变化。本实验采用体外模拟消化和未经消化处理两种实验方案,对黑色食品中的抗氧化活性成分及其抗氧化活性进行测定。研究体外模拟消化对黑色食品多酚、黄酮的释放量与抗氧化活性的影响,为黑色食品的有效利用和开发新产品提供实验依据和理论参考。
1 材料与方法
1.1 材料与试剂
黑米、黑小米和黑苦荞购自山东省临沂市;黑豆购自湖南省株洲市;黑绿豆和黑麦购自山东省滕州市。用粉碎机将样品粉碎,过40 目筛,备用。
福林-酚试剂 上海源叶生物科技有限公司;2,4,6-三吡啶基三嗪(tripyridyltriazine,TPTZ) 都莱生物技术有限公司;水溶性VE(Trolox) 华蓝化学有限公司;2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS) 合肥博美生物有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 日本东京化成工业株式会社;亚硝酸钠 天津市大茂化学试剂厂;胃蛋白酶、猪胰酶、胆汁盐 西格玛奥德里奇(上海)贸易有限公司;没食子酸、芦丁、儿茶素、三氯化铁 国药集团化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
UV1800紫外-可见光光度计 日本岛津公司;JRC-2000超声波清洗机 济宁市润通超声电子有限公司;JP-150A高速多功能粉碎机 永康市小宝电器有限公司;AUW220D电子分析天平 日本岛津公司。
1.3 方法
1.3.1 体外化学法提取酚类物质
参考Sun Jie等[10]的研究方法,准确称取1 g样品放入小锥形瓶中,加入20 mL含体积分数0.1%盐酸的体积分数为70%的甲醇溶液,在超声功率500 W条件下超声,40 min后,在4 000 r/min的条件下离心8 min,取上清液,沉淀加10 mL提取液重复上述步骤。合并两次的提取液进行分析。
1.3.2 体外模拟胃、肠消化
1.3.2.1 体外模拟胃消化
采用改进的Miller等[11]的体外模拟消化法对黑色食品进行模拟消化。取4 g样品,加入40 g生理盐水,沸水浴15 min。冷却后,用去离子水将样品的悬浊液恒质量至44 g。用1 mol/L盐酸溶液将pH值调至2.0,再加入0.5 mL模拟胃液(0.2 g胃蛋白酶溶于5 mL 0.01 mol/L盐酸溶液)。用去离子水作空白对照,用0.01 mol/L的盐酸溶液作对照组。避光并充入氮气,于37 ℃的恒温水浴摇床中消化2 h。分别在反应0、1、2 h时取出一定质量的液体,12 000 r/min、4 ℃下离心15 min后,取上清液进行测定。
1.3.2.2 体外模拟肠消化
取4 g样品,加入40 g生理盐水,沸水浴15 min后用去离子水将样品恒质量至44 g。用1 mol/L盐酸将pH值调至2.0,加入0.5 mL模拟胃液(0.2 g胃蛋白酶溶于5 mL 0.01 mol/L盐酸溶液),避光并充入氮气,于37 ℃的恒温水浴摇床中反应2 h。向样品中继续加入1 mol/L NaHCO3溶液至pH 7.0,加入1 mL模拟肠液(4 g胰酶、25 g胆汁盐溶于1 L 0.1 mol/L NaHCO3溶液)。用NaHCO3溶液做空白对照组。避光并充入氮气,于37 ℃的恒温水浴摇床里消化2 h。分别在胃消化0 h、肠消化0、1、2 h时取出一定质量的悬浊液,12 000 r/min、4 ℃下离心15 min后,取上清液进行测定。
1.3.3 多酚含量测定
采用福林-酚试剂比色法[12]进行测定,吸取0.015、0.025、0.050、0.075、0.100 mg/mL不同质量浓度没食子酸或待测溶液1 mL置于25 mL的比色管中,用蒸馏水定容至23 mL,再加入500 μL的福林-酚试剂和300 μL质量分数为10%的Na2CO3溶液,混匀静置30 min后在760 nm波长处测定其吸光度。多酚含量以每百克干样品中没食子酸当量表示(mg GAE/100 g md)。
1.3.4 黄酮含量测定
参照Zielinski等[13]比色法测定总黄酮的含量。取0.04、0.08、0.12、0.16、0.20 mg/mL不同质量浓度儿茶素或待测溶液250 μL,加入2 720 μL体积分数为30%的乙醇溶液和120 μL的0.5 mol/L亚硝酸钠溶液反应5 min。然后加入120 μL质量分数为10%的氯化铝溶液反应5 min,再加入800 μL的1 mol/L NaOH溶液混匀,在510 nm波长处测其吸光度。黄酮含量以每百克干样品中儿茶素当量表示(mg CE/100 g md)。
1.3.5 抗氧化活性测定
1.3.5.1 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参考Gorjanović等[14]方法并经适当修改。取300 μL的待测液体或Trolox标准液(2.5、5.0、7.5、10.0、15.0 μmol/L),加入1.9 mL 0.093 mmol/L DPPH,溶液混合均匀后在黑暗处放置30 min,于517 nm波长处进行测定,以体积分数为80%的甲醇作为空白。DPPH自由基清除能力用每百克干样品中Trolox当量表示(μmol Trolox/100 g md)。
1.3.5.2 FRAP的测定
FRAP的测定参考Lu Xiaonan等[15]的方法并经适当的修改。吸取900 μL的提取液或Trolox标准液,加入2.7 mL的FRAP试剂(40 mmol/L盐酸配制10 mmol/L的TPTZ 2.5 mL,将其与2.5 mL的20 mmol/L FeCl3和25 mL 0.3 mol/L pH 3.6的醋酸缓冲液混合加热至37 ℃制成)和270 μL的去离子水,混合均匀后37 ℃水浴加热30 min,在595 nm波长处测其吸光度,以体积分数为80%的甲醇作为空白,FRAP用每百克干样品中Trolox当量表示(μmol Trolox/100 g md)。
1.3.5.3 ABTS+·清除能力的测定
ABTS+·清除能力的测定参考Chang[16]、Oh[17]等的方法并经适当修改。取7.4 mmol/L的ABTS原液与等量2.45 mmol/L过硫酸钾混合,在黑暗中放置12~16 h,将ABTS溶液用无水乙醇稀释至在734 nm波长处的吸光度为0.70±0.02,得到ABTS+·溶液。向1 mL提取液或Trolox标准液中加入4 mL的ABTS+·溶液,混合均匀后在734 nm波长处测吸光度,无水乙醇作为空白,ABTS+·清除能力用每百克干样品中Trolox当量表示(μmol Trolox/100 g md)。
2 结果与分析
2.1 化学提取测定多酚、黄酮及其抗氧化能力结果
2.1.1 6 种黑色食品抗氧化活性成分含量

表1 6 种黑色食品的抗氧化成分含量Table1 Total fl avonoid and phenol contents of six kinds of black foods
6 种黑色食品中的多酚、黄酮含量见表1。不同黑色食品中的多酚和黄酮含量具有显著性差异(P<0.05),多酚含量在61.05~670.07 mg GAE/100 g md之间,黄酮含量在46.04~560.55 mg CE/100 g md之间。其中,黑苦荞的多酚含量最高(670.07 mg GAE/100 g md),其次为黑米、黑麦、黑豆、黑绿豆,黑小米多酚含量最低;黄酮含量以黑苦荞最高,其次为黑米、黑麦、黑小米、黑豆、黑绿豆。Mira等[18]研究比较了21 种稻米,其中黑米的多酚含量最高,平均值达到424.6 mg GAE/100 g md。Shao Yafang等[19]对3 种黑米、红米和白米进行对比研究,发现黑米的多酚含量最高,为43.7 mg GAE/100 g md。多酚含量的差异可能是由黑米品种和地区的差异所导致。
2.1.2 6 种黑色食品抗氧化活性分析
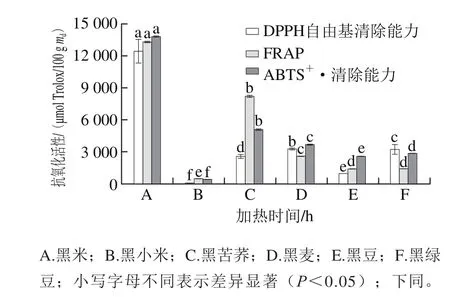
图1 6 种黑色食品的抗氧化活性Fig.1 Antioxidant activity of six kinds of black foods
用3 种抗氧化测定方法(DPPH自由基清除能力、FRAP和ABTS+·清除能力)研究了6 种黑色食品的抗氧化活性,从图1可以看出,不同的黑色食品中的抗氧化活性具有显著性差异(P<0.05)。结果表明:DPPH自由基清除能力介于41.50~12 445.89 μmol Trolox/100 g md之间;其中,DPPH自由基清除能力最高的是黑米,其次为黑麦、黑绿豆、黑苦荞、黑豆、黑小米;FRAP介于492.57~13 312.62 μmol Trolox/100 g md之间,其大小依次为黑米>黑苦荞>黑麦>黑绿豆>黑豆>黑小米;ABTS+·清除能力在422.42~13 832.58 μmol Trolox/100 g md之间,其抗氧化活性最高的为黑米,其次为黑苦荞、黑麦、黑绿豆、黑豆、黑小米。综合比较表明,黑米的总抗氧化能力最强,黑小米的总抗氧化性最弱。
2.2 体外模拟消化过程中多酚释放规律
6 种黑色食品在模拟胃、肠消化过程中多酚释放量的变化趋势如图2所示。在胃消化阶段(0~2 h),黑米、黑苦荞、黑麦、黑豆和黑绿豆在0~1 h增长趋势较为显著,1~2 h相对平稳,黑小米在0~1 h增长趋势相对平稳,1~2 h较为显著。经过胃消化阶段2 h后,黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的最大释放量与对照组相比分别增长了18%、28%、12%、20%、6%和14%,其中以黑小米的多酚释放量增长最大,从39.81 mg GAE/100 g md增加到51.03 mg GAE/100 g md,增长了28%。在肠消化阶段(2~4 h),黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的多酚释放量也呈显著上升趋势。经过肠消化2 h后,多酚释放量分别增长了50%、42%、58%、113%、35%和36%,其中以黑麦的多酚释放量增长率最大,从35.13 mg GAE/100 g md增加到74.99 mg GAE/100 g md,增长了113%。
在模拟胃、肠消化过程中多酚释放量顺序为胃消化组>盐酸对照组>胃空白对照组,肠消化组>肠空白对照组。与对照组相比,胃蛋白酶、胰酶和胆汁可以促进多酚的释放。通过对胃消化阶段和肠消化阶段的比较,发现6 种黑色食品肠消化阶段的多酚释放量的增长率比胃消化阶段的增长率大。彭梦雪等[20]研究发现,苹果在模拟胃消化阶段多酚的最大释放量为消化前的1.36~1.76 倍,肠消化后的释放量为消化前的1.34~2.08 倍,经过模拟胃、肠消化后多酚释放的增量与本实验结果相似。胡义东等[21]研究了芒果经过体外模拟胃、肠消化后的抗氧化成分及其活性的变化,发现芒果的多酚含量分别在模拟胃消化3 h和肠消化2 h达到最大值,分别为该阶段消化前的3.5 倍和1.5 倍,增长率分别为250%和50%。从彦丽等[22]检测了柑橘在体外模拟消化过程中多酚含量的变化,结果表明,胃、肠消化后,多酚平均释放量与消化前相比分别增加了1.05 倍和0.87 倍。上述实验中多酚释放量在胃、肠消化阶段的增长率有差异,原因可能是不同食物中多酚的存在形式不同,胃和肠的环境对其造成的影响有所差异,但多酚的释放量均显著增加。所有实验中空白对照组与盐酸对照组无显著差异,说明多酚的释放量受酸碱环境的影响不显著。模拟胃、肠消化组的多酚含量显著升高,原因可能是在胃蛋白酶的作用下与多酚结合或将包围于多酚外部的蛋白质水解为小分子多肽,使多酚从细胞壁中分离释放[23];胰酶和胆汁进一步水解多肽,使多酚进一步释放。
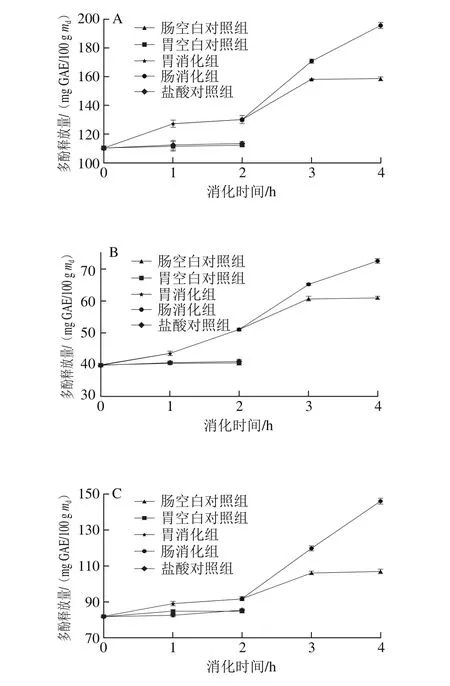
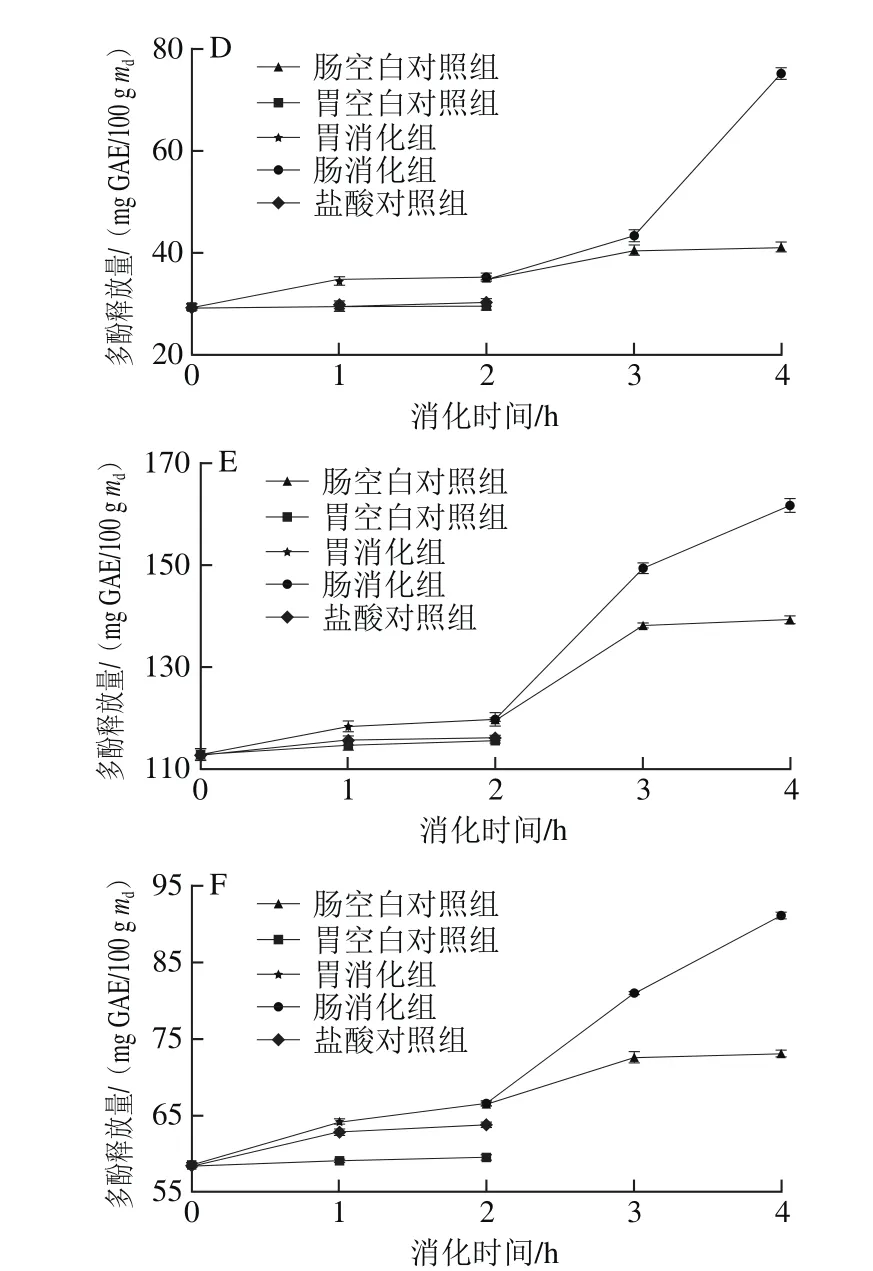
图2 6 种黑色食品在模拟胃、肠消化过程中多酚释放量的变化Fig.2 Variations in release rate of phenols from six kinds of black foods during simulated gastrointestinal digestion
2.3 体外模拟消化过程中黄酮释放规律
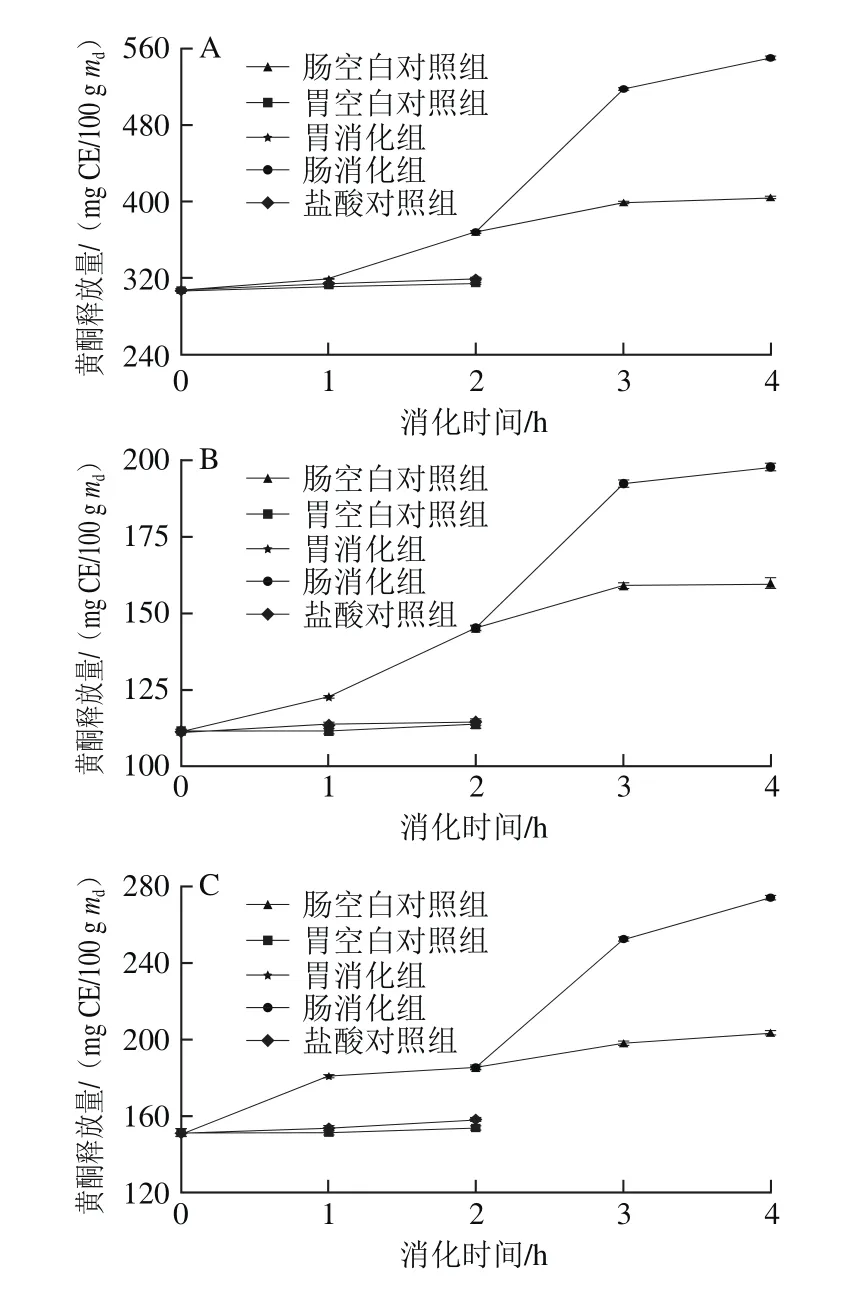
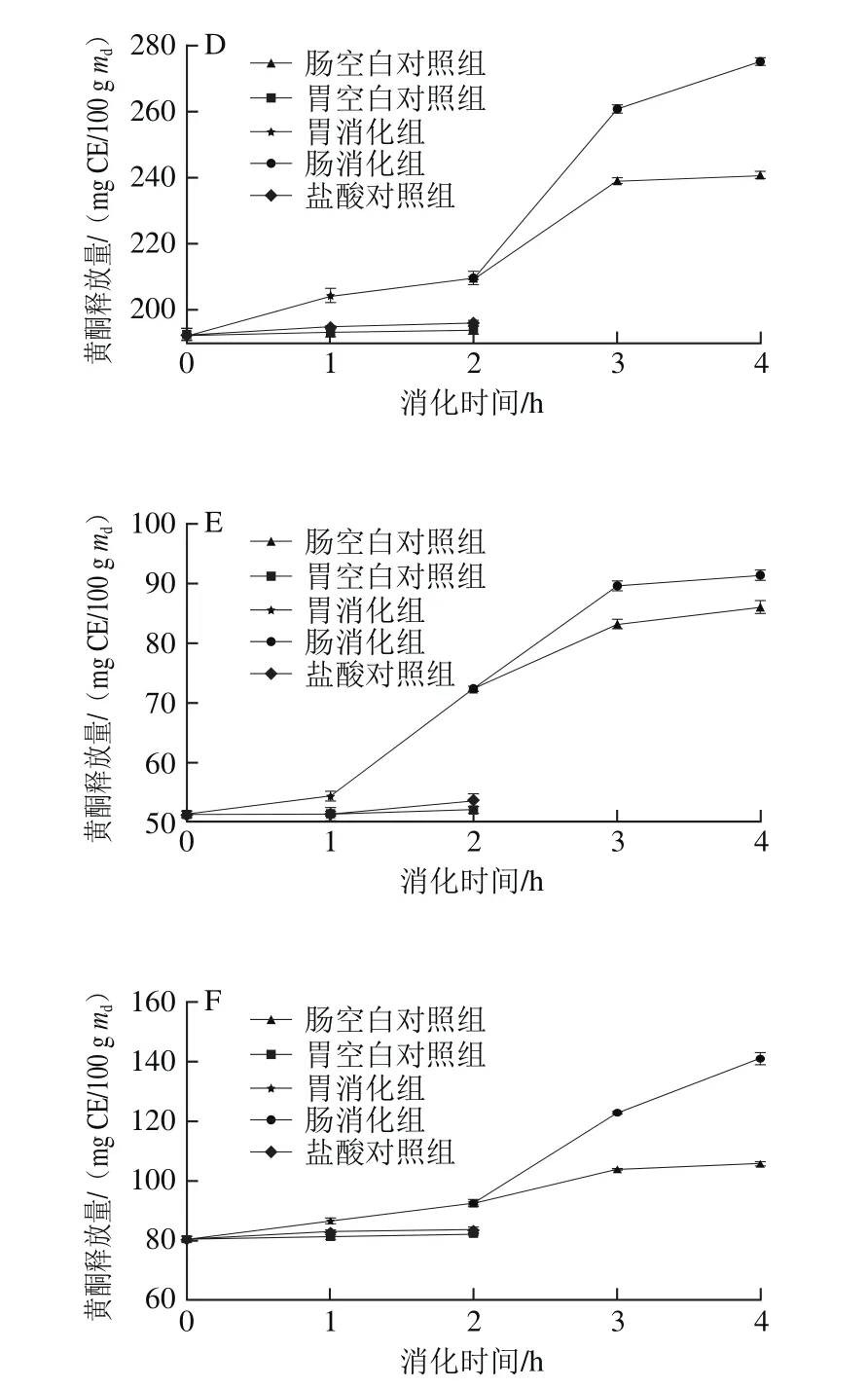
图3 6 种黑色食品模拟胃、肠消化过程中黄酮释放量的变化Fig.3 Variations in release rate of fl avonoids from six kinds of black foods during simulated gastrointestinal digestion
6 种样品在体外模拟消化过程中黄酮释放量随消化时间的变化如图3所示。在胃消化阶段,黑米、黑小米、黑豆的胃消化组的黄酮释放量在1 h内相对平缓,1~2 h内显著提高,而黑苦荞和黑麦则在1 h内上升趋势相对明显,在1~2 h内趋于平缓,黑绿豆在胃消化2 h内一直呈现平稳增长趋势。经过模拟胃消化2 h后,黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的释放量与对照组相比分别增长了20%、30%、22%、8%、41%和15%。其中黑豆的黄酮释放量在胃消化阶段内增长率最大,黄酮释放量从51.35 mg CE/100 g md增加到72.37 mg CE/100 g md,增长了41%。6 组样品在肠消化阶段2~3 h内黄酮释放量也呈上升趋势,在3~4 h内黑米、黑小米、黑苦荞、黑麦和黑豆均趋于稳定,而黑绿豆仍呈较明显上升趋势。模拟肠消化2 h后,黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的释放量分别增长了49%、36%、48%、31%、26%和52%。其中黑绿豆的黄酮释放量在肠消化阶段的增长率最大,黄酮释放量从92.64 mg CE/100 g md增加到140.90 mg CE/100 g md,增长了52%。
在模拟胃、肠的消化过程中,黄酮释放量顺序为胃消化组>盐酸对照组>胃空白对照组,肠消化组>肠空白对照组。与对照组相比,胃蛋白酶、胰酶和胆汁可以促进黄酮的释放。通过对胃消化阶段和肠消化阶段的比较发现,除黑豆外的其他5 组样品中,肠消化阶段黄酮释放量的增长率比胃消化阶段的增长率大。比较图2、3发现黄酮的释放量变化规律与多酚释放量的变化规律相似。胡义东等[21]检测了不同消化阶段芒果中黄酮的释放量变化,结果表明黄酮的释放量在胃、肠消化阶段增长率分别为54%和127%,结果与本实验相似。从彦丽等[24]研究3 种梨体外模拟消化过程中黄酮释放量的变化,模拟胃、肠阶段黄酮的平均释放量分别为未消化时的2 倍和0.58 倍。由于不同食物黄酮的存在形式不同,导致胃、肠消化阶段对黄酮释放量的影响也有所差异。
2.4 模拟胃、肠消化对6 种黑色食品抗氧化活性的影响
6 种黑色食品模拟胃、肠消化后的DPPH自由基清除能力变化如图4所示。在胃消化阶段,胃空白对照组和盐酸对照组变化不明显,两组之间没有显著差异(P>0.05),模拟胃消化组与胃空白对照组、盐酸对照组之间差异显著(P<0.05)。在0~1 h消化阶段,6 种样品的DPPH自由基清除能力增长趋势较为平稳,在1~2 h消化阶段,只有黑小米、黑麦、黑豆和黑绿豆的DPPH自由基清除能力呈较明显增长趋势。模拟胃消化2 h后,黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的DPPH自由基清除能力与未消化时相比分别增长了9%、24%、30%、32%、114%和44%,显著大于盐酸对照组和胃空白对照组。经过胃消化后黑豆的DPPH自由基清除能力增长率最大,从211.95 μmol Trolox/100 g md增加到452.79 μmol Trolox/100 g md,增长了114%。
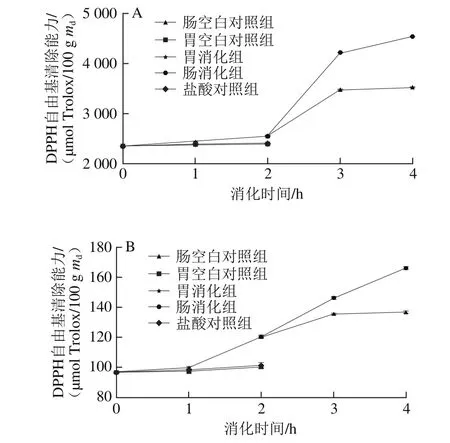
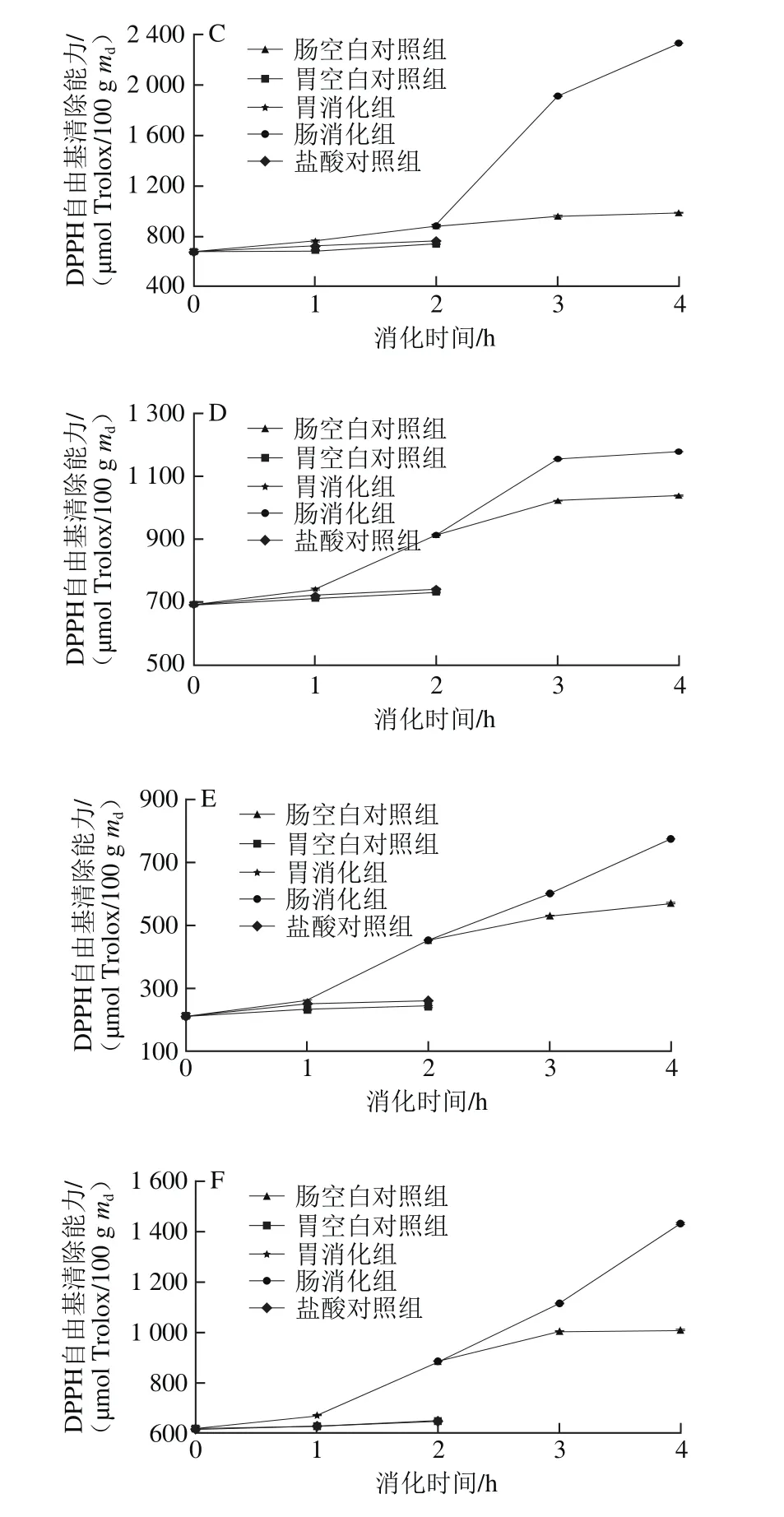
图4 6 种黑色食品模拟胃、肠消化液中DPPH自由基清除能力Fig.4 Variations in DPPH radical scavenging capacity of six kinds of black foods during simulated gastrointestinal digestion
在肠消化阶段,肠空白对照组的变化不明显,肠消化组与肠空白对照组相比,黑苦荞的DPPH自由基清除能力增长率最大,经过2 h消化后,其DPPH自由基清除能力达到肠空白对照组的2.33 倍。肠消化组的6 种样品在肠消化1 h内的DPPH自由基清除能力均有显著增加,在1~2 h间黑米、黑苦荞和黑麦增长趋势缓慢,而黑小米、黑豆和黑绿豆仍呈显著增长趋势。模拟肠消化2 h后,黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的DPPH自由基清除能力与肠消化0 h相比分别增长了84%、37%、161%、29%、71%和62%,显著大于肠空白对照组(P<0.05)。经过肠消化后黑苦荞的DPPH自由基清除能力增长率最大,从891.14 μmol Trolox/100 g md增加到2 326.59 μmol Trolox/100 g md,增长了161%。
6 种黑色食品模拟胃、肠消化的FRAP变化如图5所示。在胃消化阶段,胃空白对照组和盐酸对照组在胃消化阶段变化不明显,两组之间没有显著差异(P>0.05),胃消化组与此两组相比,黑绿豆的FRAP增长率最大,经过2 h消化后,其FRAP分别是胃空白对照组和盐酸对照组的1.27 倍和1.26 倍,模拟胃消化组与胃空白对照组、盐酸对照组之间差异显著(P<0.05)。黑米、黑小米和黑麦的消化组的FRAP增长在0~2 h之间都较为平稳,而黑苦荞、黑豆和黑绿豆则在0~1 h内增长平稳,在1~2 h时增长较为显著。模拟胃消化2 h后,黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的FRAP分别增长了7%、11%、15%、6%、24%和31%,显著大于盐酸对照组和胃空白对照组(P<0.05)。经过胃消化后,黑绿豆的FRAP增长率最大,从286.97 μmol Trolox/100 g md增加到376.95 μmol Trolox/100 g md,增长了31%。
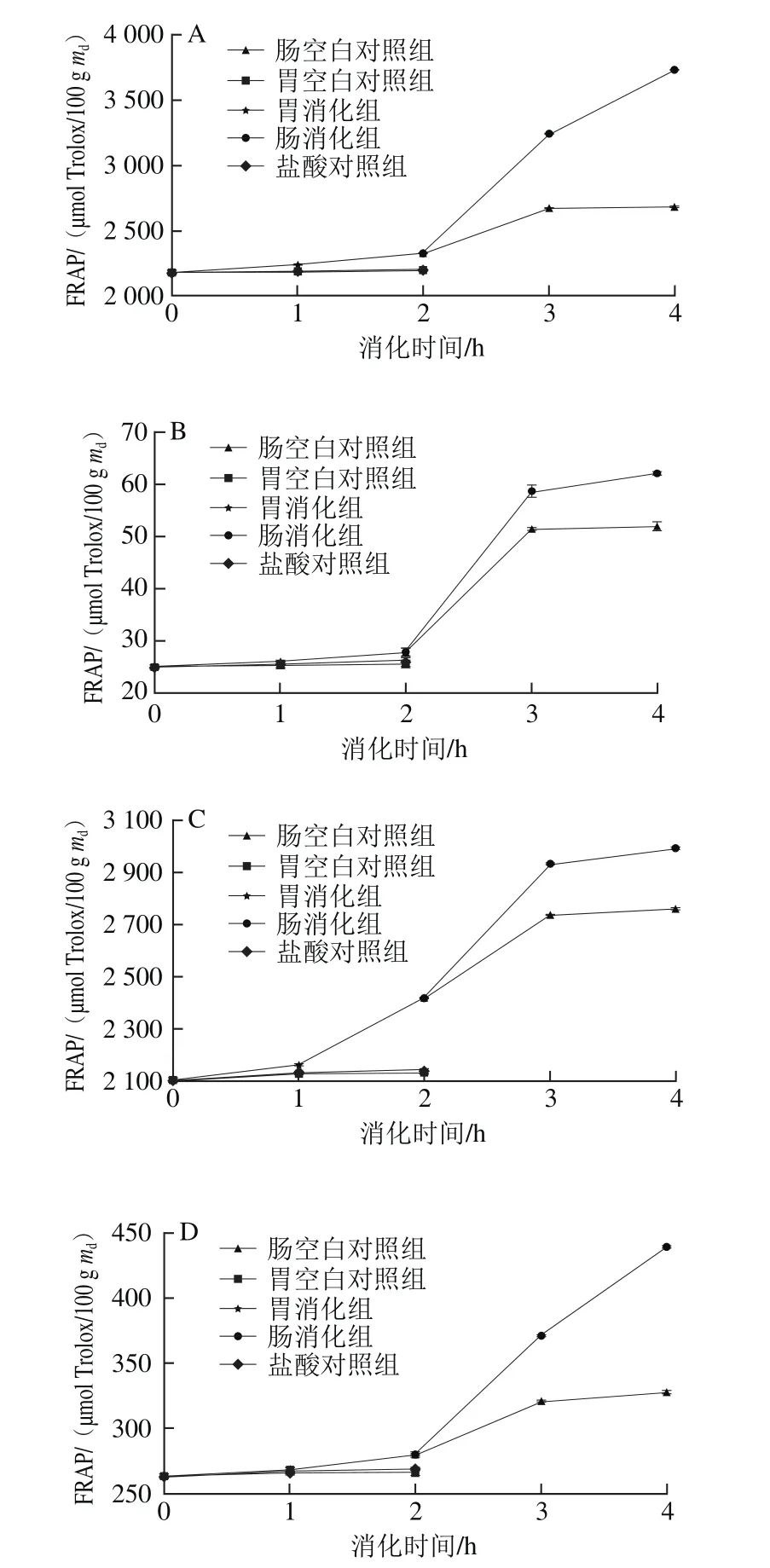
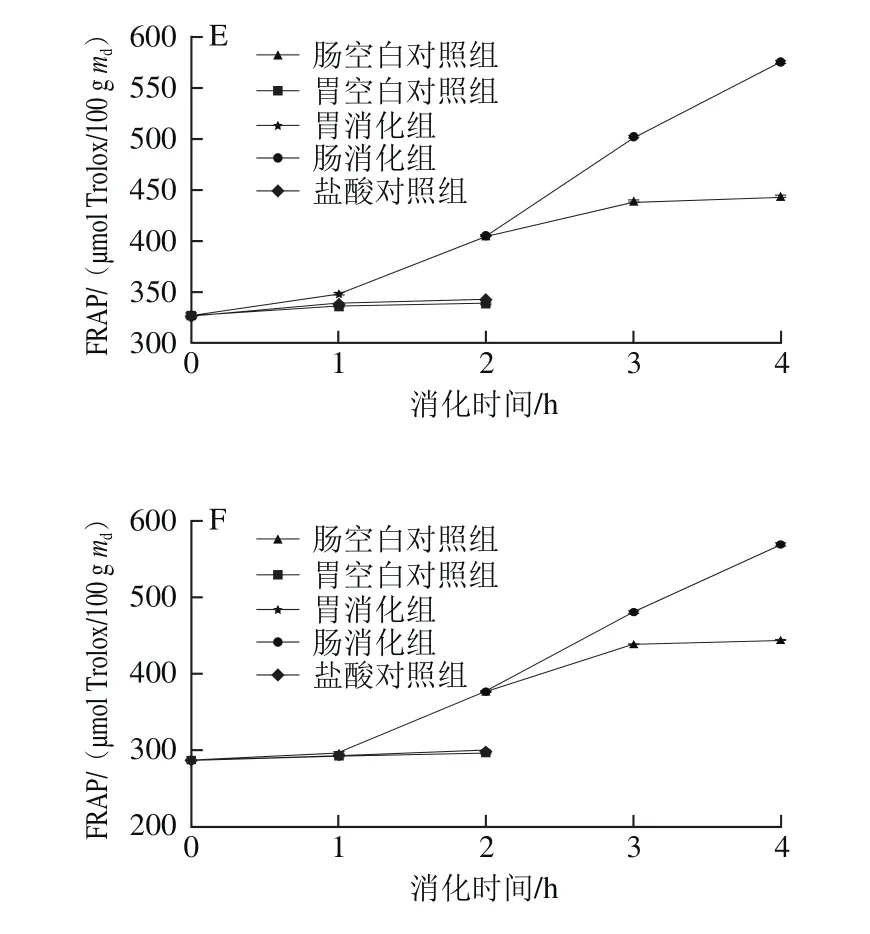
图5 6 种黑色食品模拟胃、肠消化液中FRAPFig.5 Variations in FRAP activity of six kinds of black foods during simulated gastrointestinal digestion
在模拟肠消化阶段,肠空白对照组在肠消化阶段变化不明显,肠消化组与肠空白对照组相比,黑米的FRAP增长率最大,经过2 h消化后,其FRAP达到肠空白对照组的1.39 倍,肠空白对照组与肠消化组之间差异显著。6 种样品在模拟肠消化0~1 h FRAP均有显著增加,黑小米在1~2 h增长趋势趋于稳定,而黑米、黑苦荞、黑麦、黑豆和黑绿豆仍持续增长,模拟肠消化2 h时后黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的FRAP分别增长了60%、124%、23%、56%、42%和51%,结果显著大于肠空白对照组。其中黑小米的FRAP在肠消化2 h内增长率最大,从27.73 μmol Trolox/100 g md增加到62.01 μmol Trolox/100 g md,增长了124%。
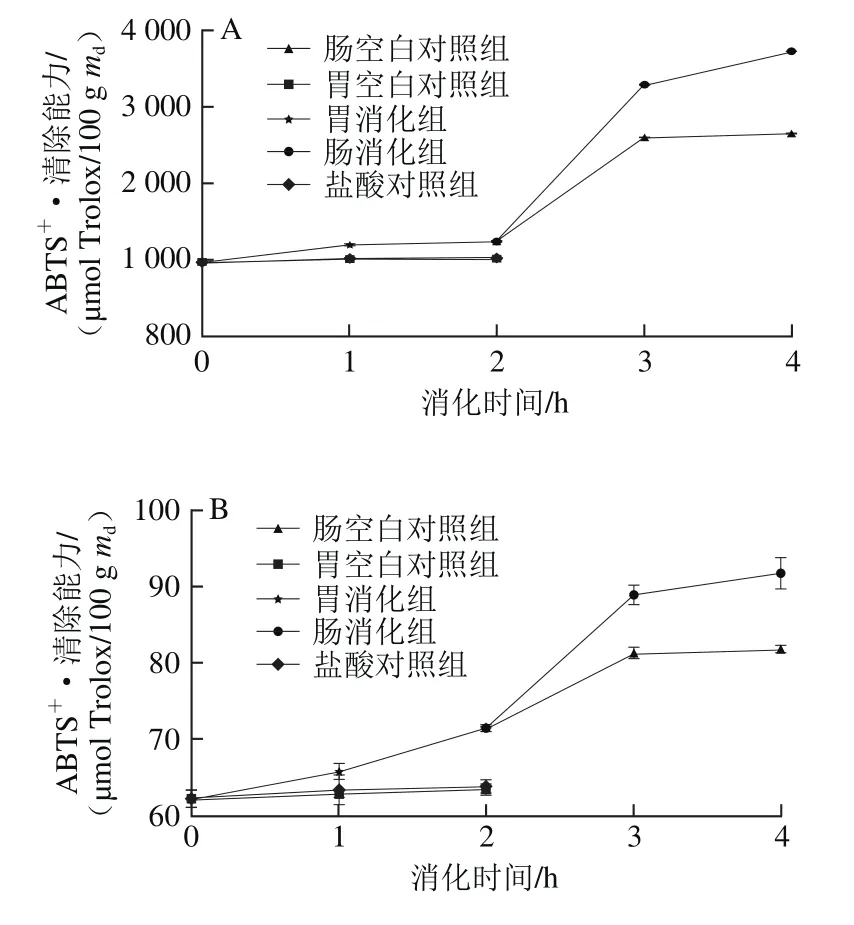
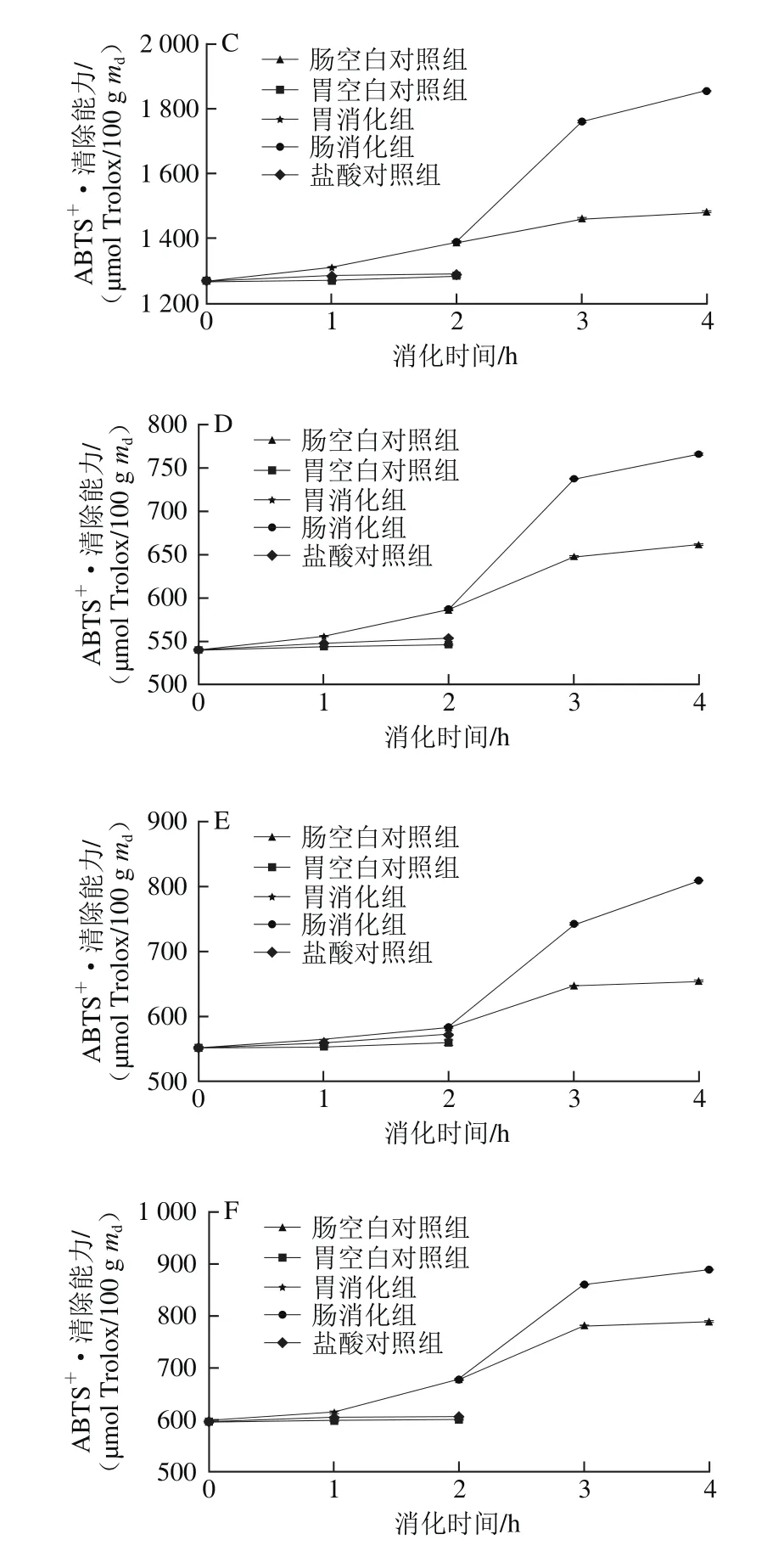
图6 6 种黑色食品模拟胃、肠消化液中ABTS+·清除能力Fig.6 Variations in ABTS radical scavenging capacity of 6 kinds of black foods during simulated gastrointestinal digestion
如图6所示,胃空白对照组和盐酸对照组在胃消化阶段变化不明显,两组之间没有显著差异(P>0.05),胃消化组与此两组相比,黑米的ABTS+·清除能力增长率最大,经过2 h消化后,其ABTS+·清除能力分别达到胃空白对照组和盐酸对照组的1.23 倍和1.20 倍,胃消化组与胃空白对照组、盐酸对照组之间差异显著(P<0.05)。黑米和黑豆的消化组的ABTS+·清除能力增长趋势在0~2 h 时较为平稳,黑小米、黑苦荞、黑麦和黑绿豆的ABTS+·清除能力在0~1 h时较为平稳,在1~2 h时增长较为显著。黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的ABTS+·清除能力分别增长了28%、15%、9%、9%、6%和14%,显著大于盐酸对照组和胃空白对照组。其中黑米的ABTS+·清除能力在胃消化2 h内增长率最大,从972.53 μmol Trolox/100 g md增加到1 244.99 μmol Trolox/100 g md,增长了28%。
模拟肠消化阶段,肠空白对照组变化不明显,肠消化组与肠空白对照组相比,黑米的ABTS+·清除能力增长率最大,经过2 h消化后,其ABTS+·清除能力达到肠空白对照组的1.40 倍,肠空白对照组与模拟肠消化组之间差异显著(P>0.05)。6 种样品在0~1 h内ABTS+·清除能力的变化趋势均有显著增加,而在1~2 h增长不明显。肠消化2 h时后黑米、黑小米、黑苦荞、黑麦、黑豆和黑绿豆的ABTS+·清除能力与肠空白对照组相比分别增长了199%、28%、34%、30%、38%和31%(P<0.05)。经过2 h肠消化后,黑米的ABTS+·清除能力增长率也最大,从1 244.99 μmol Trolox/100 g md增加到3 727.14 μmol Trolox/100 g md,增长了199%。
在模拟胃液消化过程中,6 种黑色食品提取液的抗氧化活性(DPPH自由基清除能力、FRAP和ABTS+·清除能力)呈逐渐上升的趋势。其中,DPPH自由基清除能力的增长率以黑豆最大,FRAP增长率以黑绿豆的最大,ABTS+·清除能力增长率以黑米最大,分别达到了114%、31%和28%。在模拟肠消化条件下,DPPH自由基清除能力的增长率以黑苦荞最大,FRAP增长率以黑小米最大,ABTS+·清除能力增长率以黑米最大,分别达到了161%、124%和199%。上述3 个实验的结果均表现为6 种黑色食品在经过胃、肠消化后抗氧化值显著增加,不同方法测定抗氧化值的变化趋势均与多酚和黄酮含量的变化趋势相近。模拟消化后6 种黑色食品的抗氧化值均高于化学提取法,这可能与多酚、黄酮等抗氧化物质的释放有关。王慧清等[25]通过对3 种全麦粉体外模拟胃、肠消化的研究表明:经过胃消化阶段,3 种全麦粉的抗氧化值增加了1.14~2.92 倍;肠消化阶段抗氧化值增加了1.72~2.24 倍。胡义东等[21]的研究显示,芒果体外模拟胃、肠消化后的抗氧化值分别增加了2.33 倍和1.71 倍。Ti Huihui等[8]的研究结果显示,稻米经过模拟胃、肠消化后抗氧化值增大为原来的285.7%。谷类经过胃、肠的消化后,其潜在的抗氧化活性成分被释放,抗氧化能力提高[26]。因此,6 种黑色食品通过模拟胃、肠的4 h消化过程有利于其活性成分的释放,使其抗氧化活性显著提升。盛雪飞[27]研究了柑橘中黄酮的抗氧化及协同作用,发现槲皮素和芦丁与其他的黄酮单体组合时可产生抗氧化协同作用。不同活性物质之间发生的协同作用可使它们的抗氧化活性增强,由此猜测,经过模拟胃、肠的消化使多酚和黄酮等活性物质的存在形式发生改变,释放量增加,同时影响了它们之间的相互作用,使抗氧化协同作用增加,最终使这6 种黑色食品的抗氧化活性增加。
2.5 不同样品多酚、黄酮含量与抗氧化活性的相关性分析
6 种样品的多酚、黄酮含量和抗氧化活性的相关性如表2所示,6 种黑色食品胃消化阶段胃消化组的多酚、黄酮含量和抗氧化活性存在强相关性(R2=0.721~0.999,P<0.05)。黑米的胃消化阶段在6 种黑色食品中的相关性最高(R2=0.885~0.999,P<0.05)。6 种黑色食品肠消化阶段肠消化组的多酚、黄酮含量和抗氧化活性存在强相关性(R2=0.716~0.999,P<0.05)。黑米肠消化阶段在6 种黑色食品中的相关性最高(R2=0.984~0.999,P<0.05)(表3)。进一步证明了胃、肠消化有助于黑米、黑苦荞等粮谷类黑色食品多酚和黄酮类化合物的释放以及抗氧化活性的提升。
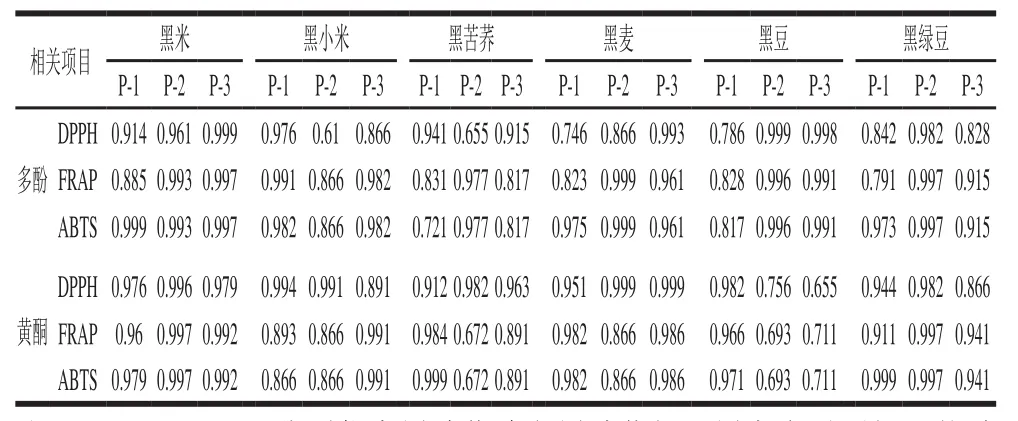
表2 不同黑色食品在模拟胃消化过程中的多酚、黄酮含量与抗氧化活性之间的相关性Table2 Correlation coefficients between antioxidant activity and phenolic profiles (total phenol contents, total fl avonoids contents) in different black foods during simulated gastric digestion
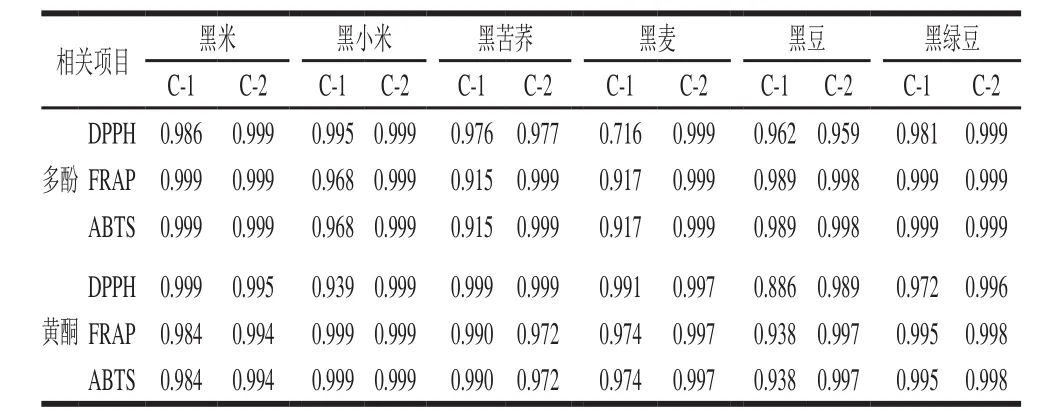
表3 不同黑色食品在模拟肠消化过程中的多酚、黄酮含量与抗氧化活性之间的相关性Table3 Correlation coefficients between antioxidant activity and phenolic profiles (total phenol contents and total flavonoids contents) in different black foods during simulated intestinal digestion
3 结 论
本实验通过体外模拟消化法对6 种黑色食品中的抗氧化成分及其活性进行了研究。结果表明:1)各黑色食品未消化前的抗氧化成分具有显著性差异(P<0.05)。多酚含量在61.05~670.07 mg GAE/100 g md之间,黄酮含量为46.04~560.55 mg CE/100 g md。各黑色食品的抗氧化活性具有显著性差异(P<0.05),DPPH自由基清除能力介于41.50~12 445.89 μmol Trolox/100 g md之间;FRAP介于492.57~13 312.62 μmol Trolox/100 g md之间;ABTS+·清除能力在422.42~13 832.58 μmol Trolox/100 g md之间。2)在模拟胃消化的条件下,黑豆的黄酮释放量增长率最大,达到41%,黑小米多酚释放量增长率最大(28%),而黑米的多酚释放量最高(130.22 mg GAE/100 g md)。在模拟肠消化条件下,黑绿豆的黄酮释放量增长率最大,增长了52%。黑麦的多酚释放量增长率最大,达113%,而黑米多酚释放量最高,达195.57 mg GAE/100 g md。3)在模拟胃、肠消化过程中,6 种黑色食品提取液的抗氧化活性均呈逐渐上升的趋势。在模拟胃消化条件下,DPPH自由基清除能力、FRAP、ABTS+·清除能力的增长率分别以黑豆、黑绿豆和黑米最大,其值分别为114%、31%和28%。在模拟肠消化条件下,DPPH自由基清除能力、FRAP和ABTS+·清除能力增长率分别以黑苦荞、黑小米和黑米最大,其值分别达到了161%、124%和199%。表明胃、肠消化能显著提高黑色食品的抗氧化活性。所有黑色食品中,黑米在消化前后均表现出最强的抗氧化活性,通过胃、肠消化后,其DPPH自由基清除能力、FRAP和ABTS+·清除能力分别为4 531.79 、3 729.69 μmol Trolox/100 g md和3 727.14 μmol Trolox/100 g md,分别较未消化时增长了200%、171%和383%,是较有应用前景的一种黑色食品。
[1] 王国良, 任顺成, 王鹏. 黑色食品的营养功能及研究展望[J]. 食品工业科技, 2008(10): 308-311. DOI:10.13386/j.issn1002-0306.2008.10.072.
[2] 周红柳. 黑色食品的营养保健功能探析[J]. 消费导刊, 2009(4): 215-216. DOI:10.3969/j.issn.1008-7508.2012.04.052.
[3] 应超. 黑色食品中黑色素的研究现状[J]. 科学教育, 2010, 16(1): 95-96.
[4] 要萍, 于金侠. 功能性黑色食品的研究与开发[J]. 粮油食品科技,2010, 18(1): 5-7. DOI:10.16210/j.cnki.1007-7561.2010.01.023.
[5] SAVA V M, GALKIN B N, HONG M Y, et al. A novel melaninlike pigment derived from black tea leaves with immuno-stimulating activity[J]. Food Research International, 2001, 34(4): 337-343.DOI:10.1016/S0963-9969(00)00173-3.
[6] 孙玲, 张名位, 池建伟, 等. 黑米资源的黄酮含量及其与粒形性状的相关性[J]. 湖北农学院学报, 2000, 20(1): 1-5.
[7] ZHANG Mingwei, ZHANG Ruifeng, ZHANG Fangxuan, et al.Phenolic prof i les and antioxidant activity of black rice bran of different commercially available varieties[J]. Journal of Agricultural & Food Chemistry, 2010, 58(13): 7580-7587. DOI:10.1021/jf1007665.
[8] TI Huihui, ZHANG Ruifen, LI Qing, et al. Effects of cooking and in vitro digestion of rice on phenolic prof i les and antioxidant activity[J].Food Research International, 2015, 76: 813-820. DOI:10.1016/j.foodres.2015.07.032.
[9] 刘冬, 万红霞, 赵旭, 等. 小麦不同部位在体外模拟消化过程中抗氧化活性的变化规律[J]. 现代食品科技, 2016, 32(4): 94-99.DOI:10.13982/j.mfst.1673-9078.2016.4.016.
[10] SUN Jie, CHU Yifang, WU Xianzhong, et al. Antioxidant and antiproliferative activities of common fruits[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7449-7454. DOI:10.1021/jf020665f.
[11] MILLER D D, SCHRICKER B R, RASMUSSEN R R, et al. An in vitro method for estimation of iron availability from meals[J].American Journal of Clinical Nutrition, 1981, 34(10): 2248-2256.
[12] BURSAL E, KÖKSAL E, GÜLÇIN İ, et al. Antioxidant activity and polyphenol content of cherry stem (Cerasus avium L.) determined by LC-MS/MS[J]. Food Research International, 2013, 51(1): 66-74.DOI:10.1016/j.foodres.2012.11.022.
[13] ZIELINSKI A A F, HAMINIUK C W I, ALBERTI A, et al. A comparative study of the phenolic compounds and the in vitro,antioxidant activity of different Brazilian teas using multivariate statistical techniques[J]. Food Research International, 2014, 60(6):246-254. DOI:10.1016/j.foodres.2013.09.010.
[14] GORJANOVIĆ S, KOMES D, PASTOR F T, et al. Antioxidant capacity of teas and herbal infusions: polarographic assessment[J].Journal of Agricultural and Food Chemistry, 2012, 60(38): 9573-9580.DOI:10.1021/jf302375t.
[15] LU Xiaonan, ROSS C F, POWERS J R, et al. Determination of total phenolic content and antioxidant activity of garlic (Allium sativum) and elephant garlic (Allium ampeloprasum) by attenuated total reflectance-Fourier transformed infrared spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5215-5221. DOI:10.1021/jf201254f.
[16] CHANG K C, JUNG K H, SOOK Y C H. Anthocyanins from soybean seed coat inhibit the expression of TNF-α-induced genes associated with ischemia/reperfusion in endothelial cell by NF-κB-dependent pathway[C]//第十五届国际药理学大会论文集. 北京: 中国药理学会, 2006: 157.
[17] OH J, JO H, CHO A R, et al. Antioxidant and antimicrobial activities of various leafy herbal teas[J]. Food Control, 2013, 31(2): 403-409.DOI:10.1016/j.foodcont.2012.10.021.
[18] MIRA N V M D, MASSARETTO I L, PASCUAL C D S C I, et al.Comparative study of phenolic compounds in different Brazilian rice (Oryza sativa L.) genotypes[J]. Journal of Food Composition &Analysis, 2009, 22(5): 405-409. DOI:10.1016/j.jfca.2008.06.012.
[19] SHAO Yafang, Xu Feifei, Sun Xiao, et al. Identification and quantification of phenolic acids and anthocyanins as antioxidants in bran, embryo and endosperm of white, red and black rice kernels(Oryza sativa L.)[J]. Journal of Cereal Science, 2014, 59(2): 211-218.DOI:10.1016/j.jcs.2014.01.004.
[20] 彭梦雪, 从彦丽, 刘冬. 模拟胃肠消化评价苹果多酚、黄酮及抗氧化活性的相关性[J]. 现代食品科技, 2016, 32(1): 122-128; 296.DOI:10.13982/j.mfst.1673-9078.2016.1.020.
[21] 胡义东, 文良娟. 体外模拟胃肠消化对芒果抗氧化成分及其活性的影响[J]. 南方农业学报, 2014, 45(9): 1652-1656. DOI:10.3969/j.issn.2095-1191.2014.9.1652.
[22] 从彦丽, 彭梦雪, 刘冬, 等. 柑橘在体外模拟胃肠消化过程中总多酚、总黄酮及总抗氧化活性的变化规律[J]. 食品科学, 2016,37(17): 96-103. DOI:10.7506/spkx1002-6630-201617016.
[23] 王谢祎, 翟宇鑫, 李倩, 等. 南酸枣在模拟消化过程中抗氧化活性及多酚含量分析[J]. 食品科学, 2016, 37(11): 7-11. DOI:10.7506/spkx1002-6630-201611002.
[24] 从彦丽, 彭梦雪, 王慧清, 等. 梨体外模拟胃肠消化过程中多酚、黄酮及抗氧化活性的变化规律[J]. 现代食品科技, 2016, 32(6): 29-34;84. DOI:10.13982/j.mfst.1673-9078.2016.6.006.
[25] 王慧清, 刘冬, 孙海燕, 等. 全麦粉模拟消化过程中的抗氧化活性研究[J]. 现代食品科技, 2015, 31(10): 122-128. DOI:10.13982/j.mfst.1673-9078.2015.10.021.
[26] MASISI K, BETA T, MOGHADASIAN M H. Antioxidant properties of diverse cereal grains: a review on in vitro and in vivo studies[J]. Food Chemistry, 2015, 196: 90-97. DOI:10.1016/j.foodchem.2015.09.021.
[27] 盛雪飞. 柑橘黄酮抗氧化及协同作用研究[D]. 杭州: 浙江大学,2010: 40.
