浆水中产香酵母菌菌株的筛选及其增殖培养基优化
2018-03-20贠建民艾对元严海娇李多佳
姚 博,贠建民*,艾对元,严海娇,白 杰,李多佳
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
浆水是我国西北地区一种传统发酵酸性调味食品,一般是用经焯水后的蔬菜加入面汤或米汤经微生物发酵制成[1]。其汤汁略呈乳白色,口味酸醇清香,含有丰富的益生菌群[2],营养价值高,具有清热解暑、开胃止渴、调理脏腑和降血压等功效[3-4],长期以来深受西北人民青睐。
自然发酵浆水中微生物菌系复杂,其中优势菌群为乳酸菌和酵母菌,赋予了浆水良好的风味[5]。相较于工业化纯种发酵而言,传统多菌种混合发酵工艺生产的产品味道更优、风味更浓,但传统发酵过程因受原料、地域、生产规模和方法等因素的影响,致使浆水的风味品质差异较大,且发酵后期易受霉菌污染[6],不便于实现工业化、标准化生产。因此,开发安全、卫生、健康的浆水工业化产品,是人们的迫切需要。
直投式发酵菌剂是传统发酵食品实现工艺现代化改造过程的关键[7],而筛选获得产香性能优良的发酵菌株是开发直投式发酵菌剂的基础。目前,浆水的研究主要集中在浆水发酵工艺研究[8-9]、微生物的分离鉴定[5-6]及其亚硝酸盐的变化[3,10]等方面,对于浆水中优良功能菌株的筛选研究报道甚少。根据本实验室多年的研究,浆水中的特征香气成分为柠檬烯、乙酸乙酯、乙醛、蒎烯、苯乙醇、正己醇和乙酸,这些香气物质主要来自于发酵过程微生物的代谢作用[11]。为此,本研究拟通过筛选浆水中产香性能优良的酵母菌菌株,并优化其增殖培养基,旨在为开发浆水辅助发酵直投式菌剂及实现工业化生产提供产香菌种来源和技术参考。
1 材料与方法
1.1 材料、试剂与培养基
浆水由甘肃天水孟姑浆水厂提供。
环己酮(色谱纯) 美国Sigma Aldrich公司;酵母膏、蛋白胨、牛肉膏、琼脂 北京奥博星生物技术有限公司;其他试剂均为国产分析纯。
酵母菌分离培养基(yeast extract-peptone-dextrose,YEPD):葡萄糖20 g,酵母膏10 g,蛋白胨20 g,琼脂20 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
酵母菌液体培养基(yeast extract-peptone-dextrose broth,YPB):葡萄糖20 g,酵母膏10 g,蛋白胨20 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
豆芽汁培养基:豆芽汁(10%)100 g,葡萄糖20 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
麦芽汁培养基:将大麦芽粉碎,麦芽粉与水的比例为1∶4(g/mL),38 ℃保温2 h,升温至45 ℃,30 min,再提高到50℃,30 min,再升华至60 ℃,糖化1~1.5 h至完全糖化,并用鸡蛋清煮沸澄清,稀释至适当浓度,121 ℃高压蒸汽灭菌20 min。
酵母基础培养基:葡萄糖20 g,KH2PO41 g,MgSO40.5 g,(NH4)2SO40.5 g,酵母膏1g,蒸馏水1000 mL,121 ℃高压蒸汽灭菌20 min。
马铃薯培养基(potato dextrose broth,PDB):马铃薯(去皮)200 g,葡萄糖20 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SW-CJ-1FD洁净工作台 苏州安泰空气技术有限公司;THZ-98A恒温振荡器 上海一恒科学仪器有限公司;101-1-S-II电热恒温培养箱 北京科伟永兴仪器有限公司;YX280B手提式不锈钢压力蒸汽灭菌器 上海三申医疗器械有限公司;TRACE 1310气相色谱仪、TG-WAX色谱柱 美国Thermo Scientific公司;顶空固相微萃取装置(DVB/CAR/PDMS萃取器) 美国Supelco公司。
1.3 方法
1.3.1 产香酵母菌菌株的筛选
1.3.1.1 酵母菌菌株的分离
吸取10 mL浆水于已灭菌的装有90 mL无菌生理盐水的500 mL三角瓶中,充分摇匀,制备菌悬液,梯度稀释至10-7,吸取稀释液0.1 mL均匀涂布在已灭菌的YEPD固体平板培养基上,28 ℃培养2~3 d。取菌落密度适中的平板,选择具有典型酵母菌菌落特征的单菌落进行划线分离[12]。
1.3.1.2 产香酵母菌菌株的筛选
分别挑取1环纯化后的酵母菌菌种接种于50 mL/150 mL 10 °Be′麦芽汁培养基中,28 ℃、150 r/min振荡培养1~5 d。
由10 位身体健康,无不良嗜好、偏食和变态性反应的同学组成评价小组,对发酵后的酵母菌培养液持续每日进行外观及气味的评价,综合评价,挑选出产香气良好、持续时间长、无不良气味的几株酵母菌菌株[13]。同时对其发酵残糖量、生物量和挥发性成分进行测定优选产香酵母菌。
1.3.2 发酵性能检测
残糖量测定:采用3,5-二硝基水杨酸法[14]。生物量测定:采用质量恒定法[15]。产香性能测定:采用半定量顶空固相微萃取-气相色谱-质谱(headspace solidphase microextraction and gas chromatography-mass spectrometry,HSME-GC-MS)联用技术对酵母菌菌株发酵产物进行挥发性成分测定,以灭菌后不接菌培养基在同等条件培养后作为对照。
萃取条件:在装有磁力搅拌器的顶空瓶中加入10 mL发酵液,并加入1 g NaCl和16 μL/mL的10 μL环己酮,40 ℃恒温搅拌30 min,将已老化的萃取头插入样品瓶的顶空部分,吸附30 min,进样口温度250 ℃,解吸10 min。
GC条件:TG-WAX色谱柱(60 m×0.25 mm,0.25 μm);载气:氦气,流量1.0 mL/min;升温程序:初始温度40 ℃,保持5 min,以4 ℃/min升至100 ℃,保持5 min,再以5 ℃/min升至180 ℃,保留10 min。
MS条件:接口温度280 ℃,离子源温度230 ℃,电子电离源,电子能量70 eV,扫描质量范围50~450 u。经计算机在Nist及Wiley标准谱库的检索对比,通过计算机相应的保留指数对比,匹配度大于700(最大值为1 000)进行确认。
内标法[16](假定各组分的响应因子为1)计算公式为:mi=(ms/As)×Ai。其中mi为组分的质量;ms为内标物的质量;Ai为组分的峰面积;As为内标物的峰面积。
1.3.3 菌株鉴定
1.3.3.1 生理生化鉴定
根据《酵母菌特性及鉴定手册》[17],对该菌株进行菌体形态,包括子囊孢子、掷孢子、假菌丝的观察,及糖发酵实验、碳源同化实验、氮源同化实验、类淀粉化合物生成、硝酸盐利用、脲酶实验等生理生化鉴定。
1.3.3.2 分子生物学序列鉴定
将提取的基因组DNA委托北京奥维森生物科技有限公司对26S rDNA中的D1/D2区域基因进行序列扩增。得到的26S rDNA D1/D2区序列结果提交GenBank数据库,所得基因序列通过BLAST程序提交,NCBI数据库中进行同源序列检索,将目标菌株和应用BLAST检索到的与之较高的同源性菌株的26S rDNA中D1/D2区域基因序列作最大同源性比较分析[18]。
1.3.4 酵母菌菌株增殖培养基优化
1.3.4.1 增殖基础培养基的筛选
挑取1 环斜面活化的酵母菌接种到10 mL YEPD培养基中,28 ℃、180 r/min振荡培养10 h,制成酵母富集液,用无菌水稀释至约10-5的菌悬液,4 ℃保藏备用。
分别配制10 °Be′麦芽汁培养基、豆芽汁培养基、YPB培养基、PDB培养基、酵母基础培养基,接种3%菌悬液于各培养基(30 mL/150 mL)中,28 ℃、180 r/min振荡培养24 h,测定各培养基中的细胞浓度。分别配制4、6、8、10、12、14 °Be′的麦芽汁培养基,同上述条件,测定各培养基中的细胞浓度。细胞浓度测定采用血球计数板法[19]。
1.3.4.2 生长曲线的测定
吸取3%的菌悬液接种于30 mL/150 mL的麦芽汁培养基中,28 ℃、180 r/min振荡培养,每隔2 h取样测定细胞浓度[20]。
1.3.4.3 增殖培养基优化
在装液量30 mL/150 mL、接种量3%、28 ℃、180 r/min条件下振荡培养20 h后,以发酵液中的细胞浓度为优选指标,对麦芽汁培养基进行优化。
以筛选出的麦芽汁培养基为对照,在其基础上添加10 g/L的葡萄糖、蔗糖、麦芽糖、可溶性淀粉筛选最佳碳源;添加5、10、20、30、40、50 g/L的葡萄糖筛选最适糖质量浓度;在最佳碳源的基础上添加0.5 g/L氮元素的酵母膏、牛肉膏、蛋白胨、硫酸铵、尿素、硝酸钾筛选最佳氮源;添加1、2、3、4、5、6 g/L的牛肉膏筛选最适氮源质量浓度;在最佳碳源和氮源基础上,添加0.5 g/L的KH2PO4、NaCl、MgSO4、FeSO4、ZnSO4、CaCl2筛选最佳无机盐种类,添加0.1、0.3、0.5、0.7、0.9、1.1 g/L的KH2PO4筛选最适无机盐质量浓度[21]。
在单因素试验结果的基础上,选取葡萄糖、牛肉膏、KH2PO4质量浓度为考察因素,使用Design-Expert对各因素进行中心组合响应面设计,以细胞浓度为响应值,以期得到最优培养基组合。
1.3.4.4 Y16菌株在优化增殖培养基中产香能力的GC-MS检测
为进一步检验优选菌株增殖后的产香能力,采用同1.3.2节方法,对其在最佳增殖培养基上发酵后的乙酸乙酯及柠檬烯含量进行测定。
2 结果与分析
2.1 菌株筛选结果
2.1.1 感官评定结果
从浆水中分离筛选出16 株酵母菌,编号为Y1~Y16,分别接种于10 °Be′麦芽汁培养基中,28 ℃、150 r/min振荡培养1~5 d。发酵期间对酵母菌发酵液持续每日进行外观及气味的评价,综合评价结果见表1。
由表1可以看出,分离出的16 株酵母菌发酵液的感官风味特征各异,其中Y3、Y5、Y12、Y15和Y16共5 株酵母菌菌株不产生褐变,产果香持久、浓郁,风味良好;Y2、Y4、Y7、Y9、Y10和Y11共6 株酵母菌产生较淡的果香味,无明显异味,其中Y9发酵第3天后发生褐变;Y6、Y13发酵前期产生香味,第3天后出现不良风味;Y1发酵过程中出现不良风味;Y8发酵中轻微褐变,香味不突出;Y14发酵中无褐变,无明显香味和异味。综上,Y3、Y5、Y12、Y15和Y16共5 株酵母菌株产香味持久浓郁,产香性能突出,发酵过程中无不良风味,故选作产香初筛菌株。
2.1.2 5 株初筛酵母菌发酵过程残糖量及生物量变化

图1 发酵过程中5 株酵母菌残糖量的变化Fig. 1 Change in residual sugar during fermentation of 5 selected yeasts

图2 发酵过程中5 株酵母菌生物量的变化Fig. 2 Change in biomass during fermentation of 5 selected yeasts
酵母菌利用糖的能力越高,其生长活力旺盛,发酵性能、物质转化能力就越强。其产生的相应风味物质也就越多。由图1可看出,Y5、Y12、Y15和Y16菌株随着发酵时间的延长,残糖量逐步降低,且降低程度较快,说明对糖的利用速率较快,发酵能力较好,而Y3菌株发酵能力相对较弱。由图2可看出,5 株酵母菌的生物量增速均较快,在24 h后基本处于平稳状态,其中Y12和Y16菌株的生物量最高。
2.1.3 5 株酵母菌发酵过程产挥发性成分测定结果

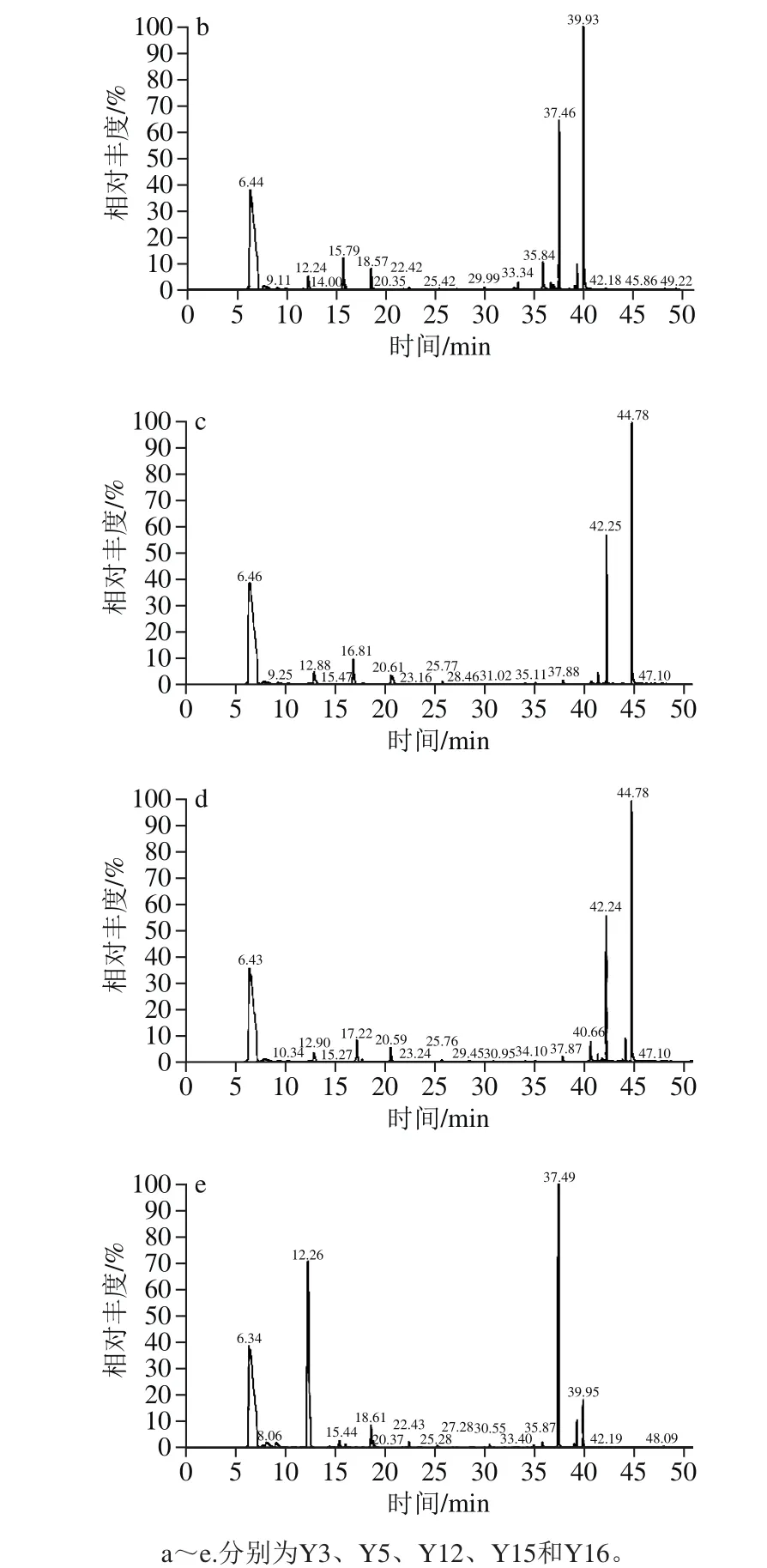
图3 5 株酵母菌菌株的GC-MS总离子流图Fig. 3 Total ion chromatograms of GC-MS for volatile compounds produced by five yeasts
由图3可以得出,初筛的5 株酵母菌的发酵产物中均含有较高的浆水主体香气物质乙酸乙酯(出峰时间6.4 min),其中Y12菌株的乙酸乙酯产量最高,为226.76 μg/mL,Y16菌株的乙酸乙酯产量次之,为204.45 μg/mL,且该菌株产柠檬烯(出峰时间14.07 min)的含量也达到0.063 μg/mL。由于柠檬烯和乙酸乙酯是浆水中最主要的两种主体风味物质,对浆水风味贡献率最大[11],故Y16菌株的发酵产物风味更接近于传统自然发酵浆水特有的风味。
鉴于Y16酵母菌菌株的糖利用速率快、菌体生物量高,且其发酵产物中含有较高的浆水中的主体风味柠檬烯和乙酸乙酯,故确定Y16酵母菌菌株为浆水发酵的优良产香菌株。
2.2 菌株鉴定结果
2.2.1 菌株形态学及生理生化鉴定结果
固体培养特征:菌落小,灰白色,圆屋顶状,半透明,表面平滑,边缘整齐,黏稠。
液体培养特征:澄清,后期有白色沉淀,有菌璞。
根据《酵母菌特性及鉴定手册》,对Y16酵母菌菌株进行了生理生化鉴定,结果如表2所示。通过对比,该菌株与异常汉逊酵母菌(Hansenula anomala)很相似。

表2 Y16菌株的生理生化实验结果Table 2 Physiological and biochemical characteristics of strain Y16
2.2.2 菌株分子生物学鉴定结果
对筛出的Y16菌株进行26S rDNA中的D1/D2区域基因序列分析鉴定,取其基因组DNA进行PCR扩增,对PCR产物进行电泳检测,结果如图4所示。
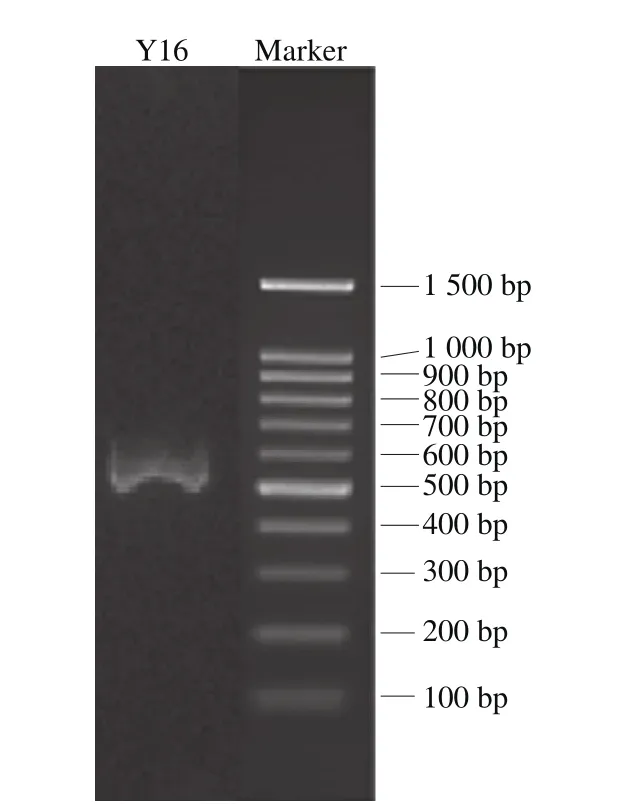
图4 Y16菌株的PCR电泳图Fig. 4 Electrophoregram of PCR amplified genomic DNA from strain Y16
Y16酵母菌26S rDNA中的D1/D2区域基因PCR扩增产物均在500~600 bp之间,结果提交GenBank,得知该条带大小为590 bp(登录号FJ972217),提交NCBI数据库进行BLAST序列比对,与Wickerhamomyces anomalus同源性为99.9%,结合菌落形态和生理生化特征鉴定,确定Y16为异常汉逊酵母。
2.3 增殖培养基优化结果
2.3.1 基础培养基的筛选结果
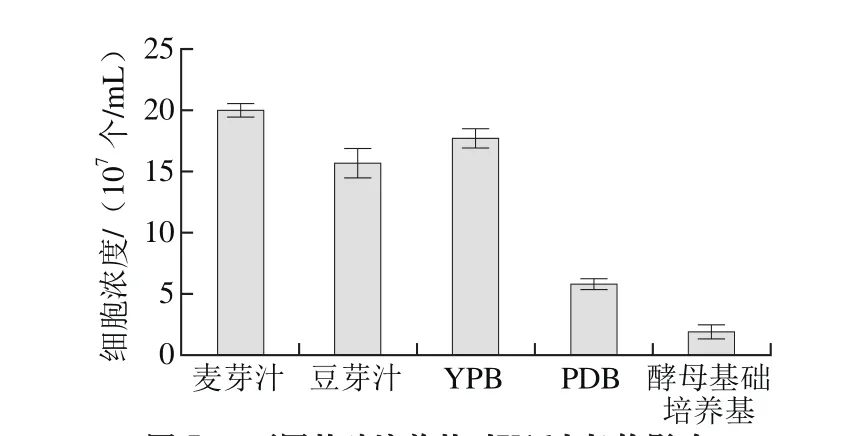
图5 不同基础培养基对Y16生长的影响Fig. 5 Effect of different basic media on on the growth of Y16

图6 麦芽汁培养基浓度对Y16生长的影响Fig. 6 Effect of different concentrations of wort medium the growth of Y16
由图5可知,Y16菌株均能利用麦芽汁、豆芽汁、YPB、PDB培养基生长,其中基础培养基麦芽汁的细胞增殖效果最好,细胞浓度达到1.99×108个/mL,因此选择麦芽汁培养基为基础培养基。由图6可知,随着麦芽汁浓度的增大,细胞浓度呈先上升后下降的趋势,说明麦芽汁浓度过高,会抑制酵母菌的生长,故选择10 °Be′的麦芽汁培养基作为基础培养基。
2.3.2 Y16菌株生长曲线测定结果
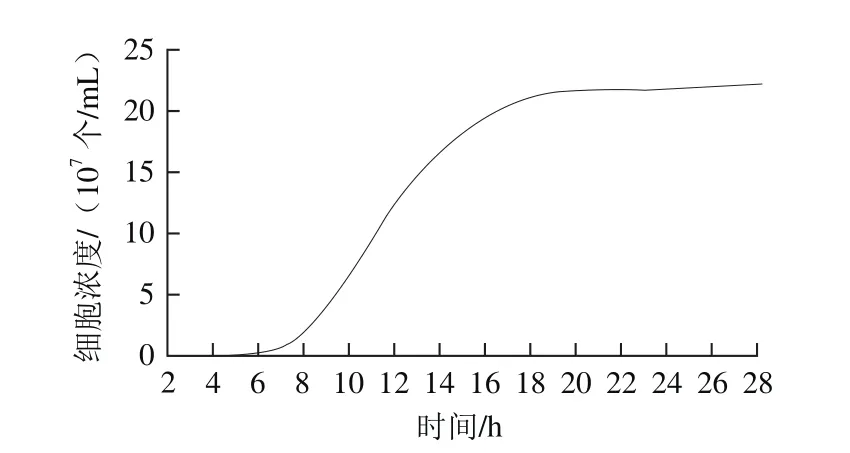
图7 Y16菌株生长曲线Fig. 7 The growth curve of Y16 strain
由图7可知,Y16菌株在培养6 h后,进入对数期,18 h达到对数生长末期;20 h进入稳定期,细胞浓度达到最大。为使菌体的总生长量和活性达到最大,故选择20 h时间点作为菌体收集点。
2.3.3 Y16菌株增殖培养基优化结果
2.3.3.1 碳源种类及碳源质量浓度对Y16菌株细胞浓度的影响

图8 碳源种类对Y16生长的影响Fig. 8 Effect of different carbon sources on the growth of Y16

图9 葡萄糖质量浓度对Y16生长的影响Fig. 9 Effect of different glucose concentrations on the growth of Y16
碳源是化能异养型微生物代谢所需的能量来源,选择适合的碳源对提高微生物的繁殖速度和代谢产物产量是非常关键的[22]。乙酰辅酶A是酵母菌体内合成柠檬烯及乙酸乙酯的起点[23-24],而乙酰辅酶A可由葡萄糖降解而来,所以增加适量的糖有助于提高乙酸乙酯和柠檬烯的含量。由图8可知,Y16菌株均能利用葡萄糖、麦芽糖、蔗糖、可溶性淀粉进行生长繁殖,其中利用葡萄糖细胞浓度增长最快。由图9可知,随着葡萄糖质量浓度的增长,Y16菌株生长越缓慢,说明高质量浓度的糖不利于微生物生长,添加葡萄糖质量浓度为10 g/L时,细胞浓度达到最大,为3.743×108个/mL,故选择添加10 g/L的葡萄糖作为补充碳源。
2.3.3.2 氮源种类及氮源质量浓度对Y16菌株细胞浓度的影响
氮是组成核酸和蛋白质的重要元素,微生物提供合成细胞物质代谢产物的原料[25],微生物在含有有机氮源的培养基中表现出生长旺盛,细胞浓度增长速度快,并有利于积累代谢产物。由图10可知,增加供试的6种氮源均有利于Y16菌株的生长,其中利用牛肉膏生长繁殖最快。由图11可知,添加牛肉膏质量浓度在2 g/L时,最有利于Y16菌株的生长,细胞浓度达到6.783×108个/mL,故选择2 g/L的牛肉膏作为补充氮源。

图10 氮源种类对Y16生长的影响Fig. 10 Effect of different nitrogen sources on the growth of Y16
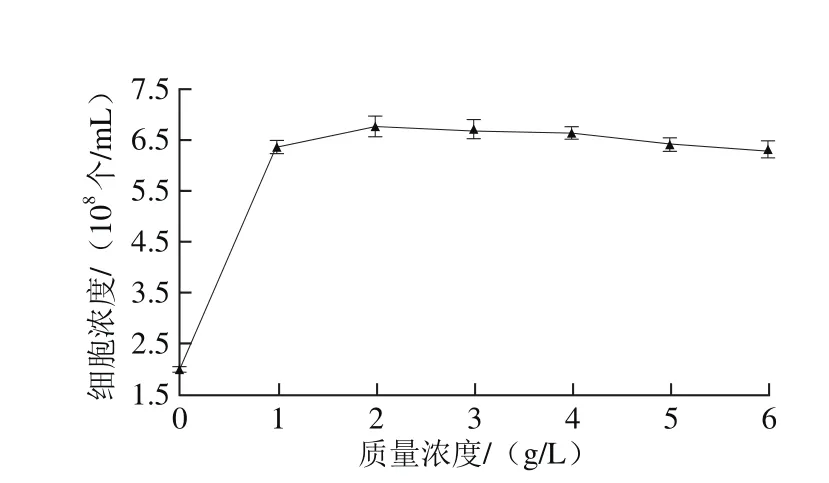
图11 牛肉膏质量浓度对Y16生长的影响Fig. 11 Effect of different beef extract concentrations on the growth of Y16
2.3.3.3 无机盐种类及KH2PO4质量浓度对Y16菌株细胞浓度的影响

图12 无机盐种类对Y16生长的影响Fig. 12 Effect of different salt species on the growth of Y16
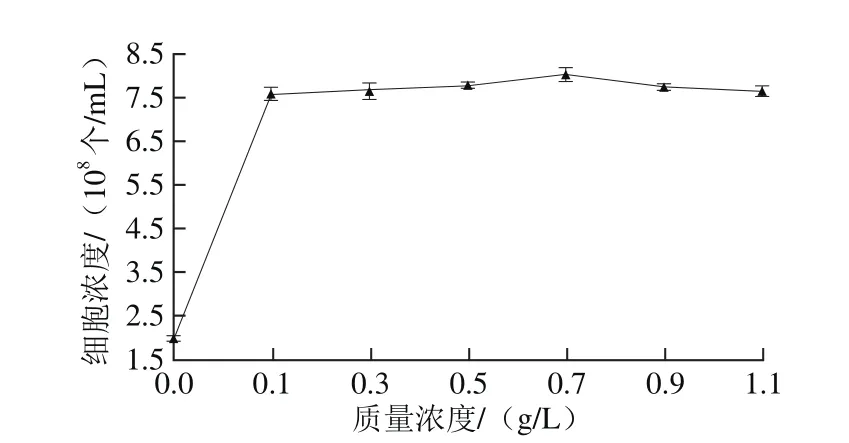
图13 KH2PO4质量浓度对Y16生长的影响Fig. 13 Effect of different KH2PO4 concentrations on the growth of Y16
由图12可知,供试的6 种无机盐均有利于Y16菌株的生长,其中KH2PO4最有利于Y16菌株细胞浓度的增长。已有文献报道表明,磷酸盐对酵母的生长及代谢均极为重要,培养基中添加一定量的磷酸盐,对产酯酵母的产酯有利[26]。由图13可知,在KH2PO4质量浓度为0.7 g/L时,细胞浓度达到最大,为8.017×108个/mL,故选择0.7 g/L的KH2PO4作为补充无机盐。
2.3.3.4 响应面优化Y16菌株增殖培养基结果
根据单因素试验结果,在10 °Be′麦芽汁基础培养基中分别添加葡萄糖10 g/L、牛肉膏2 g/L、KH2PO40.7 g/L,细胞浓度具有最大值。因此使用Design-Expert对培养基条件进行中心组合响应面试验分析,以细胞浓度为响应值,设计及优化结果如表3所示。

表3 响应面优化Y16菌株增殖培养基试验结果Table 3 Experimental design with response variable for response surface analysis
经二次多项回归拟合,得到培养液中以细胞浓度为响应值的回归方程:
Y=8.661 734+0.358 664A+0.388 513B+0.344 273C-0.590 5AB+0.36AC+0.580 5BC-0.824 556A2-0.923 555B2-0.700 816C2
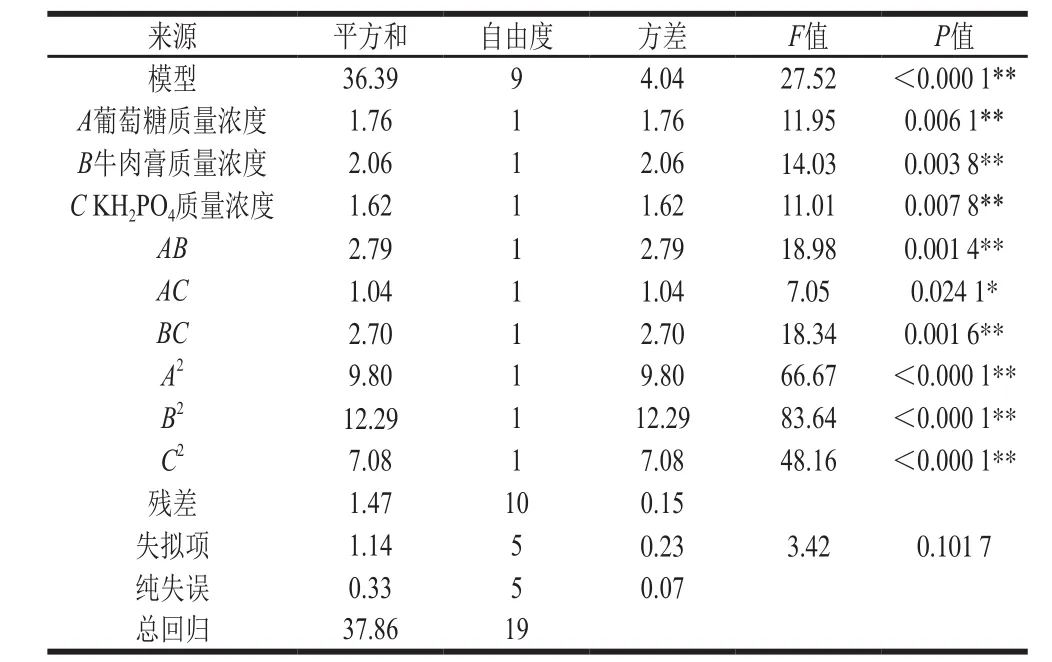
表4 响应面优化Y16菌株增殖培养基回归模型参数检验Table 4 Analysis of variance of response surface regression model
根据表4方差分析可看出,该模型优化Y16菌株培养基在α为0.01的水平上效果显著,回归方程失拟项检验不显著(P>0.05),其决定系数R2为0.961 2,表明该拟合方程与实际相符,误差较小,能较好地反映各因素与响应值的之间的关系,可以确定其培养基优化配方。其中,A、B、C、AB、BC、A2、B2、C2因素对Y16菌株细胞浓度的影响极显著(P<0.01),AC因素对Y16菌株细胞浓度增长的影响显著(P<0.05)。由各因素对试验指标的影响程度F值可以看出,牛肉膏对该菌株的细胞浓度增长影响最大,葡萄糖的影响次之,KH2PO4的影响最小。
由图14a可知,响应面曲面坡度陡峭且等高线扁而密集,说明添加的葡萄糖和牛肉膏两因素交互作用对Y16菌株细胞浓度有极显著影响;由图14b可知,响应面曲面坡度陡峭度降低,等高线较密集,说明添加的葡萄糖与KH2PO4两因素的交互作用对Y16菌株细胞浓度影响显著;由图14c可知,响应面曲面坡度陡峭,等高线密集,说明添加的牛肉膏与KH2PO4两因素的交互作用对Y16菌株细胞浓度影响极显著。
2.3.3.5 最优培养基配方确定及验证
通过对回归模型进行数学分析,得到Y16菌株在10 °Be’麦芽汁基础培养基上最佳的营养物添加量为葡萄糖11.05 g/L、牛肉膏2.27 g/L、KH2PO40.782 g/L,细胞浓度达到8.82×108个/mL。但为提高实际可操作性,根据以上响应面优化Y16菌株增殖培养基结果,优化最佳的营养物添加量为葡萄糖11.0 g/L、牛肉膏2.3 g/L、KH2PO40.8 g/L,得到细胞浓度为8.8×108个/mL。在此添加量培养基的条件下,重复实验3 次,得到细胞浓度为8.75×108个/mL,与理论预测值相比,其相对误差为0.57%。说明该模型设计准确可靠,得到的最佳添加量可行,在实际操作中具有指导意义。
2.4 Y16菌株在优化增殖培养基中产香能力的GC-MS检测结果
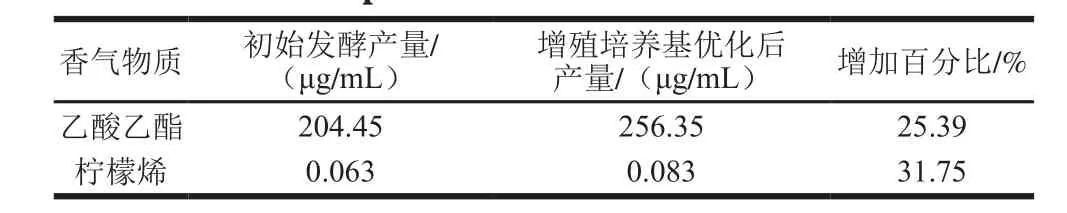
表5 增殖培养基优化前后乙酸乙酯与柠檬烯产量的变化Table 5 Comparative production of ethyl acetate and limonene in optimized and initial medium
由表5可知,对Y16菌株进行增殖培养基优化培养后,乙酸乙酯的产量同比发酵初始培养基增加了25.39%,柠檬烯增加了31.75%,增香效果显著。
3 讨论与结论
传统发酵食品独特风味形成都与产香功能菌的代谢产物密切相关[27]。如Jung等[28]研究泡菜发酵过程中发现Leuconostoc mesenteroides是主要功能乳酸菌,将其应用于发酵可以很好地改善产品的风味。Jansen等[29]发现鲁氏酵母(Zygosaccharomyces rouxii)在酱油发酵前期生长繁殖,其发酵葡萄糖、麦芽糖等成分生成乙醇、甘油、琥珀酸及其他微量成分,并与嗜盐片球菌联合作用生成糠醇,使酱油具有特殊的香气。Viana等[30]研究非酿酒酵母在酿造过程中能够产生特殊的酯香味物质或产生不同的高级醇,形成黄酒的特殊风味。可见功能菌筛选对研究食品风味具有重要意义,而目前针对浆水中具有产香功能菌的菌株研究甚少。
酵母菌活动生成乙醇,经酯化反应生成酯类、醇类、醛类等芳香物质,这些物质构成发酵食品的特征风味成分[31]。Ciani等[32]研究酿酒酵母在15 ℃采用顺序发酵的方法获得乙酸乙酯的高产量,乙酸乙酯是由酵母菌代谢产生,本研究也得到相似的结果,异常汉逊酵母能够产生高产量的乙酸乙酯。
本研究以甘肃传统酿制的浆水为材料,采用经典平板分离法分离出了16 株酵母菌菌株,筛选出一株产香性能优良的酵母菌菌株,经鉴定为异常汉逊酵母。优化得到该菌株的增殖培养基配方为:10 °Be′麦芽汁,其中最佳的营养物添加量分别为葡萄糖11.0 g/L、牛肉膏2.3 g/L、KH2PO40.8 g/L,细胞浓度可达到8.75×108个/mL,是初始麦芽汁发酵培养基细胞浓度的4 倍多。同时该菌株可以生成乙酸乙酯和柠檬烯这两种浆水传统酿制中的特征风味物质,其中,乙酸乙酯的产量达到256.35 μg/mL,比初始发酵培养基增加了25.39%;柠檬烯的产量达到0.083 μg/mL,比优化前增加了31.75%,增香效果明显。所以对该菌株的开发利用是非常必要的,可为浆水发酵直投式增香菌剂的开发提供菌株来源和技术参考。
[1] 张培. 浆水制备工艺和营养成分分析方法的研究[D]. 兰州: 兰州大学, 2014.
[2] 李良凤. 浆水中益生菌群的研究及浆水发酵工艺的研究[D]. 西安:陕西科技大学, 2013.
[3] 何玲. 浆水芹菜营养功能成分与亚硝酸盐变化规律及加工机理研究[D]. 杨凌: 西北农林科技大学, 2007.
[4] 张丽珂, 周鸽鸽, 孟宪刚. 传统发酵食品浆水中厌氧微生物分离鉴定初探[J]. 食品科技, 2010, 35(4): 39-41. DOI:10.13684/j.cnki.spkj.2010.04.049.
[5] 李雪萍, 李建宏, 孟宪刚, 等. 浆水中微生物的分离与鉴定[J]. 食品科学, 2014, 35(23): 204-209. DOI:10.7506/spkx1002-6630-201423040.
[6] 张轶, 王玉丽, 陈晓前, 等. 传统发酵食品: 浆水中微生物的分离与初步鉴定[J]. 食品科学, 2007, 28(1): 219-222. DOI:10.3321/j.issn:1002-6630.2007.01.052.
[7] 杨洋, 高航. 国内直投式乳酸菌发酵剂研究进展[J]. 中国奶牛,2016(6): 44-47. DOI:10.19305/j.cnki.11-3009/s.2016.06.009.
[8] 吕嘉枥, 李良凤. 传统浆水菜发酵工艺条件的研究[J]. 陕西科技大学学报(自然科学版), 2013, 31(3): 89-92. DOI:10.3969/j.issn.1000-5811.2013.03.021.
[9] 侯智勇, 杨静. 川北地区浆水菜发酵工艺优化研究[J]. 中国调味品,2016, 41(5): 68-71. DOI:10.3969/j.issn.1000-9973.2016.05.015.
[10] 贾亚莉, 贠建民, 艾对元, 等. 甘肃浆水传统发酵过程中亚硝酸盐含量动态变化分析[J]. 生物技术进展, 2016, 6(1): 59-66. DOI:10.3969/j.issn.2095-2341.2016.01.12.
[11] 李宏珍, 贠建民, 贾亚莉, 等. 浆水传统酿制过程中挥发性物质的动态变化[J]. 食品与机械, 2016, 32(6): 29-33. DOI:10.13652/j.issn.1003-5788.2016.06.007.
[12] 陆振群. 酒曲中生香酵母的分离及生理生化鉴定[J]. 酿酒科技,2012(3): 37-39. DOI:10.13746/j.njkj.2012.03.017.
[13] 刘绍. 食品分析与检验[M]. 武汉: 华中科技大学出版社, 2011.
[14] 李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J]. 食品工业科技, 2013, 34(18): 75-77. DOI:10.13386/j.issn1002-0306.2013.18.043.
[15] 陈俭梅. 高产谷胱甘肽酵母菌株选育及培养条件研究[D]. 济南: 山东师范大学, 2009.
[16] 孙培培, 黄明泉, 孙宝国, 等. 同时蒸馏萃取-气质联机分析燕麦片挥发性成分的研究[J]. 食品工业科技, 2011, 32(12): 479-483.DOI:10.13386/j.issn1002-0306.2011.12.046.
[17] 巴尼特 J A, 佩恩 R W, 亚罗 D. 酵母菌的特征与鉴定手册[M]. 胡瑞卿, 译. 青岛: 青岛海洋大学出版社, 1991: 18-31.
[18] SUN Y, GUO J J, LIU F B, et al. Identification of indigenous yeast flora isolated from the five winegrape varieties harvested in Xiangning, China[J]. Antonie van Leeuwenhoek, 2014, 105: 533-540.DOI:10.1007/s10482-013-0105-0.
[19] 张祥强. 血球计数板法测定酵母数及出芽率时应注意的问题[J]. 啤酒科技, 2007(7): 30; 33. DOI:10.3969/j.issn.1008-4819.2007.07.015.
[20] 熊海燕, 李莹. 不同果汁发酵液中酵母菌生长曲线的测定及pH值的变化[J]. 农产品加工: 学刊, 2009(4): 26-27. DOI:10.3969/j.issn.1671-9646-B.2009.04.007.
[21] 南博. 活性酿酒酵母的真空干燥技术研究[D]. 杨凌: 西北农林科技大学, 2014.
[22] ZHAO Z Y, MA S S, LI A, et al. Effects of trophic modes, carbon sources, and salinity on the cell growth and lipid accumulation of tropic ocean oilgae strain Desmodesmus sp. WC08[J]. Applied Biochemistry and Biotechnology, 2016, 180(3): 452-463. DOI:10.1007/s12010-016-2109-5.
[23] MAHMOUD S S, CROTEAU R B. Strategies for transgenic manipulation of monoterpene biosynthesis in plants[J]. Trends in Plant Science, 2002, 7(8): 366-373. DOI:10.1016/S1360-1385(02)02303-8.
[24] 吕磊. 芝麻香型白酒关键微生物产香分析研究[D]. 济南: 齐鲁工业大学, 2014.
[25] BI F, MENT D, LURIA N, et al. Mutation of AREA aあects growth,sporulation, nitrogen regulation, and pathogenicity in Colletotrichum gloeosporioides[J]. Fungal Genetics and Biology, 2017, 99: 29.DOI:10.1016/j.fgb.2016.12.006.
[26] 李锐利. 高产乙酸乙酯酵母的选育及在清香型小曲酒中的应用研究[D]. 武汉: 湖北工业大学, 2011.
[27] 范琳琳, 陈启和. 传统发酵食品中的微生物及其代谢作用[J]. 食品安全质量检测学报, 2014, 5(4): 995-1001.
[28] JUNG J Y, LEE S H, LEE H J, et al. Eあects of Leuconostoc mesenteroides,starter cultures on microbial communities and metabolites during kimchi fermentation[J]. International Journal of Food Microbiology, 2012, 153(3):378-387. DOI:10.1016/j.ijfoodmicro.2011.11.030.
[29] JANSEN M, VEURINK J H, EUVERINK G J, et al. Growth of the salt-tolerant yeast Zygosaccharomyces rouxii, in microtiter plates:effects of NaCl, pH and temperature on growth and fusel alcohol production from branched-chain amino acids[J]. Fems Yeast Research,2003, 3(3): 313-318. DOI:10.1016/S1567-1356(02)00162-9.
[30] VIANA F, GIL J V, GENOVÉS S, et al. Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits[J]. Food Microbiology, 2008, 25(6): 778-785.DOI:10.1016/j.fm.2008.04.015.
[31] 陈妍, 陆利霞, 熊晓辉. 微生物发酵法生产食品风味物质[J]. 中国调味品, 2011, 36(7): 13-17. DOI:10.3969/j.issn.1000-9973.2011.07.004.
[32] CIANI M, BECO L, COMITINI F. Fermentation behaviour and metabolic interactions of multistarter wine yeast fermentations[J].International Journal of Food Microbiology, 2006, 108(2): 239-245.DOI:10.1016/j.ijfoodmicro.2005.11.012.
