医用Zn-1.5Mg合金的组织与性能研究
2018-03-20刘小洁祖国胤王明好东北大学材料科学与工程学院沈阳110819
刘小洁,祖国胤,王明好,刘 莹(东北大学 材料科学与工程学院,沈阳 110819)
镁合金由于在力学性能上接近人体骨骼,且有良好的生物相容性,具有作为生物材料的突出优势,因此在整形外科及心血管支架的应用上被寄予厚望.但镁合金因降解速率过快,导致不能在人体组织恢复前给予有效的支持[1].铁合金力学性能良好,且降解过程中不会产生氢气,也被认为是一种有潜力的生物医用合金.然而铁合金因降解速率过慢,其临床应用受到很大限制[2].
锌的标准电极电位(-0.763 V(vs SHE))介于镁(-2.363 V(vs SHE))和铁(-0.440 V(vs SHE))之间,可以避免腐蚀速率过快或过慢的问题.Zn合金还具有阻尼性能优良、耐腐蚀性良好以及易成形等优点,是当前生物医用材料的主要发展方向之一[3-4].锌是人体必需的一种微量元素,几乎参与人机体内的所有生理代谢过程,除了在多种金属酶、转录因子及其他蛋白中起着催化或构建作用外,还以神经递质发挥其功能[5].但纯锌的强度较低、延伸率较差,变形处理后合金在室温下发生回复和再结晶,不能作为承力材料使用[6-7].通过添加合金元素和变形处理来细化晶粒是提高Zn合金力学性能的主要强化方式.迄今为止,对生物医用可降解锌合金的研究尚处于探索阶段.国内外已开发的合金体系包括Zn-Mg等二元合金以及Zn-4Al-1Cu等三元合金.
如前所述,镁的密度较小,并且弹性模量接近于人骨,镁元素植于人体也具有良好的细胞相容性和血液相容性.镁元素降解之后可以被人体吸收,对人体没有伤害.锌基体中加入适量的镁元素,会形成金属间化合物,对提高合金抗拉强度有一定帮助,但同时会损伤合金的韧性.加入少量镁元素,可以提高锌合金的耐磨性;但加入镁元素过多,则会增加合金的热裂倾向.锌合金中含镁量的多少也会影响到其耐腐蚀性.当镁的质量分数大于1%时,表面生成的腐蚀产物可有效提高合金的耐蚀性,镁含量(质量分数)达到4%时,耐蚀性最佳,但此时铸造过程中浮渣生成量也会显著增多.已有的研究显示,镁质量分数为2.5%~3.5%的Zn-Mg合金耐蚀性较为理想[14],但本课题组经过系统实验发现,随着Mg含量的增加,合金的轧制性能迅速变差,极易产生边裂等缺陷.为了开发兼具良好力学性能、耐蚀性能及成形性能的Zn-Mg合金,本文在参考文献[11]的基础上,研究了添加w[Mg]=1.5%的Zn-Mg合金铸造态、均匀化处理后及轧制变形后的微观组织结构演化,测试了轧制变形后合金的腐蚀性能.
1 实验材料和方法
本实验采用纯度为99.99%的Zn锭、纯度为99.99%的Mg锭为原料,制备名义合金成分为Zn-1.5Mg 的二元锌基合金.在高纯石墨坩埚内装入高纯锌锭,放入中频电磁感应真空炉中升温到450 ℃待锌锭完全熔化,继续升高炉温至500 ℃ 并保温10 min.随后用石墨钟罩向合金熔体中压入预热的高纯镁.当金属完全呈熔融态时,将炉温调低50 ℃,向合金熔体中加入除气剂C2Cl6后用石墨棒搅拌,排除熔融金属内部的气体.最后在450 ℃静置20 min,去除氧化物浮层,浇铸至水冷铜模内得到光亮的Zn-1.5Mg合金铸锭.
采用Plasma 400型等离子体发射光谱仪测试铸造合金的实际成分,结果显示Zn的质量分数为98.54%,Mg的质量分数为1.46%.铸造态合金试样经过300 ℃×10 h均匀化处理后,用电火花线切割机切割成100 mm×30 mm×4 mm的试样,经酒精超声清洗20 min,除去表面油脂.合金的轧制温度为200 ℃,道次压下量为10%~15%,总压下量为73%.
使用MPDDY2094型X射线衍射仪对合金样品作物相分析,采用附带能谱仪的ULTRA PLUS型场发射扫描电镜观察合金的微观组织特征.选取轧制变形量为73%的Zn-1.5Mg合金进行拉伸试验.根据GB/T 228—2002制备拉伸试样,试样表面涂抹粒度1.5的金刚石抛光膏抛光后,采用CMT 5105-SANS型电子万能试验机进行拉伸,拉伸速率为0.5 mm/s,拉伸实验数据取三次拉伸平均值.
通过电化学实验测出样品的阻抗谱及Tafel曲线,根据电化学数据评估样品的腐蚀性能.实验设备为CHI 604D型电化学工作站.本实验采用三电极系统,参比电极选用饱和甘汞电极(RE),选用铂为辅助电极(CE),工作电极为环氧树脂镶嵌的待测合金(WE).试样在模拟体液中浸泡5~10 min后开始测量.Tafel曲线测试所采用的参数如下:扫描速率1 mV/s,扫描范围为±600 mV于开路电压.EIS阻抗谱的扫描频率为0.01~10 000 Hz,外加电压为0.005 V.用电火花线切割机分别将厚度为2.04 mm、1.09 mm的轧后样品切割成10 mm×10 mm的试样.环氧树脂镶嵌后的试样表面经400#、1200#、2000#、3000#砂纸打磨并精抛后进行电化学测试.每组实验测试三个平行试样.
实验通过样品失重评价轧态样品在模拟体液(SBF)中的腐蚀性能.将轧制变形量分别为49%和73%的Zn-1.5Mg合金轧制样品依次用 400#、1 200#、2 000#、3 000#砂纸打磨光滑,每组实验三个平行试样,实验数据取平均值.将试样在SBF中分别浸泡1、 2、 4、 8、 14、 22和32d.电解质溶液选择pH为7.4的Hank’s液.溶液体积为20 ml/cm2,具体配制过程执行ISO/FDIS23317:In vitro evaluation for apatite-forming ability of implant materials的规定.
2 结果与讨论
2.1 铸态组织
图1为Zn-Mg二元合金相图,图2显示的是Zn-1.5Mg合金铸态和均匀化后的XRD分析结果.图3为铸态Zn-1.5Mg合金的扫描照片.结合合金相图及XRD测试结果分析可知,铸态Zn-1.5Mg合金中存在η-Zn、Mg2Zn11及MgZn2三种相.

图1 Zn-Mg二元合金相图Fig.1 Phase diagram of Zn-Mg alloy

图2 Zn-1.5Mg合金铸态和均匀化后的XRD分析结果Fig.2 XRD analysis results of Zn-1.5Mg alloy as cast and after homogenization treatment
图2显示经过均匀化处理后,合金中未检测到MgZn2相存在,均匀化后合金组织主要由η-Zn和Mg2Zn11相组成.Zn-1.5Mg合金在铸造过程中,由于水冷铜模冷却速度较快,使得Zn-1.5Mg合金在较大的过冷度下发生非平衡凝固,导致Zn-1.5Mg合金在凝固过程中产生晶内成分偏析.先结晶凝固的部分含高熔点的组分多,后结晶的部分含低熔点的组分多,导致晶粒内部成分不均匀,铸态组织中析出MgZn2相.经过均匀化处理后,合金中的MgZn2相固溶到了Zn基体内部,使非平衡相MgZn2消失.由于Mg2Zn11相的分解温度较高,未能固溶到Zn基体内部.
图3(a)中A区域的灰色枝晶为初生的η-Zn相;图3(b)中B区域内黑灰相间的片层状组织为Mg2Zn11+η-Zn共晶组织,其中,灰色为η-Zn相,黑色为Mg2Zn11相.合金在凝固过程中,由于水冷铜模冷却速度较快,使合金在较大的过冷条件下凝固.溶质元素Mg不能够充分扩散,造成晶粒内部成分偏析,形成枝晶组织,晶粒内部元素分布不均匀,形成非平衡相MgZn2.

图3 铸态Zn-1.5Mg合金的SEM形貌Fig.3 SEM images of as casting Zn-1.5Mg alloy
图4(a)为均匀化处理后Zn-1.5Mg合金的SEM形貌,图4(b)为图4(a)中方形区域局部放大图.对比图3铸态和图4均匀化热处理后Zn-1.5Mg合金的显微组织观察结果可以看出,均匀化后共晶组织的片层状形态消失,铸态下存在的非平衡相MgZn2经过均匀化后溶解到基体中.平衡凝固条件下,温度不断下降,首先从液相中析出初生η-Zn相,当温度降至共晶点时,发生共晶反应L→Mg2Zn11+η-Zn.但是合金溶液浇注后由于冷却速度非常快,在特定的温度区间下没有足够的扩散时间,产生了晶内偏析现象,析出了少量非平衡相MgZn2,故铸态下合金的室温相组成为η-Zn相、Mg2Zn11相以及MgZn2相.均匀化处理后,共晶片层组织特征消失,晶内组织变得均匀,枝晶间的非平衡凝固相固溶到了基体中,Mg2Zn相消失,均匀化后合金的相组成为η-Zn和Mg2Zn11相.

图4 均匀化处理后Zn-1.5Mg合金的SEM形貌Fig.4 SEM images of Zn-1.5Mg alloy after homogenization treatment
图5显示的是经过均匀化处理后的Zn-1.5Mg合金分别经49%和73%的轧制变形后的显微组织.由图5(b)可以看出,经过总压下量73%的轧制变形后,枝晶几乎全部破碎成颗粒状,呈无序状态分布在合金内部.随着轧制道次的增加,条状相以及圆形大颗粒逐渐碎裂,散乱无序的分布在基体内.出现这一现象的原因是由于条状相以及圆形大颗粒硬度大,且塑性较差,轧制过程中这些区域容易产生应力集中,导致晶粒破碎而实现细化.均匀化处理后的Zn-1.5Mg合金经过五道次总压下量73%的轧制变形后,枝晶显著细化,呈现不规则的颗粒状且散乱无序地分布在基体内.

图5 经不同变形量轧制后Zn-1.5Mg合金的显微组织Fig.5 SEM morphologies of rolled Zn-1.5Mg alloy at different rolling deformation rates(a)—轧制变形量49%; (b)—轧制变形量73%
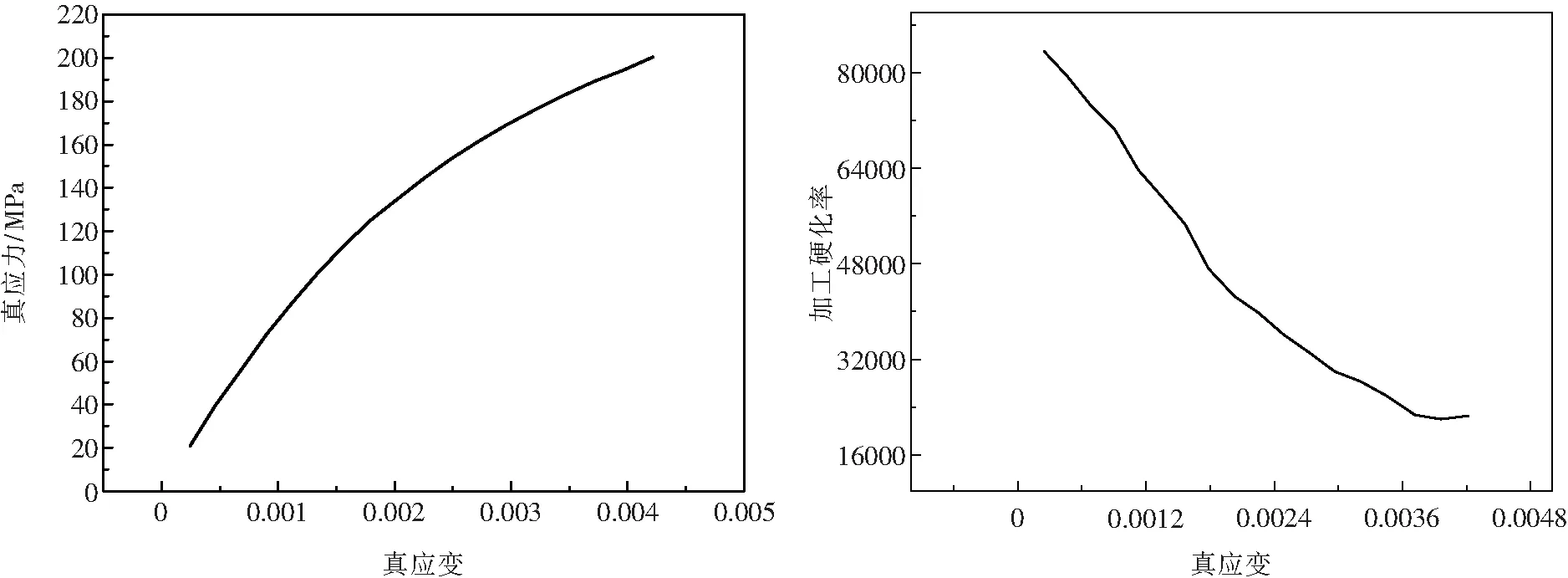
图6 轧制后Zn-1.5Mg真应力-真应变曲线和加工硬化率-真应变曲线Fig.6 True stress - true strain curve and strain hardening rate-true strain curve of rolled Zn-1.5Mg alloy
2.2 轧制试样的力学性能
图6为轧制变形量为73%的Zn-1.5Mg合金的真应力-真应变曲线及加工硬化率-真应变曲线.由图可见,变形量为73%的Zn-1.5Mg合金的屈服强度和抗拉强度分别为190 MPa和204 MPa,断裂延伸率为2.44%.据参考文献[11]报道,铸态纯锌的屈服强度低至12 MPa,抗拉强度仅20 MPa左右,延伸率不足2%;纯Zn中加入质量分数为1%的Mg后,抗拉强度、屈服强度、延伸率分别提高至127 MPa、184 MPa和2.1%.研究表明,人骨抗拉强度为30~280 MPa,延伸率为1%~2%[12].对比分析后可见,本研究开发的Zn-1.5Mg合金拥有更好的塑性,并且抗拉强度也显著提升,符合生物医用合金的相关性能要求.
2.3 轧制试样的腐蚀性能
图7(a)为轧制变形量分别为49%和73%的Zn-1.5Mg合金的腐蚀速率图.从图可知,在浸泡起始阶段,两种不同厚度的轧态样品腐蚀速率较高,且腐蚀速率的变化也较为明显.当浸泡时间超过4天之后,两种厚度的合金的腐蚀速率变化趋缓,腐蚀速度基本保持在0.2 mm/a,即3.8 g/(m2·d-1) 左右.相比于镁合金的腐蚀速率 18 g/(m2·d-1)[10],本研究中的Zn-1.5Mg合金的腐蚀速率要小得多.参考文献[8]指出,骨修复器械通常要求能够维持 3~6个月的服役期,其体外降解速率应小于0.5 mm/a,故实验合金符合该项要求.对比相同浸泡天数的两种厚度的合金腐蚀速率可以发现,轧制变形量为73%的合金腐蚀速率总体低于轧制变形量为49%的合金.这是由于轧制后Zn-1.5Mg合金内的枝晶细化成颗粒状,并且组织更加致密,阻碍了腐蚀的进程,导致腐蚀速率降低.
由外推法分析图7(b)所示的合金极化曲线后可知,轧制变形量为49%的合金样品腐蚀电压为-0.97 V,腐蚀电流为1.07×10-5A/cm2,轧制
变形量为73%的合金样品腐蚀电压为-0.94 V,腐蚀电流为1.98×10-5A/cm2.两种样品的腐蚀电压均大于镁的标准电极电位(-2.34 V(vs SHE)),小于铁的标准电极电位(-0.44 V(vs SHE)).且随着变形率的增加,合金的抗腐蚀性能逐渐增强.研究中发现轧制态Zn-1.5Mg合金腐蚀后表面变黑、变暗.随着浸泡时间的增加,电极表面会吸附腐蚀产物,电极表面的实际面积随之增大,而且试样表面会变粗糙,这种粗糙表面的成因除了腐蚀作用外,还包括杂质、晶界和位错[9].
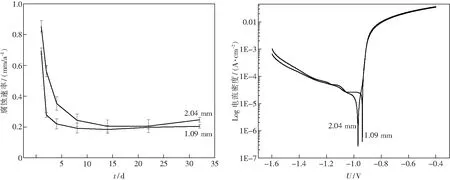
图7 轧制态Zn-1.5Mg合金的腐蚀速率曲线及在pH 7.4模拟体液中的极化曲线Fig.7 Corrosion rates curve and polarization curve at SBF of rolled Zn-1.5Mg alloy(a)—腐蚀速率曲线; (b)—极化曲线
3 结 论
(1)铸态Zn-1.5Mg合金中存在η-Zn、Mg2Zn11及MgZn2三种相.均匀化后合金内共晶组织的片层状形态和MgZn2消失.
(2)均匀化后的Zn-1.5Mg合金在变形量为73%轧制变形后,屈服强度和抗拉强度分别为190 MPa和204 MPa,断裂延伸率为2.44%.
(3)Zn-1.5Mg合金在pH值为7.4的SBF溶液中浸泡超过4天后,其腐蚀速度基本保持在0.2 mm/a左右.腐蚀电压在-0.9 V左右,具有良好的耐腐蚀性,符合对生物医用材料的耐蚀性要求.
[1] Zheng Y F, Gu X N, Witte F. Biodegradable metals[J]. Materials Science & Engineering R, 2014, 77: 1-34.
[2] 王安东,戴起勋. 生物医用材料316L不锈钢的磨损腐蚀特性研究[J].金属热处理,2005, 30(3): 33-36.
(Wang Andong Dai Qixun,Wear-corrosion behavior of 316L stainless steel for biomedical applications[J].Heat Treatment of Metals, 2005, 30(3): 33-36.)
[3] 姜宇,杨述华. 可降解材料在骨科的应用[J]. 临床骨科杂志,2004, 7(1): 115-118.
(Jiang Yu,Yang Shuhua.The application and research of biodegradable material in orthopedics[J].Journal of Clinical Orthopaedics, 2004, 7(1): 115-118.)
[4] Kubasek J, Vojtech D, Jablonska E,etal. Structure, mechanical characteristics and in vitro degradation, cytotoxicity, genotoxicity and mutagenicity of novel biodegradable Zn-Mg alloys[J]. Materials Science & Engineering C, 2016, 58: 24-35.
[5] Vida T A, Freitas E S, Brito C,etal. Thermal parameters and microstructural development in directionally solidified Zn-Rich Zn-Mg alloys[J]. Metallurgical and Materials Transactions A, 2016, 47A(6): 3052-3064.
[6] Chen Q, Thouas G A. Metallic implant biomaterials [J]. Materials Science & Engineering R, 2015, 87: 1-57.
[7] Purcek G, Saray O, Karaman I,etal. Effect of severe plastic deformation on tensile properties and impact toughness of two-phase Zn-40Al alloy[J]. Materials Science and Engineering: A, 2008, 490(1-2): 403-410.
[8] 何业东. 材料腐蚀与防护概论[M]. 北京: 机械工业出版社, 2005: 78-79.
(He Yedong. Corrosin and protection of materials[M]. Beijing: China Machine Press, 2005: 78-79.)
[9] Devirgiliis C. Zinc fluxes and zinc transporter genes in chronic diseases[J]. Mutation Research Fundamental and Molecular Mechanisms of Mutagenesis, 2007, 622(2): 84-93.
[10] Liu Xiwei, Sun Jianke, Yang Yanhong,etal. In vitro investigation of ultra-pure Zn and its mini-tube as potential bioabsorbable stent material[J]. Materials Letters, 2015, 161: 53-56.
[11] Li HF, Xie XH, Zheng YF,etal. Development of biodegradable Zn-1X binary alloys with nutrient alloying elements Mg, Ca and Sr[J]. Scientific Reports, 2015, 5:10719.
[12] Barsoum M W.Fundamentals of ceramics [M]. New York: Taylor & Francis, 2002.
