硫掺杂偏钛酸粉体的制备
2018-03-20沈阳理工大学材料科学与工程学院沈阳059东北大学冶金学院沈阳068
张 武, 张 力(.沈阳理工大学 材料科学与工程学院,沈阳 059; .东北大学 冶金学院,沈阳 068)
二氧化钛作为一种常见的金属氧化物,在国民经济的许多领域都具有广泛的用途.例如,在颜料制作领域,二氧化钛颜料是当今世界上用量最大、最广的白色颜料,全世界消费的二氧化钛颜料占整个颜料总消费量的50%以上[1-3].在精细化工领域,二氧化钛是制作化妆品的重要原料之一.二氧化钛由于折射率高,是搪瓷釉最好的白色乳浊剂[2-6].钛搪瓷的釉层可为锑搪瓷层厚度的二分之一,且耐候性、光泽和耐酸性均优于锑搪瓷.二氧化钛还可用于制造耐热玻璃、乳白玻璃和微晶玻璃等.作为一种绿色无污染材料,二氧化钛及其改性材料具有良好的光催化性能[7-11],在商业上被广泛用作光触媒降解室内的可挥发性有机污染物;此外,还被用作环境修复剂通过光催化途径降解有机染料废水及光催化制氢等[12-15].
近年来,学者们的研究表明金属/非金属掺杂二氧化钛材料相比传统的二氧化钛材料具有显著提升,诸多研究表明[16-21], 硫掺杂二氧化钛材料相比其他二氧化钛材料具有更强的光催化活性,相比于普通偏钛酸粉体,硫掺杂偏钛酸颗粒是制备高活性硫掺杂二氧化钛材料的重要前驱体.这种硫掺杂偏钛酸粒子的粒度分布决定了最终硫掺杂二氧化钛材料的性能,因而,硫掺杂偏钛酸粉体的制备受到了越来越多的关注.然而,硫掺杂偏钛酸粉体制备过程中颗粒大小及水解率等难以有效控制,其主要原因在于人们对于钛盐水解产生偏钛酸这一过程的基础研究不多,没有完全掌握水解钛盐过程的基本规律.本文以硫酸钛为原料,采用水解法制备硫掺杂偏钛酸粉体,系统研究了偏钛酸水解过程的影响因素,为掌握钛盐水解规律从而提高离子掺杂偏钛酸制备过程的可控性提供了实验基础.
1 实 验
本文采取的实验步骤如下:1)室温下将一定量的硫酸钛及硫化钠溶解于蒸馏水中,得到硫酸钛与硫化钠混合溶液A;2)将溶液A置于水浴锅中,加热到不同温度,水解一定时间后,得到白色浑浊液B;3)将白色浑浊液B冷却至室温,离心;4)经过离心,得到白色沉淀C;5)将白色沉淀C置于恒温鼓风干燥箱中干燥,得到白色粉末; 本实验所采用的实验装置图如图1所示.采用激光粒度仪(型号:Nano 90, 生产商:英国马尔文公司)测定偏钛酸粉体粒度,分散剂为四硼酸钠溶液,质量分数为0.5%.采用场发射扫描电镜(FESEM,型号:ULTRA55, 生产商:德国卡尔蔡司公司)观察颗粒显微形貌,加速电压15 kV.

图1 实验装置图Fig.1 Experimental device diagram1—电动搅拌器; 2—冷凝管; 3—三口烧瓶;4——智控水(油)浴锅
2 结果与讨论
2.1 钛液水解及颗粒长大过程分析
关于钛液的水解方法和水解反应的理论虽然有很多的报道,但是关于钛液水解的机理还尚未有统一的认识.钛液的水解机理非常复杂,目前被大多数研究者认可的一种观点是:钛液的水解过程可以分为H+的转移和胶体的凝聚两个过程.该过程具体描述如下:
钛组分在溶液中是以一种六配位的配合离子[Ti(H2O)6]4+的形式存在,配位的水分子也可以是其他阴离子.水解的第一步是从1个水分子中脱去1个H+,进而形成由5个水分子和1个OH-所组成的配合离子,降低了钛的电荷.该过程的反应式如下[22-26]:
[Ti(H2O)6]4++H2O=[Ti(OH)(H2O)5]3+
+H3O+
(1)
这个含有羟基的水合钛离子[Ti(OH)(H2O)5]3+包含氧氢基,在溶液中以二聚体形式存在,即二核钛离子(八水合二羟基钛配合离子),该过程的反应式如下:
2[Ti(OH)(H2O)5]3+=
[(H2O4)Ti(OH)2Ti(H2O)4]6++2H2O
(2)
当上述二核钛离子溶液长时间放置时,溶液的酸度逐渐升高,这是由于钛的“羟桥”上的H+继续转移而形成更稳定的“氧桥”配合离子.反应式如下[26]:

在氧桥配合物中,水分子上的H+再次发生转移,进一步离解成“羟桥”,继而进一步转移成“氧桥”,就可能结合成四钛配合物,其结构如下:

这种H+的转移随着水解过程的进行继续发展时,变逐步形成多核配合物,其结构如图2所示:

图2 多核配合物结构示意图Fig.2 Schematic diagram of polynuclear complex structure
图2所示的配合物属于大分子,它容易聚集并进一步长大,最终形成胶体粒子,其粒径比传统意义上的颗粒要小.因此,胶体粒子可以视为水合二氧化钛颗粒的一次晶核.系统总界面能的减小是水合二氧化钛颗粒生长的驱动力.小颗粒的比表面积比大颗粒大,具有较强的吸附能力,因而其周围的配合离子浓度明显高于大颗粒周围的配合离子浓度.因此在浓度梯度的作用下,小颗粒和大颗粒之间配合物会发生扩散流动[26].
2.2 Ti(SO4)2浓度对水解率及中间产物粒径的影响
图3为Ti(SO4)2的质量浓度对水解率及中间产物粒径的影响曲线.

图3 Ti(SO4)2的质量浓度对水解率及中间产物粒径的影响示意图Fig.3 Effects of Ti (SO4)2 concentration on the hydrolysis ratio and particle size(a)—平均粒径; (b)—水解率
从图3中可以看出,Ti(SO4)2溶液浓度对中间产物粒径的影响较大,随着溶液浓度的增加,生成中间产物粒径先增加后减小.在一定范围内增加Ti(SO4)2溶液浓度(从55 g/L增加至65 g/L),相当于增加了反应体系中沉淀离子的过饱和度,增强了中间产物成核的推动力,生成的晶核碰撞概率增大,粒子的团聚更加容易,沉淀粒子的粒径增大[26],当溶液浓度继续增加,单位时间内产生的细小晶核数量增加,中间产物可以短时间内在众多晶核的基础上形成细小的中间产物颗粒.张益都[26]在阐述偏钛酸形核的过程中指出,一方面,增加溶液浓度增强了中间产物成核的推动力,生成的晶核碰撞概率增大,会导致颗粒明显变大,但浓度增加同时又会使细小晶核数量增加,使颗粒尺寸变小,当溶液浓度过高时,后一种情况优势更加明显,因而颗粒尺寸会明显变小.Ti(SO4)2浓度对水解率影响较小,这是由于在相同的反应时间内,水解速率主要与反应温度关系密切,与Ti(SO4)2浓度关系较小,因而在同一时间段内,原料的水解率基本一致.综合考虑水解率和中间产物的平均粒径,选择最佳的工艺条件为55 g/L,该条件下水解率为56.3%,中间产物粒径为393.6 nm.
2.3 水解温度对水解率及中间产物粒径的影响
图4为水解温度对水解率及中间产物粒径的影响曲线.
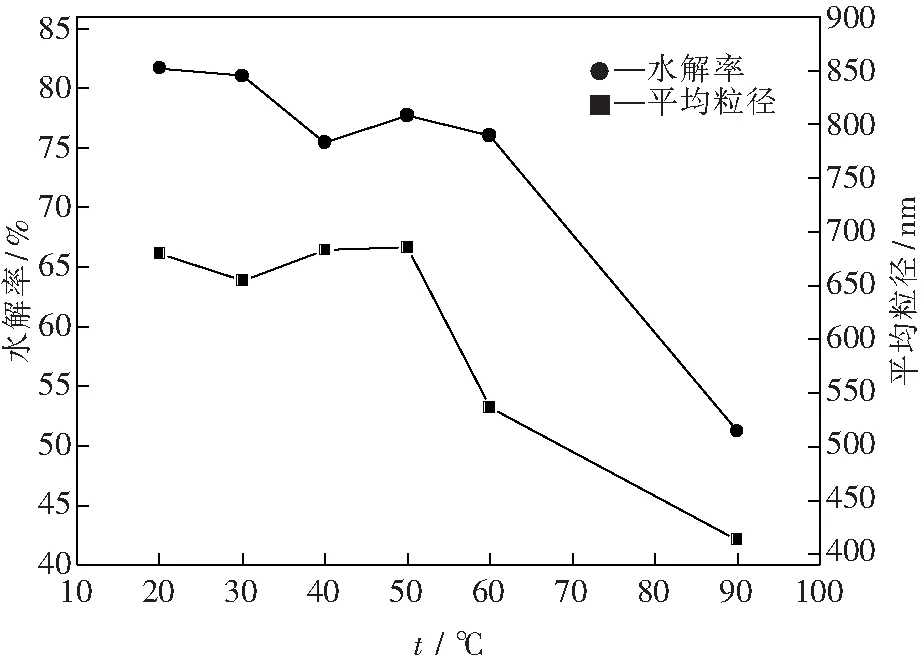
图4 水解温度对水解率及中间产物粒径的影响曲线Fig.4 Effects of hydrolysis temperature on the hydrolysis ratio and the particle size
从图4中可以看出,当水解温度在50 ℃以下时,所获中间产物粒径较大(大于650 nm),温度继续上升,中间产物粒径明显减小,成核速率与温度的关系如式(4)所示[26]:
(4)
式中,IN为成核速率;Ω为常数;σ为液相界面能;k为玻尔兹曼常量;T为体系热力学温度;VS为分子体积;S为过饱和度.
在公式(4)中,除温度外的其他参数,如过饱和度等随温度变化幅度相对较小,因此当温度升高时,成核速率升高,单位时间内产生的晶核明显增多,即体系中在短时间内即可产生较大数量的晶核,中间产物可以短时间内在众多晶核的基础上形成细小的中间产物颗粒.同时,从图4中可以看出,当水解温度在60 ℃以下时,水解率变化不明显(75%~82%),而当水解温度达到 90 ℃ 时,水解率迅速下降至53.6%,这是由于随着水解温度升高,水解反应速率明显变快,溶液体系在短时间内产生大量H+,而水解反应是一个释酸过程,大量的H+会使水解反应向逆方向进行,导致水解产物明显减少,水解率明显下降.因此,综合考虑水解率和中间产物的平均粒径,选择最佳的工艺条件为60 ℃.该条件下水解率为75.99%,中间产物粒径为536.1 nm.
2.4 体系pH对水解率及中间产物粒径的影响
图5是体系pH值对水解率及中间产物粒径的影响曲线.
图5中在不同pH值(3~11)所获得的中间产物粒径并无明显规律,当pH为5时,中间产物的粒径最小,为559.5 nm;当pH为7时,中间产物粒径最大,为679.4 nm.对于在溶液体系中的纳米粒子,颗粒团聚是影响最终颗粒尺寸的重要原因,当pH值不同时,颗粒表面电位明显不同,因而不同pH值条件下颗粒的团聚状况也不相同.从图5中不难看出当pH值为7时颗粒粒径最大,说明此时颗粒团聚度最高.根据蒋裕平[27]的研究结果,在酸性条件下,pH值越小,正电荷数量越多,zeta电位越高,颗粒之间的静电斥力越强,悬浊液越稳定,颗粒团聚程度较弱;在碱性条件下,pH值越大,负电荷数量越多,zeta电位绝对值越高,颗粒之间的静电斥力越强,悬浊液越稳定,颗粒团聚程度较弱.从图5中可以看出,本实验中的等电点在pH=7左右,此时静电斥力较弱,颗粒团聚严重,中间产物的平均粒径偏高.pH=5与pH=9时,理论上其电位应相等,但是由于酸性环境中的H+体积比碱性环境中OH-体积小,使得酸性环境下颗粒表面电荷密度比碱性环境更高,导致酸性条件下的zeta电位大于碱性条件下电位的绝对值.这就造成pH=5时中间产物平均粒径比pH=9的要小.同理,pH=3与pH=11是平均粒径的差异也是如此.而pH值对于水解率的影响,从图5中可以看出当pH<7时,水解率基本不变,而当pH>7时,水解率随pH的增大明显提高,这是由于当pH值较大时溶液中的H+被OH-迅速中和,从而有力地促进水解反应正向进行.因此,综合考虑水解率和中间产物的平均粒径,选择最佳的工艺条件为pH=5.该条件下水解率为81.88%,中间产物粒径为559.5nm.
图6 为硫掺杂偏钛酸粉体的微观显微形貌图(硫酸钛溶液质量浓度为65 g/L、水解温度60 ℃、pH值为7).图中偏钛酸粉体一次颗粒的粒径约为500 nm,颗粒团聚较为明显,这是由于在干燥过程中颗粒表面产生氢键等极性基团使颗粒发生硬团聚的结果.
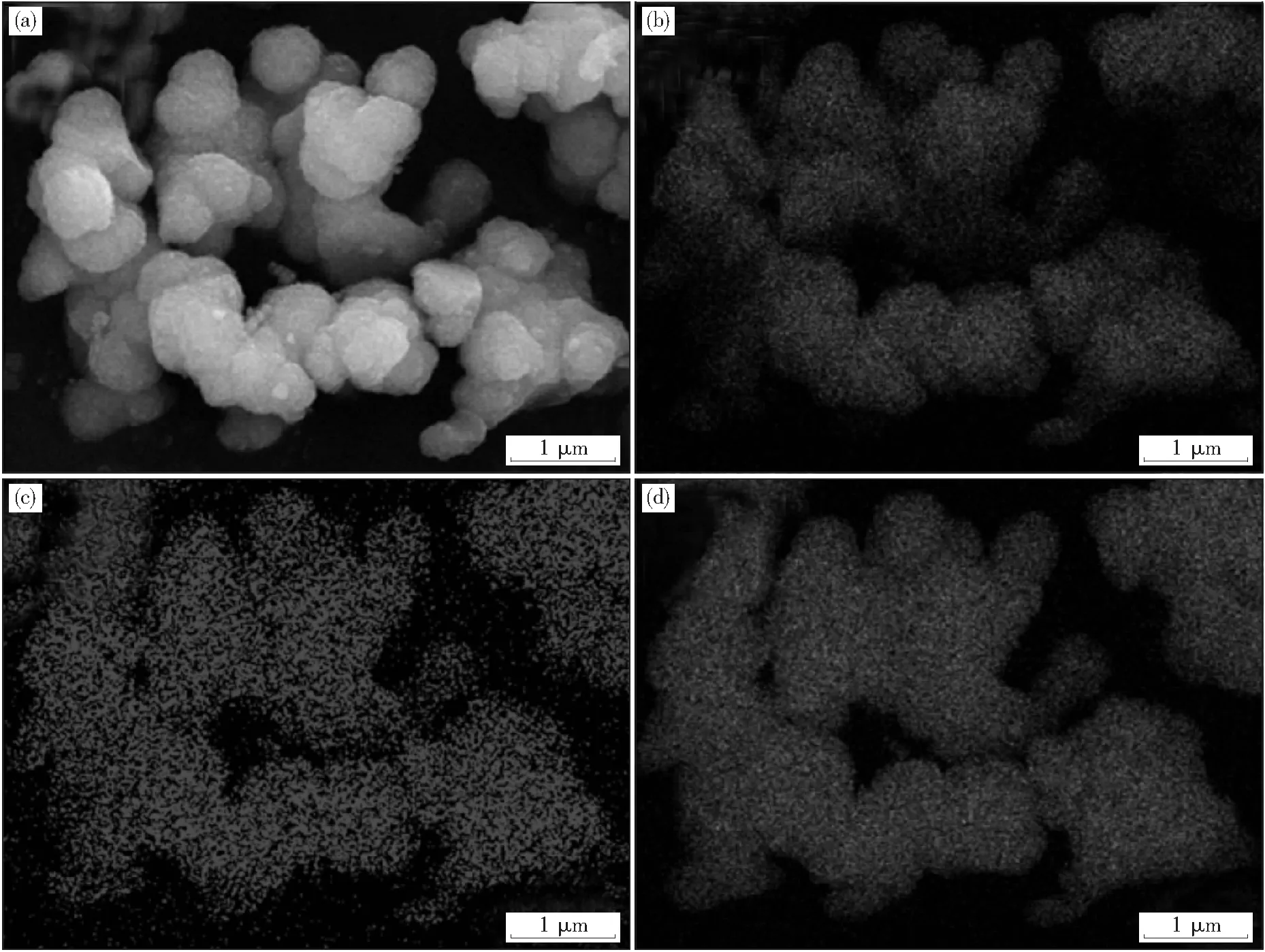
图6 产品显微形貌及其面扫描分析结果 Fig.6 Micro-morphology of the product and surface scanning analysis resutls(a)—显微形貌; (b)—O; (c)—S; (d)—Ti
3 结 论
采用硫酸钛水解法制备了硫掺杂偏钛酸粉体.本文以硫酸钛为原料,采用水解法制备纳米TiO2,制备过程具有低成本,简单易行等优点.采用场发射扫描电镜(FESEM)、激光粒度分析等技术对偏钛酸粉体的形貌及粒度进行了分析.系统研究了硫酸钛溶液浓度、水解温度、pH值对水解率、偏钛酸粉体粒径的影响,研究结果表明:硫酸钛溶液浓度、pH值及水解温度对中间产物粒径及原料水解率具有显著影响,对应于最佳产品的水解工艺条件为:硫酸钛溶液质量浓度为65 g/L、水解温度60 ℃、pH值为7.
[1] 王玲, 王河锦, 李婷. 锐钛矿金红石的高温原位X射线衍射研究[J]. 物理学报, 2013, 62(14): 000353-000361.
(Wang Ling, Wang Hejin, Li Ting. In situ X ray diffraction study of anatase rutile at elevated temperature[J]. Acta Physica Sinica, 2013, 62(14): 000353-000361.)
[2] 郑遗凡, 李国华, 田伟, 等. 纳米锐钛矿相变的原位XRD研究[J]. 无机化学学报, 2007, 23(6): 1121-1125.
(Zheng Yifan, Li Guohua, Tian Wei,etal. In situ XRD study of nano anatase phase transition[J]. Chinese Journal of Inorganic Chemistry, 2007, 23(6): 1121-1125. )
[3] 高濂, 郑珊, 张青红. 纳米氧化钛光催化材料及应用[M]. 北京: 化学工业出版社, 2002.
(Gao Lian, Zheng Shan, Zhang Qinghong. Nano titania photocatalytic material and its application[M]. Beijing: Chemical Industry Press, 2002.)
[4] 袭著革, 李官贤, 张华山, 等. 复合纳米TiO2净化典型室内空气污染物初步研究[J]. 解放军预防医学杂志, 2003, 21(5): 316-318.
(Xi Zhuge, Li Guanxian, Zhang Huashan,etal. Preliminary study on purification of typical indoor air pollutants by composite nano TiO2[J]. Journal of Preventive Medicine of Chinese People's Liberation Army, 2003, 21(5): 316-318.)
[5] 文明, 郑水林, 刘月, 等. 蛋白土/纳米二氧化钛复合材料的制备与应用研究[J]. 非金属矿, 2008, 31(6): 41-42.
(Wen Ming, Zheng Shuilin, Liu Yue,etal. Study on preparation and application of protein soil / nano titania composite[J]. Non Met Mine, 2008,31(6):41-42.)
[6] 顾凯, 周晓燕. 纳米二氧化钛/三聚氰胺树脂混合体系的特性[J]. 南京林业大学学报(自然科学版), 2010, 34(2): 65-68.
(Gu Kai, Zhou Xiaoyan. Characteristics of nano titania / melamine resin mixed system[J]. Journal of Nanjing Forestry University(Natural Science Edition), 2010, 34(2): 65-68.)
[7] 张颖, 王桂茹, 李朝晖, 等. 光催化氧化法处理活性染料水溶液[J]. 精细化工, 2000, 17(2): 79-81.
(Zhang Ying, Wang Guiru, Li Zhaohui,etal. Treatment of reactive dye aqueous solution by photocatalytic oxidation[J]. Fine Chemicals, 2000, 17(2):79-81.)
[8] Matthews R W. Photo oxidation of organic material in aqueous suspensions of titanium dioxide[J]. Water Res, 1990, 24(5): 653. )
[9] Zhang Fushen, Jerome O, Nriagu H. Ideaki itoh[J]. Journal of Photo Chemistry and Photo Biology A: Chemistry, 2004(167): 223-228.)
[10] 赵同建. 纳米TiO2在涂料中的应用研究[J]. 弹性体, 2007, 17(3): 60-63.
(Zhao Tongjian. Study on the application of nano TiO2in coatings[J]. China Elastomerics, 2007, 17(3): 60-63.)
[11] 李振中, 李东红, 温变英. 无机纳米粒子填充改性聚合物的研究进展[J]. 塑料, 2001, 30(1): 44- 49.
(Li Zhenzhong, Li Donghong, Wen Bianying. Research progress of inorganic nanoparticles filled modified polymers[J]. Plastics, 2001, 30(1):44- 49.
[12] 许秀艳, 付国柱, 徐瑞芬. 纳米TiO2在涂料中的应用[J]. 全面腐蚀控制, 2000, 15(2): 8-11.
(Xu Xiuyan, Fu Guozhu, Xu Ruifen. Application of nano TiO2in coatings[J]. Total Corrosion Control, 2000, 15(2): 8-11.
[13] 刘小强, 杜仕国, 闫军, 等. 纳米二氧化钛改性及其在涂料中的应用[J]. 化工时刊, 2004, 18(11): 13-16.
(Liu Xiaoqiang, Du Shiguo, Yan Jun,etal, Modification of nano titanium dioxide and its application in coatings[J]. Chemical Industry Times, 2004, 18(11):13-16.)
[14] 阳露波. 金红石纳米TiO2在涂料中的应用研究[J]. 钢铁钒钛, 2003, 24(2): 52-56.
(Yang Lubo. Study on the application of rutile nano TiO2in coatings[J]. Iron Steel Vanadium Titanium, 2003, 24(2): 52-56.)
[15] 郭刚, 曹建军, 段小平, 等. 金红石型纳米二氧化钛改性聚酯/异氰脲酸三缩水甘油酯粉末涂料研究[J]. 现代化工, 2004, 24(5): 38-40.
(Guo Gang, Cao Jianjun, Duan Xiaoping,etal. Study on modified nano TiO2modified polyester / cyanuric acid three glycidyl ester powder coating[J]. Modern Chemical Industry, 2004, 24(5): 38-40.)
[16] 徐瑞芬, 余广为, 许秀艳. 复合涂料中纳米TiO2降解污染物和抗菌性能研究[J]. 化工进展, 2003, 22(11): 1193-1195.
(Xu Ruifen, Yu Guangwei, Xu Xiuyan. Study on degradation of pollutants and antibacterial properties of nano TiO2in composite coatings[J]. Chemical Industry and Engineering, 2003, 22(11): 1193-1195.)
[17] 许莹. 无机抗菌剂的制备及在建筑用杀菌涂料中的应用[J]. 新型建筑材料, 2003 (2): 47- 49.
(Xu Ying. Preparation of inorganic antibacterial agent and its application in building bactericidal coatings[J]. New Building Materials, 2003 (2): 47- 49.)
[18] Yu Chenlin, Tu-En Chien, Po-Chih Lai. TiS2transformation into S-doped and N-doped TiO2with visible-light catalytic activity[J]. Applied Surface Science, 2014, 359: 1-6.)
[19] Jarmila Puskelova, Robert Michal, Maria Caplovicova. Hydrogen production by photocatalytic ethanol reforming using Eu- and S-doped anatase[J]. Applied Surface Science, 2014, 305:665-669.)
[20] Chen Xiaoyun, Kuo Donghau,Lu Dongfang. Visible light response and superior dispersed S-doped TiO2nanoparticles synthesized via ionic liquid [J]. Advanced Powder Technology, 2017, 28(4):1213-1220.)
[21] 石建稳, 郑经堂.纳米TiO2光催化剂可见光化的研究进展[J]. 化工进展, 2005, 24(8): 841-844.
(Shi Jianwen, Zheng Jingtang. Research progress of visible photochemistry of nanometer TiO2photocatalyst[J]. Chemical Industry and Engineering Progress, 2005, 24(8): 841-844.)
[22] 胡裕龙, 刘宏芳, 郭兴蓬. 氮掺杂二氧化钛光催化剂的研究进展[J]. 硅酸盐学报, 2010, 38(3): 535-541.
(Hu Yulong, Liu Hongfang, Guo Xing peng. Research progress of n-doped titania photocatalyst[J]. Journal of the Chinese Ceramic Society, 2010, 38(3):535-541.)
[23] Sun L, Li J, Wang L C,etal. An electrochemical strategy of doping Fe3+into TiO2nanotube array films for enhancement in photocatalytic activity[J]. Solar Energy Material & Solar Cells, 2009, 93(10): 1875-1879.)
[24] 朱国平, 周康根, 郭朝晖, 等. 氮掺杂二氧化钛粉体(TiO2-xNx)的制备与性能表征[J]. 中国科学B辑化学, 2006, 36(4): 326-330.
(Zhu G P, Zhou K G, Guo Z H,etal. Preparation and characterization of nitrogen doped titania powder[J]. Science in China(Series B), 2006, 36(4): 326-330. )
[25] 崔文权, 冯良荣, 徐成华, 等. 用于甲醇水溶液制氢的光催化剂纳米TiO2的改性进展[J]. 合成化学, 2004, 12(5): 452-456.
(Cui Wenquan, Feng Liangrong, Xu Chenghua,etal. Progress in photocatalytic modification of nanosized TiO2for hydrogen production in methanol aqueous solution[J]. Chinese Journal of Synthetic Chemistry, 2004, 12(5): 452-456. )
[26] 张益都. 硫酸法钛白粉生产技术创新[M]. 北京: 化学工业出版社, 2010: 100-110.
(Zhang Yidu. Technological innovation of titanium dioxide production by sulfuric acid process[M]. Beijing: Chemical Industry Press, 2010: 100-110. )
[27] 蒋裕平. TiO2在不同pH值和高盐度溶液中的吸附和光催化作用研究[D]. 广州: 华南理工大学, 2013: 29-31.
(Jiang Yuping. Study on the adsorption and photocatalytic activity of TiO2in different pH and high salinity solutions[D]. Guangzhou: South China University of Technology, 2013: 29-31.
