Bortezomib对炎症性肠病小鼠模型炎症抑制作用及机制的研究
2018-03-20胡丽红张志荣
胡丽红, 李 晴, 曲 波, 张志荣
1.哈尔滨医科大学附属第二医院消化内科,黑龙江 哈尔滨 150086; 2.哈尔滨医科大学2014级临床医学本科
炎症性肠病(inflammatory bowel disease, IBD)是一种病因和发病机制尚不明确的慢性非特异性肠道炎性病变,发病率在我国呈逐年上升趋势。但由于IBD的病因尚不明确,治疗上也缺乏特异性的药物,世界卫生组织将其列为难治性疾病之一[1-2]。目前的研究表明,在IBD中,活化的核因子-κB(nuclear factor-κB, NF-κB)可调节与IBD发生、发展相关的促炎性细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1(interleukin-1, IL-1)等的产生和释放,加重肠道的炎性反应[3]。由此提示,NF-κB的激活在调节免疫及炎性反应中起着关键作用,抑制NF-κB的活性可以起到治疗IBD的作用。而Bortezomib是进入临床研究的第一个蛋白酶体抑制剂,可有效抑制NF-κB活性,已被批准用于治疗多发性骨髓瘤[4]。本研究旨在以葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的IBD小鼠作为模型,评价Bortezomib是否可通过NF-κB的抑制作用达到治疗IBD的目的。
1 材料与方法
1.1动物选取8周龄健康雄性Balb/c小鼠,体质量20~25 g,共160只,由哈尔滨医科大学附属第二医院动物实验中心提供。小鼠常规饲养,保证环境清洁,通风良好,湿温度适宜(温度24~25 ℃,湿度70%~75%,照明方案12 L/12 D)。此方案经哈尔滨医科大学动物保护与应用委员会批准。在进行实验之前,将动物于实验室条件下饲养7 d。
1.2主要试剂Bortezomib由Ben Venue Laboratories Inc(Bedford,USA)提供。DSS(M.W.=36000-50000,上海翊圣生物科技有限公司);ELISA试剂盒(北京义翘神州生物科技有限公司);胞浆-核蛋白抽提试剂盒(PIERCE Biotech, USA) Cat:78833;BCA蛋白浓度测定试剂盒:Pierce公司 Cat:23227;非放射EMSA Kit:PIERCE公司 Cat:89880;成像系统:阿尔法公司flurechemical(made in USA)。
1.3造模与治疗160只小鼠随机分为5组:正常对照组,模型组和Bortezomib高、中、低剂量组(32只/组)。各组间质量差异无统计学意义(P>0.05)。正常对照组小鼠正常饮用水饲养。其余4组小鼠给予质量浓度为30 g/L的 DSS 溶液,连续饲养7 d[5]。Bortezomib低剂量治疗组(从腹腔入0.2 mg/kg Bortezomib);Bortezomib中剂量治疗组(从腹腔入0.6 mg/kg Bortezomib);Bortezomib高剂量治疗组(从腹腔入1.0 mg/kg Bortezomib);模型对照组(从腹腔入PBS);正常对照组(从腹腔入PBS)。分别于药物治疗前及用药后第1、3、7天4个时间点,从每组中随机抽取8只小鼠检测相关指标。
1.4疾病活动指数(diseaseactivityindex,DAI)评价Bortezomib对DSS诱导的IBD的治疗效果使用DAI评价IBD的临床活动。DAI指数由三部分组成:体质量下降、大便性状和血便情况。体质量减轻分数如下测定:0分:无体质量下降;1分:1%~5%体质量下降;2分:6%~10%体质量下降;3分:11%~15%体质量下降;4分:> 15%体质量下降。粪便性状评分如下:0分:正常大便;2分:大便松散;4分:腹泻。便血情况评分如下:0分:无便血;2分:潜血;4分:肉眼血便。三个类别分数相加取总分。
1.5组织病理学评价炎症程度在给药治疗前及给药后分别于第1、3和7天对小鼠实施安乐死。 在实验结束后,收集结肠组织,清洗,质量浓度为30 g/L的甲醛固定,石蜡包埋、切片,切片厚度为5 μm,并进行苏木精-伊红(HE)染色,用于光学显微镜(Olympus BX51 microscopy, Olympus, Japan)观察,最后由对实验方案不知情的病理学家进行观察和分级。收集剩余的结肠组织并冷冻在液氮中。组织染色分级标准见表1。

表1 组织染色分级标准Tab 1 Grading criteria for histological staining
1.6ELISA法检测Bortezomib治疗对TNF-α血清水平的影响实验动物处死前通过心脏穿刺收集血液,将血液静置后离心(3 500 r/min) 15 min, 按ELISA试剂盒操作步骤测定TNF-α(ng/L)的水平。
1.7电泳迁移率改变分析(electrophoreticmobilityshiftassay,EMSA)法检测Bortezomib治疗对NF-κB活性的影响按核蛋白抽提试剂盒操作说明提取核蛋白;然后BCA法进行蛋白浓度测定;进行EMSA,其具体步骤为:配制质量浓度为65 g/L的聚丙烯酞胺凝胶;制备预冷的0.25×TBE,4 ℃保存;预电泳:用预冷的0.25×TBE在冰上120 V预电泳1 h,并在上样前用电泳缓冲液冲洗加样孔3~5次/孔;然后将细胞核提取物与NF-κB寡核苷酸探针进行结合反应,反应体系按总体积15 μl上样,并设置阴性对照组(标记探针)、常规反应组(含激活的NF-κB核蛋白+标记探针)、探针冷竞争反应组(含激活的NF-κB核蛋白+标记探针+标记探针100倍量的未标记探针);制备上样混合液:电泳:将全部样品(18 μl)加于样品孔中,低温下180 V,电泳60 min。电泳后取出凝胶板,用电泳转膜装置将凝胶上的蛋白转至结合膜,交联、洗涤、底物结合反应、Cool Imager成像系统成像。

2 结果
2.1DAI评价Bortezomib对DSS诱导的IBD的治疗效果造模过程中无小鼠死亡,小鼠于造模开始第3天逐渐出现精神萎靡、毛发直立、肉眼血便,第5天出现血便,第7天均出现肉眼血便或便潜血阳性,严重者在出现肉眼纯稀血便的同时肛周黏附少量血液。造模7 d后小鼠体质量下降明显,降幅均超过原体质量的15%(见图1A、1B)。所有DSS处理组的DAI评分均明显增加,而在整个给药期间正常对照组DAI始终为0,造模组小鼠一般状态DAI评分(11.250±0.463)较正常对照组高,差异有统计学意义(P<0.05)。
给予Bortezomib药物治疗后,与PBS治疗的模型组相比,Bortezomib低剂量治疗组治疗1 d DAI评分无显著降低。中剂量和高剂量Bortezomib组的DAI评分均显著降低(P<0.05)。Bortezomib不同剂量及时间处理后多因素方差分析结果显示,时间、剂量及时间和计量的交互作用对DAI影响,差异均有统计学意义(P<0.001)。总体趋势:随着药物浓度的增加及时间的延长,小鼠一般状态逐渐好转,DAI评分逐渐降低。应用高剂量Bortezomib治疗7 d后,IBD的症状显著改善,平均DAI评分仅为1.83分(见图1C)。
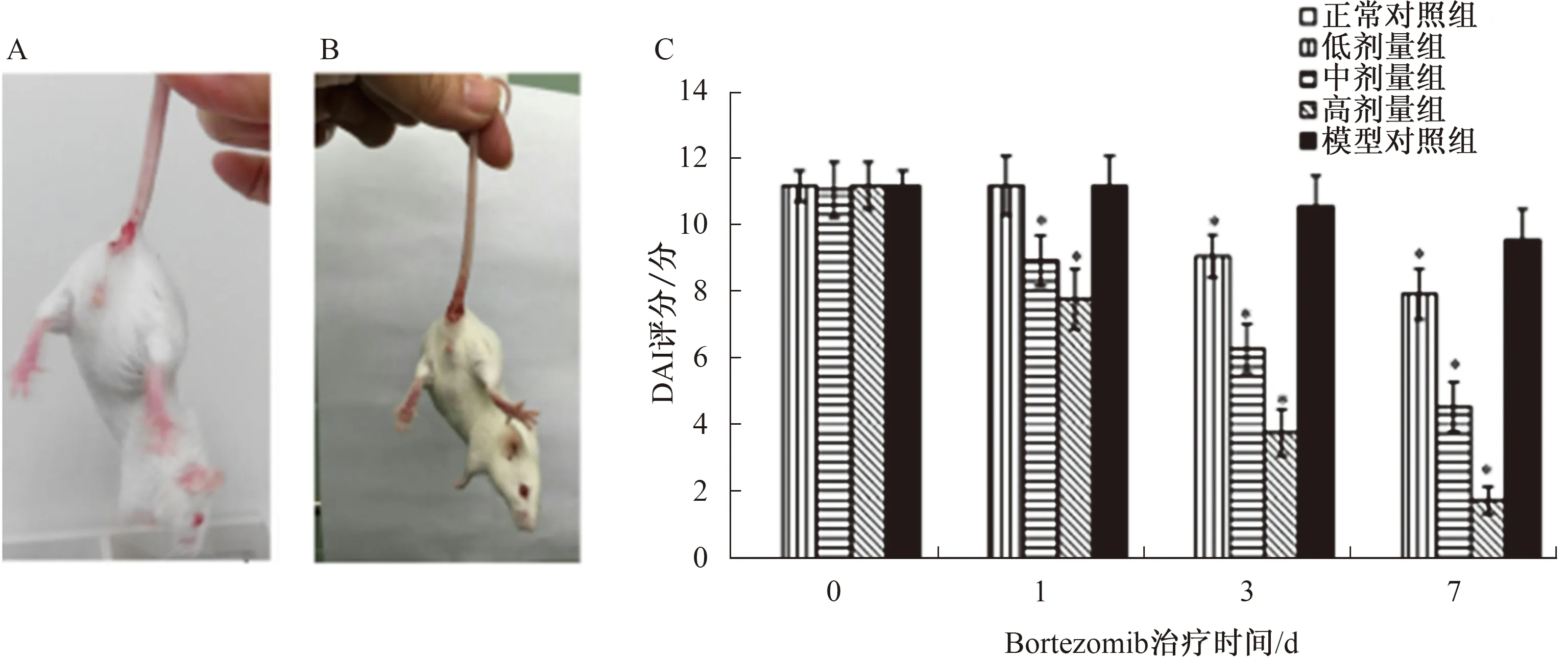
注:与模型对照组比较,*P<0.05。图1 小鼠便血情况及DAI值比较 A:DSS诱导5 d IBD小鼠模型;B:DSS诱导7 d IBD小鼠模型;C:给药期间小鼠体质量下降、大便性状和血便情况DAI评分Fig 1 Comparison of bloody situation in mice and DAI value A: DSS-induced IBD in mice model for 5 days; B: DSS-induced IBD in mice medel for 7 days; C: DAI score for body weight change, rectal bleeding and stool consistency during administration
2.2组织病理学评价炎症程度在正常对照组中,组织学染色显示结构正常,没有异常的组织变化和损伤(见图2A)。在DSS处理造模后,可以观察到黏膜损伤,结构破坏,明显的上皮细胞崩解,炎性细胞浸润,水肿和隐窝脓肿形成(见图2B)。应用中剂量和高剂量Bortezomib治疗3 d和7 d后,炎症和隐窝损伤显著改善,组织学评分也显著降低(见图2C和2D)。此外,低剂量Bortezomib治疗未能诱导组织学评分显著降低。高剂量和中等剂量的Bortezomib治疗能够达到DSS诱导的IBD组织病理学缓解。
2.3Bortezomib治疗对TNF-α血清水平的影响与正常对照组小鼠相比,模型组小鼠TNF-α水平显著上调。随着Bortezomib治疗时间和剂量的增加,TNF-α的表达显著下调(见图3)。不同剂量及时间处理后多因素方差分析结果显示,时间、剂量及时间和计量的交互作用对TNF-α影响,差异均有统计学意义(P<0.001)。
2.4EMSA法检测Bortezomib治疗对NF-κB活性的影响结肠组织核蛋白提取物显示,与正常对照组相比,应用DSS处理后的小鼠NF-κB p65蛋白活性显著上调(见图4)。然而,应用Bortezomib治疗后由DSS诱导引起的结肠黏膜中NF-κB p65活性升高则显著下调,并呈时间和剂量依赖性。
3 讨论
NF-κB是一种具有多向转录调节作用的蛋白质, 广泛存在于真核细胞中,参与许多疾病的发病机制。NF-κB家族5位成员包括:NF-κB1(P50)、NF-κB2(P52、P49、P50B)、RelA(P65)、RelB、 c-rel。正常状态下,NF-κB家族成员通常以二聚体形式与其抑制蛋白IκB形成复合物,以非活性形式存在于细胞质中。只有在受到各种活化因素的作用,IκB蛋白激酶IKK活化,IκB被磷酸化并通过26S蛋白酶体顺序降解,与NF-κB解离,NF-κB活化进入细胞核内,其DNA结合位点暴露,与DNA启动子上特定的认知序列结合,调控NF-κB反应性基因的转录[6]。NF-κB是初级转录因子的一种,具有调节细胞反应的功能,例如细胞中无活性的转录因子,且不需要新的蛋白质合成来激活。这使得NF-κB成为了对有害细胞刺激的第一反应者。已经证明NF-κB在各种炎症细胞因子的激活中起中心作用,且是IBD发病的关键调节剂,因为NF-κB的表达和激活在IBD患者的结肠组织中显著上调。此外,活化的NF-κB的数量与肠道炎症的严重程度密切相关[7]。在IBD中,活化的NF-κB可调节与IBD发生、发展相关的促炎性细胞因子,如TNF-α、白细胞介素-1(interleukin-1,IL-1)等的产生和释放,加重肠道的炎性反应[8-9]。TNF-α作为多效细胞因子,通过触发白细胞活化和组织蓄积,在IBD的发病中发挥不可或缺的作用。因此,抑制NF-κB的活化已经作为治疗IBD的抗炎策略。Bortezomib是一种硼酸二肽衍生物,是26S蛋白酶体的选择性抑制药。研究发现,Bortezomib可通过抑制26S蛋白酶的作用抑制IκB的降解,从而阻断NF-κB的活化[10]。目前该药物已应用于多发性骨髓瘤的临床治疗,其安全性和有效性已得到证实。我们实验组在前期的工作中将Bortezomib联合传统化疗药物三氧化二砷用于肝癌治疗的研究,证明Bortezomib可以通过NF-κB的抑制作用增强肿瘤细胞对三氧化二砷的敏感性, 提高肝癌治疗的效果[11-13]。

注:与模型对照组比较,*P<0.05。 图2 结肠HE染色 (400×) A:正常对照组小鼠;B:模型对照组小鼠;C:三种剂量Bortezomib治疗后1 d、3 d和7 d的小鼠;D:三种剂量Bortezomib治疗后1 d、3 d和7 d HE评分Fig 2 HE staining of the colon (400×) A: mice in normal control group; B: mice in the model group; C: mice treated with three doses of Bortezomib for 1, 3 and 7 days; D: HE score in mice treated with three doses of Bortezomib for 1, 3 and 7 days

Bortezomib治疗天数/d注:与模型对照组比较,*P<0.05。图3 Bortezomib治疗后对IBD炎症相关物质TNF-α的影响
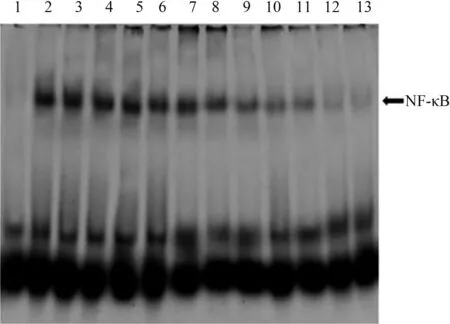
注:条带1:正常对照组小鼠;条带2、3、4:PBS处理1 d、3 d、7 d的模型组小鼠;条带5、6、7:低剂量Bortezomib处理1 d、3 d、7 d的小鼠;条带8、9、10:中剂量Bortezomib处理1 d、3 d、7 d的小鼠;条带11、12、13:高剂量Bortezomib处理1 d、3 d、7 d的小鼠。
图4EMSA方法检测NF-κB的DNA结合活性
Fig4DNAbindingactivityofNF-κBinthecolonevaluatedbyEMSA
本研究结果表明,经Bortezomib治疗可以显著下调DSS诱导NF-κB p65核易位水平,且随着用药时间和用药剂量的增加,对NF-κB的抑制作用也逐渐增加,具有明显的时间和剂量依赖性。此外,我们评估了Bortezomib对DSS诱导的IBD小鼠模型的影响。结肠的炎症程度由升高的DAI评分和组织学损伤评分表示。已经证明,应用Bortezomib可以有效减轻结肠炎症。在用日剂量0.6 mg/kg或1 mg/kg的Bortezomib治疗经DSS诱导的IBD小鼠模型3 d或7 d后,DAI评分和组织学评分显著降低,表明Bortezomib可从临床和组织病理学上同时抑制DSS诱导的IBD。而经Bortezomib治疗后,由DSS诱导的结肠炎小鼠模型,TNF-α血清水平显著上调。在应用Bortezomib治疗后,TNF-α的血清水平显著下调,这表明Bortezomib可能通过抑制促炎介质TNF-α来改善IBD的严重程度。
我们的研究结果推测,Bortezomib可能通过抑制NF-κB的DNA结合活性,下调TNF-α的表达水平,减弱小鼠DSS诱导IBD的严重性。从统计数据中可以看出,随着Bortezomib治疗剂量和治疗天数的增加,对NF-κB的活性抑制作用越来越明显,对IBD的治疗作用也越来越来明显。通过将来进一步深入的研究与探索,Bortezomib可能是治疗IBD的新型治疗药物。
[1] DA SILVA B C, LYRA A C, ROCHA R, et al. Epidemiology, demographic characteristics and prognostic predictors of ulcerative colitis [J]. World J Gastroenterol, 2014, 20(28): 9458-9467. DOI:10.3748/wjg.v20.i28.9458.
[2] MEI W Q, HU H Z, LIU Y, et al. Infliximab is superior to other biological agents for treatment of active ulcerative colitis: A meta-analysis [J]. World J Gastroenterol, 2015, 21(19): 6044-6051. DOI:10.3748/wjg.v21.i19.6044.
[3] ABRAHAM C, CHO J H. Inflammatory bowel disease-NEJM [J]. New Engl J Med, 2009, 361(21): 2066-2078. DOI:10.1056/NEJMra0804647.
[4] MTEOS M V, BRINGHEN S, RICHARDSON P G, et al. Bortezomib cumulative dose, efficacy, and tolerability with three different bortezomib-melphalan-prednisone regimens in previously untreated myeloma patients ineligible for high-dose therapy [J]. Haematologica, 2014, 99(6): 1114. DOI: 10.3324/haematol.2013.099341.
[5] 李晴, 胡丽红, 曲波. 不同浓度DSS诱导小鼠溃疡性结肠炎模型的比较[J]. 胃肠病学和肝病学杂志, 2016, 25(10): 1106-1110. DOI: 10.3969/j.issn.1006-5709.2016.10.008.
LI Q, HU L H, QU B. Comparison of different concentrations of DSS induced a mouse model of ulcerative Colitis [J]. Chin J Gastroenterol Hepatol, 2016, 25(10): 1106-1110. DOI: 10.3969/j.issn.1006-5709.2016.10.008.
[6] BAEUERLE P A, BALTIMORE D. IκB: a specifi c inhibitor of NF-κB transcription factor [J]. Science, 1988, 242(4847): 540-546. DOI: 10.1126/science.3140380.
[7] 胡丽红, 李晴, 曲波. 乌司他丁对溃疡性结肠炎小鼠模型炎症抑制作用及机制研究[J]. 胃肠病学和肝病学杂志, 2016, 25(10): 1111-1115. DOI: 10.3969/j.issn.1006-5709.2016.10.009.
HU L H, LI Q, QU B. Research on the inhibition effect and mechanism of Ulinastatin on mice model with ulcerative colitis [J]. Chin J Gastroenterol Hepatol, 2016, 25(10): 1111-1115. DOI: 10.3969/j.issn.1006-5709.2016.10.009.
[8] 张超贤, 郭李柯, 郭晓凤. 溃疡性结肠炎模型大鼠NF-κB活性、NF-κB mRNA及TNF-α mRNA的表达及芪倍合剂的干预作用[J]. 西安交通大学学报医学版, 2011, 32(3): 319-323.
ZHANG C X, GUO L K, GUO X F. NF-κB activity, NF-κB mRNA and TNF-α mRNA expressions in rats with ulcerative colitis and the interventional effect of Huangqi mixture on them [J]. Journal of Xi’an Jiaotong University (Medical Sciences), 2011, 32(3): 319-323.
[9] ZHAO Z J, XIANG J Y, LIU L, et al. Parthenolide, an inhibitor of the nucler factor-κB pathway, ameliorates dextran sulfate sodium-induced colitis in mice [J]. Int Immunopharmacol, 2012, 12(1): 169-174. DOI: 10.1016/j.intimp.2011.11.007.
[10] 林桐, 张启国, 吴鸿雁, 等. 多发性骨髓瘤患者骨髓组织中NF-κB/p65的表达与硼替佐米疗效的关系[J]. 东南大学学报(医学版), 2016, 35(1): 41-45. DOI: 10.3969/j.issn.1671-6264.2016.01.009.
LIN T, ZHANG Q G, WU H Y, et al. Expression of NF-κB/p65 associated with the efficacy of bortezomib in multiple myeloma [J]. J Southeast Univ (Med Sci Edi), 2016, 35(1): 41-45. DOI: 10.3969/j.issn.1671-6264.2016.01.009.
[11] 刘婷, 刘静, 褚艳杰, 等. 亚砷酸联合硼替佐米对肝癌细胞系BEL-7402的作用[J]. 世界华人消化杂志, 2012,20(1): 9-14. DOI: 10.11569/wcjd.v20.i1.9.
LIU T, LIU J, CHU Y J, et al. Bortezomib enhances arsenous acid-induced inhibition and apoptosis of BEL-7402 cells [J]. World Chinese Journal of Digestology, 2012, 20(1): 9-14. DOI: 10.11569/wcjd.v20.i1.9.
[12] HU L H, FAN Y J, LI Q, et al. Bortezomib protects against dextran sulfate sodiuminduced ulcerative colitis in mice [J]. Mol Med Rep, 2017, 15(6): 4093. DOI: 10.3892/mmr.2017.6524.
[13] 胡丽红, 李晴, 曲波. 硼替佐米在溃疡性结肠炎中治疗作用的实验研究[J]. 胃肠病学, 2017, 22(7): 402-406. DOI: 10.3969/j.issn.1008-7125.2017.07.004.
HU L H, LI Q, QU B. Experimental study of Bortezomib for treatment of ulcerative colitis [J]. Chin J Gastroenterol, 2017, 22(7): 402-406. DOI: 10.3969/j.issn.1008-7125.2017.07.004.
