源于中国民间传统酿造食品的鲁氏酵母耐温特性研究
2018-03-20刘翠翠杨华陈雄姚娟李志军李沛李欣
刘翠翠,杨华,陈雄,姚娟,李志军,李沛,李欣*
(1.湖北工业大学教育部发酵工程重点实验室,工业微生物湖北省重点实验室,湖北省工业发酵协同创新中心,武汉 430068;2.湖北安琪酵母股份有限公司,湖北 宜昌 443003)
酵母是现代生物产业中使用最广泛的微生物,应用领域包括酿造发酵、饲料养殖、生物医药、营养健康等[1]。在重要的应用领域——酱油酿造过程中,鲁氏酵母(Zygosaccharomycesrouxii)是主发酵酵母,是酱油酿造后期风味物质的重要来源[2]。然而,鲁氏酵母活性干酵母的应用受到极大的限制,主要是由于细胞本身耐性水平低导致其干酵母存活时间短。作为一种代谢合成的非还原性双糖,海藻糖(Trehalose)赋予了细胞在高温、脱水、冷冻、干燥等逆境环境下的抗逆能力[3-7]。同时,不同种属和不同菌株的微生物的海藻糖合成能力及其抗性不同[8,9]。因此,对酵母细胞而言,分析特定菌株的性能对于该菌株的认识和应用评估等方面均有积极的意义[10]。本工作针对1株从民间传统酿造食品中筛选出的生长能力强、耐盐水平高、风味丰满的鲁氏酵母,研究了碳源、海藻糖合成和耐温特性三者之间的关系,为进一步的应用提供依据和参考。
1 材料与方法
1.1 酵母菌株及其培养
鲁氏酵母(Zygosaccharomycesrouxii)CCTCC M2013310是1株从中国民间传统酿造食品中筛选的酵母菌株,保存于中国典型培养物保藏中心(China Center for Type Culture Collection,简称 CCTCC)[11]。
酵母细胞培养基YEPD:10.00 g/L 酵母抽提物、20.00 g/L蛋白胨、20.00 g/L葡萄糖,pH 5.0。
酵母活细胞数检测培养基为含1.5%琼脂粉的固体YEPD培养基。
1.2 试剂
葡萄糖、果糖、蔗糖、甘油、蒽酮(分析纯) 国药集团化学试剂有限公司;酵母粉、蛋白胨(生化试剂) 北京双旋微生物培养基制品厂;糖蜜 安琪酵母股份有限公司;硫酸(优级纯) 信阳市化学试剂厂;琼脂粉(分析纯) 武汉市华顺生物技术有限公司。
1.3 仪器设备
CJ-2D无菌操作台 天津泰斯特仪器有限公司;HH-2数显恒温水浴锅 常州国华电器有限公司;PL2002和AL104电子分析天平 梅特勒-托利多仪器(上海)有限公司;BL-75A高压灭菌锅 上海博迅实业有限公司;HNY-211B恒温摇床 天津欧诺仪器仪表有限公司;ZSD-A1160A恒温培养箱 上海智城分析仪器制造有限公司;CT15RE离心机 日本日立公司;V-1100D可见分光光度计 上海美谱达仪器有限公司;5804R型离心机 德国Eppendorf公司。
1.4 实验方法
1.4.1 培养基中碳源替换
将YEPD中的20.00 g/L葡萄糖按照等摩尔碳置换的原则替换成其他碳源。甘油、果糖和蔗糖在培养基中对应的浓度分别为20.45 mL/L,20.00 g/L和19.02 g/L。糖蜜以其主要成分蔗糖(37%)为置换对象,则对应浓度为51.41 mL/L。培养基中其他组分的浓度不变。
1.4.2 内源性高海藻糖鲁氏酵母的制备
在10 L发酵罐中,通过补料和控温策略制备内源性高海藻糖鲁氏酵母[12]。在研究此酵母耐温特性时,以上罐种子液中的鲁氏酵母作为对照,即视为海藻糖未积累细胞。
1.4.3 高温处理过程
鲁氏酵母细胞培养或发酵后,2 mL细胞悬液被置于设定温度的恒温水浴锅中,处理一定时间后,直接用于检测酵母活细胞数。水浴温度设定为35,40,45,50 ℃。
1.4.4 低温处理过程
鲁氏酵母细胞培养液、发酵液或发酵种子液被等分于2 mL灭菌离心管中,再分别放置于冰箱冷藏区(4 ℃)和冷冻区(-20 ℃)保存。每隔24 h取出1份样品用于酵母活细胞数的检测。
1.5 检测方法
1.5.1 存活率和致死率的检测
酵母活细胞数采用稀释涂布法检测。温度处理样品的鲁氏酵母存活率和致死率用如下公式计算:
高温酵母存活率(%)=

式(1)
低温酵母存活率(%)=
式(2)
致死率(%)=1-存活率。
式(3)
1.5.2 胞内海藻糖浓度的检测
采用硫酸-蒽酮法测定胞内海藻糖浓度[13]。取适量体积的新鲜酵母发酵液,用冰蒸馏水离心洗涤2次,在沉淀(酵母泥)中加入4 mL 0.5 mol/L三氯乙酸,将离心管震荡混匀后置于冰块中,并每15 min震荡1次。1 h后于3000 r/min离心,其上清倒入50 mL容量瓶中。用冰水洗涤沉淀2次,其洗涤液均倒入容量瓶中,且最后用冰水定容。定容液被用于海藻糖浓度的测定。以含有4 mL 0.5 mol/L三氯乙酸的冰水为空白样。
2 结果与分析
2.1 鲁氏酵母高温敏感性分析
细胞生长过程是一个生理动态变化过程,这意味着细胞对外界环境的响应特性也在变化。鲁氏酵母CCTCC M2013310在YEPD营养条件下的不同生长期对高温的敏感性见图1。

图1 YEPD中不同生长阶段的鲁氏酵母CCTCC M2013310对高温(50 ℃,10 min)的敏感度Fig.1 The sensitivity of Z.rouxii CCTCC M2013310 to high temperature (50 ℃,10 min) at different growth stages of cell on YEPD medium
鲁氏酵母CCTCC M2013310在适应末期或对数生长早期(7 h)比对数中期(14 h)和稳定期初期(21 h)更耐热,细胞存活率为4.00%,比对数中期和稳定期分别提高4.49,4.39倍。可见,在这种简单的营养环境下,鲁氏酵母细胞在生长早期具有更好的抗高温逆境的能力。然而,稳定期的鲁氏酵母细胞耐温能力对酵母的保存保藏更为重要。稳定期的鲁氏酵母CCTCC M2013310的耐高温特性见图2。

图2 YEPD中稳定期的鲁氏酵母CCTCC M2013310的耐高温特性Fig.2 The properties of high temperature tolerance of Z.rouxii CTCC M2013310 harvested from the stationary phase on YEPD medium
整体上看,随着处理温度的上升和时间的延长,鲁氏酵母细胞致死率也逐渐增大。稳定期的鲁氏酵母对不同温度的敏感性显示出差异。除45 ℃环境外,对数末期的鲁氏酵母在处理早期对温度更敏感。高温维持2 min后,不同温度下的致死率分别为71.54%(35 ℃),81.43%(40 ℃)和88.17%(50 ℃)。继续处理8 min后,酵母细胞致死率只分别增加了18.20%(35 ℃),16.45%(40 ℃)和11.83%(50 ℃)。然而45 ℃下,4 min内的酵母细胞致死率在所有温度下都是最低的,分别为46.67%(2 min)和64.86%(4 min)。但最终处理10 min,其致死率也达到99.42%。
2.2 内源性高海藻糖鲁氏酵母耐高温特性
海藻糖是一种普遍的酵母细胞逆境保护级,但对不同酵母的保护特性存在差异。通过发酵调控技术制备了海藻糖胞内高积累水平(含量不低于8%)的鲁氏酵母细胞悬液,以研究海藻糖对鲁氏酵母CCTCC M2013310耐温特性的影响。在40,50 ℃条件下分别处理5 min或10 min后的鲁氏酵母CCTCC M2013310的活细胞存活率见图3。

图3 内源性海藻糖积累对鲁氏酵母CCTCC M2013310耐高温特性影响Fig.3 The effect of high temperature on the capability of tolerant high temperature of Z.rouxii CTCC M2013310 accumulated endogenous trehalose
无论何种高温和处理时间,海藻糖的积累都能显著提高鲁氏酵母的细胞存活率,特别是在40 ℃/10 min和50 ℃/5 min条件下。在这2种条件下,鲁氏酵母CCTCC M2013310的细胞存活率分别从31.40%和49.73%恢复到100%,避免了热损失。在最严重的逆境下(50 ℃,10 min),细胞存活率也从1.36%提高到47.62%。可见,内源性海藻糖的积累非常有利于鲁氏酵母CCTCC M2013310在高温逆境下生存。
2.3 内源性高海藻糖鲁氏酵母抗低温特性
未积累与积累胞内海藻糖的鲁氏酵母CCTCC M
2013310在低温(4 ℃)和冷冻逆境(-20 ℃)下的细胞存活率差异见图4。

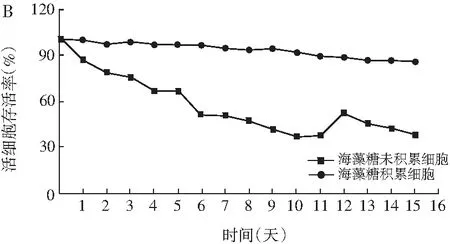
图4 内源性海藻糖对鲁氏酵母CCTCC M2013310抗低温(A)和冷冻能力(B)Fig.4 The effect of low temperature (A) and freezing(B) on the survival rate of Z.rouxii CTCC M2013310 accumulated endogenous trehalose
在15天的低温保藏逆境下,胞内未积累海藻的鲁氏酵母CCTCC M2013310在保藏早期的细胞存活率略有下降,而后期的细胞存活率维持在89%水平。积累有高浓度海藻糖的鲁氏酵母细胞在整个逆境周期下的细胞存活率不低于99%水平。可见,鲁氏酵母CCTCC M2013310本身具有一定的耐低温能力,而胞内海藻糖的积累对该酵母的低温耐受能力没有显著的效用。然而,在冷冻环境下,随着冷冻时间的延长,胞内未积累海藻糖的鲁氏酵母细胞存活率显著下降,到15天时,细胞存活率只有38.22%。然而,积累有胞内海藻糖的鲁氏酵母细胞存活率在冷冻周期内依然很高,周期结束时的存活率高达85.87%,比对照提高了2.25倍。可见,胞内海藻糖的存在能显著提高鲁氏酵母CCTCC M2013310在冷冻逆境下的生存能力,这将有助于改善冷冻环境下的鲁氏酵母细胞保藏水平。
2.4 不同碳源下鲁氏酵母积累海藻糖和抗高温能力的差异
6-磷酸葡萄糖既是海藻糖的前体物,也是海藻糖合成另一个前体物UDP-葡萄糖的前体[14]。由于6-磷酸葡萄糖位于糖酵解途径,且是糖利用途径的关键中间代谢产物,因此,不同碳源将对海藻糖合成产生影响。分别展现了酵母常用碳源葡萄糖和甘油、葡萄糖同系物果糖及双糖蔗糖和糖蜜对鲁氏酵母CCTCC M2013310积累海藻糖水平(A)和不同高温环境下的生存差异(B)的影响,见图5。


图5 不同碳源对鲁氏酵母CCTCC M2013310积累海藻糖(A)和耐高温能力(B)的影响Fig.5 The effect of different carbon sources on the accumulated levels of endogenous trehalose (A) and the capability of tolerant high temperature (B) of Z.rouxii CCTCC M2013310
无论使用何种碳源为营养物,鲁氏酵母胞内海藻糖浓度都呈现随着发酵时间的延长而增加且在稳定期达到最大的特点。在稳定期(26 h),胞内海藻糖的浓度分别为7.00 mg/g干重(甘油)、4.31 mg/g干重(葡萄糖)、6.88 mg/g干重(果糖)、5.78 mg/g干重(蔗糖)和4.86 mg/g干重(糖蜜)。不同于另外3种碳源,在生长前期(8 h),以果糖和蔗糖为碳源时,胞内海藻糖积累增加量不高。整体而言,果糖和甘油更利于胞内海藻糖的合成,蔗糖和糖蜜次之,而葡萄糖的效果最差。值得注意的是,碳源对海藻糖积累的强弱效应差异并没有与细胞耐高温性能一一对应。以果糖为碳源所收获的鲁氏酵母抗高温能力最强,无论是45 ℃还是50 ℃,其致死率分别为44.26%和57.35%。鲁氏酵母在糖蜜或葡萄糖中生长后,其稳定期细胞的抗逆水平最低,但表现出相近的耐高温能力,致死率分别为67.36%,69.96%(45 ℃)和84.32%,80.87%(50 ℃),比果糖条件下提高了24%~25%。可见,碳源对鲁氏酵母合成海藻糖产生影响,且海藻糖积累水平高不一致细胞抗温度逆境水平高,而海藻糖浓度低也并不意味细胞丧失耐温能力。
3 结果与讨论
鲁氏酵母是一种重要的应用酿造酵母,对酿成产品风味的形成具有重要贡献[15]。在酿造应用过程中,鲁氏酵母面临环境温度的大幅度变化,因此,酵母的耐温能力决定了鲁氏酵母在酿造过程中功效发挥效果。鲁氏酵母CCTCC M2013310是1株从民间传统酿造食品中筛选出的酵母,具有生长能力强、耐盐水平高、风味丰满的特点。本研究分析了该酵母正常生长的耐温特性及海藻糖对其抗温逆境的能力,为该酵母的应用和研究提供了理论基础和参考。
在简单营养条件如YEPD下培养的鲁氏酵母耐高温水平低,但延迟期细胞却有相对高的存活率。整体上,温度越高,对鲁氏酵母致死作用越大,处理10 min后的致死率基本达到100%。然而,增加鲁氏酵母胞内海藻糖浓度后,鲁氏酵母细胞耐高温能力显著提高,但对细胞耐冷温无明显贡献,却有助于提高细胞耐冷冻水平。鲁氏酵母细胞内海藻糖积累与碳源有明显关系。甘油和果糖能较好地促进鲁氏酵母积累海藻糖,葡萄糖效果最差。而且,葡萄糖条件下的鲁氏酵母细胞的耐热能力很弱,远低于果糖条件。
在研究结果中的一些问题需要说明和解释。图2所展现的鲁氏酵母在45 ℃下的致死率曲线与其他温度的差异既令人困惑,也很有趣。这种差异暗示45 ℃将给鲁氏酵母细胞带来新的、不同于其他温度的生理状态,而这种生理状态赋予了酵母细胞拟定程度的短时耐温能力。对鲁氏酵母在该温度下通过何种途径获得哪些生理变化还需要深入细致的研究。其二,图3中出现的酵母细胞存活率高于100%的情况可能是由多种因素导致的,包括但不限于稀释涂布人工操作导致的出芽孢子的分离、外源添加物的额外保护作用(如糖蜜)和系统误差等。最需要解释的碳源对鲁氏酵母CCTCC M2013310细胞积累海藻糖水平和耐热能力的差异(见图5)。在酿酒酵母中,碳源的改变会导致碳代谢流、磷酸化作用和氧化还原中间物的变化[16,17]。一个合理的解释是不同糖源具有不同中间代谢产物UDP-葡萄糖和6-磷酸葡萄糖积累特性,进而导致胞内海藻糖合成水平的差异。这种差异反映到细胞耐温能力上,但绝非全部。在酿酒酵母中,细胞的抗干燥能力虽然主要来源于胞内海藻糖,但麦芽糖也承担一定的功效。可见,鲁氏酵母细胞的抗逆能力并非由单一的海藻糖浓度决定。
[1]田晓菊.酵母属在食品工业中的应用[J].中国酿造,2015,34(4):13-16.
[2]赵丽云.天然酱醪中生香酵母的分离鉴定及其香气特征分析[J].食品与机械,2012(4):11-14.
[3]Li H,Wang H L,Du J,et al.Trehalose protects wine yeast against oxidation under thermal stress[J].World Journal of Microbiology and Biotechnology,2010,26(6):969-976.
[4]Hugo T,Lindsey Y,Douglas F,et al.Increasing intracellular trehalose is sufficient to confer desiccation tolerance toSaccharomycescerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(19):6122-6127.
[5]Diniz-mendes L,Bernardes E,Araujo P S,et al.Preservation of frozen yeast cells by trehalose[J].Biotechnology and Bioengineering,1999,65(5):572-578.
[6]陈丽君,肖冬光,郭学武,等.面包酵母海藻糖含量与酵母耐性之间的关系[J].食品工业科技,2011(8):112,117.
[7]Toshihiko M.Trehalose protects corneal epithelial cells from death by drying[J].The British Journal of Ophthalmology,2001,85(5):610-612.
[8]Argüelles J C.Physiological roles of trehalose in bacteria and yeasts:a comparative analysis[J].Archives of Microbiology,2000,174(4):217-224.
[9]Solange I M,Ercilia M S M,Livia M C,et al.Sugars metabolism and ethanol production by different yeast strains from coffee industry wastes hydrolysates[J].Applied Energy,2012,92:763-768.
[10]Della-bianca B E,Gombert A K.Stress tolerance and growth physiology of yeast strains from the Brazilian fuel ethanol industry[J].Antonie Van Leeuwenhoek,2013,104(6):1083-1095.
[11]陈雄,代俊,王志.一种高耐盐鲁氏结合酵母[P].中国专利:ZL201310362802.2,2015-02-19.
[12]胡梦蝶.鲁氏酵母积累海藻糖的发酵工艺研究[D].武汉:湖北工业大学,2016.
[13]胡梦蝶,陈雄,李欣,等.不同胁迫条件对鲁氏酵母胞内海藻糖积累的影响研究[J].食品工业科技,2016,37(11):130-133.
[14]池振明,梁丽琨,朱开玲,等.酵母海藻糖的代谢与调控研究进展[J].中国海洋大学学报(自然科学版),2006(2):209-214.
[15]卫永华,齐威,王春玲,等.耐盐酵母在酱油中的应用及其耐盐机理的研究[J].中国酿造,2012(4):25-28.
[16]Sonia C,Juan C A,Miguel A A.Fluxes of carbon,phosphorylation,and redox intermediates during growth ofSaccharomycescerevisiaeon different carbon sources[J].Biotechnology and Bioengineering,1995,47:193-208.
[17]Verstrepen K J,Iserentant D,Malcorps P,et al.Glucose and sucrose:hazardous fast-food for industrial yeast?[J].Trends in Biotechnology,2004,22(10):531-537.
