BAD基因在敖汉细毛羊发情不同时期卵巢表达规律及对生殖激素的影响
2018-03-20张梦瑶巨安庆刘开东王国义贺建宁
张梦瑶,巨安庆,杨 峰,刘开东,王国义,柳 楠,贺建宁*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.青岛畜牧兽医研究所,山东青岛 266121;3.赤峰市敖汉旗种羊场,内蒙古赤峰 024300)
大多数绵羊表现为季节性发情,通常在光照逐渐缩短的夏末秋初发情。哺乳动物的发情是一个多级的生理过程,包括发情初期的卵泡生长、卵母细胞减数分裂及卵泡破裂黄体化。目前关于家畜季节性发情的启动机制研究较少,大多数集中在激素水平的变化,如垂体分泌的促性腺激素、促卵泡激素及促黄体激素[1]等,而基因作用机制尚不清楚。因此寻找绵羊季节性发情的调控基因,对于提高绵羊的繁殖效率促进育种进程有重要意义。
促凋亡基因BAD属于Bcl-2大家族[2]。细胞凋亡是受Bcl-2家族中促进和抑制细胞2类蛋白的比例决定,Bcl-2家族促凋亡蛋白和抗凋亡蛋白通过竞争性作用来调控细胞凋亡,Bcl-2家族包括凋亡抑制基因bcl-2、mcy-1、bcl-xl等,凋亡基因BAD、bcl-xs、bax等和仅存在BH-3结构域的基因bim、bik、bid等[3-4]。大量研究表明[5-6],Bcl-2家族基因的表达产物也在线粒体调节的凋亡过程中起到关键性的作用。Zong等[7]和李东侃等[8]发现,BAD基因在眼球萎缩眼视神经残存髓鞘组织以及正常的视神经髓鞘组织有表达,而在束间隔及神经胶质细胞不表达,表明BAD可能具有促进外伤性眼球萎缩的功能。RangEr等[9]研究发现,缺少BAD蛋白的小鼠会发生肿瘤细胞的增殖,而且绝大多数为B淋巴细胞瘤,这说明BAD是一种抑制肿瘤细胞的蛋白。
敖汉细毛羊是内蒙优良肉毛兼用型绵羊品种,表现为季节性发情,在夏末秋初开始发情[10]。本研究拟利用RT-PCR技术检测BAD基因在乏情期、发情前期、发情间期以及发情期卵巢中BAD基因的表达情况,利用放射免疫方法测定了血液中促卵泡激素(FSH)、促黄体生成素(LH)、雌二醇(E2)和孕激素(P4)的浓度,分析其与敖汉细毛羊季节性发情启动的关系,为深入研究绵羊季节性繁殖的调理机理提供参考。
1 材料与方法
1.1 实验材料 选择饲养条件一致、体重接近、3~4周岁、空怀的健康敖汉细毛羊母羊24只,分为乏情期、发情间期、发情前期和发情期4组,每组6只羊。每只羊以发情开始到第2次发情开始作为其发情周期,分别在夏季的乏情期和秋季的发情前期、发情期和发情间期4个时间点处死细毛羊,并在最短时间内用专门处理过的、洁净的手术器械采集卵巢组织,立即放入液氮保存备用。
1.2 实验试剂及仪器 琼脂糖、溴化乙锭(EB)、DEPC、DAPI等均购自青岛赛尚科贸有限公司;iTaq-Uniwersal SYBR Green SuPermix 5 mL(5×1mL Vials)购 自Bio-Rad公 司;Thermo Scientific Revert Aid First Strand cDNA Synthesis Kit、DNA Ladder 2000、Dream TaqTM Green PCR Master Mix2×均购自北京索莱宝科技有限公司。核酸蛋白分析仪购自德国EppEndorf公司;EDC-810PCR仪购自东胜创新生物科技有限公司;DYY-11型电泳仪购自北京市六一仪器厂;Redbio CFX ConnectTM荧光定量PCR系统购自Bio-Rad公司。
1.3 血清采集 在乏情季节血液采集17 d;在发情季节从第1次发情开始采集血液,直至下一次发情开始结束。在8:00和14:00各采集不抗凝血各1次,每次10 mL。采集后血液37℃ 静置2 h后,3 000 r/min离心15 min,取上清于干净的1.5 mL离心管中,置于-20℃的冰箱保存,备用。送至青岛擎科生物采用放射免疫法测定血清中的P4、E2、LH和FSH浓度。
1.4 卵巢中RNA的提取及cDNA的合成 选取乏情期和发情期卵巢组织样品60 mg,加入1 mL的TRN-zol Roche试剂粉碎匀浆后抽提RNA。使用BioPhotometer型核酸蛋白测定仪测定其浓度和纯度,将检验合格的RNA用反转录试剂盒逆转录成cDNA。
1.5 引物设计及合成 根据绵羊BAD基因(GenBank登录号:XM-004019650.3)和绵羊GAPDH(GenBank登录号:NM-001190390)的序列,使用Primer 5.0软件设计引物,由青岛擎科生物有限公司合成,引物的基本信息见表1。
1.6 实时荧光定量PCR 以cDNA为模板进行荧光定量PCR。PCR反应体系25 μL:模板cDNA 1 μL,金牌Green mix 22 μL,上、下游引物各 1 μL。PCR 反应程序:94℃预变性10 min;94℃变性30 s,60℃退火30 s,72℃延伸40 s,40个循环。每个样品设置3次重复,采用2-△△CT值法计算各样本中BAD相对于内参基因GAPDH的表达量。
1.7 统计分析 利用SPSS 17.0软件中t检验对数据进行差异显著性分析,结果以平均值±标准差表示,以P<0.05作为差异显著性判断标准。

表1 引物信息
2 结 果
2.1 PCR扩增 1%琼脂糖凝胶电泳分析结果如图1所示,引物扩增的条带单一,内参基因产物大小为125 bp ,目的基因产物大小为257 bp,与已知的目的基因大小一致,可用于后续实验。
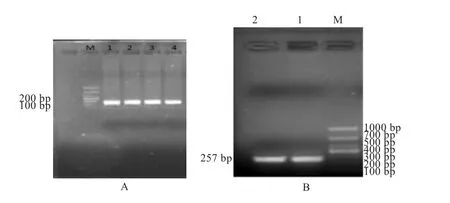
图1 GAPDH(A)和BAD(B)扩增
2.2 实时荧光定量PCR结果 由图2可知,BAD和GAPDH基因熔解曲线峰值单一、无杂峰,可知引物设计特异性良好,可用于下一步实验。
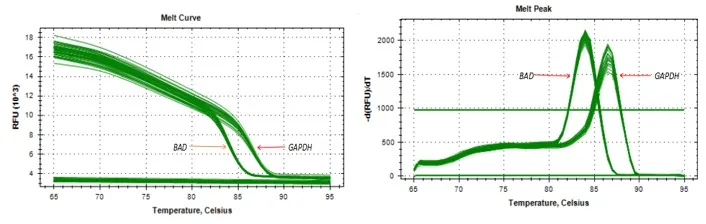
图2 BAD基因和GAPDH基因荧光定量扩增曲线(A)和熔解曲线(B)
2.3BAD基因的相对表达量 如图3所示,BAD基因在发情前期的表达量极显著高于乏情期、发情期和发情间期(P<0.01);在发情期的表达量极显著高于乏情期和发情间期(P<0.01);乏情期和发情间期的表达量基本相同(P>0.05)。
2.4 4种生殖激素在发情周期中的变化规律 由表2可知,E2浓度在第1、2 、16、17天 极显著高于其他时间(P<0.01),LH浓度在第1 天和第17 天极显著高于其他时间(P<0.01);P4浓度在发情间期处于较高的水平,第5~15天浓度极显著高于其他时间(P<0.01),P4浓度在发情期处于发情季节的最低值;FSH浓度在发情后降低,在发情间期逐渐升高,在第5~13天浓度极显著高于其他时间(P<0.01),在发情期时处于较高的水平。
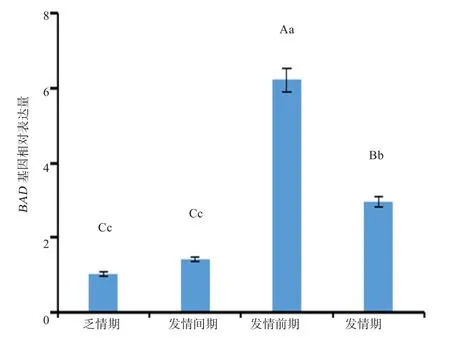
图3 各个时期BAD基因的相对表达量
2.5BAD基因在不同发情时期的表达量与4种激素浓度变化的分析 由图4可知,E2含量随着BAD基因表达量的升高而升高,推断BAD基因对E2的分泌均有促进作用。由图5可知,LH的含量随着BAD基因表达量的升高而升高,推断BAD基因对LH的分泌均有促进作用。由图6可知,P4浓度含量随着BAD基因表达量的升高而降低,从而推断BAD基因在发情季节的表达对P4分泌有抑制作用。由图7可知,FSH的浓度变化没有相应的促进和抑制规律变化关系,从而推断BAD基因的表达与FSH浓度的变化没有相应关系。
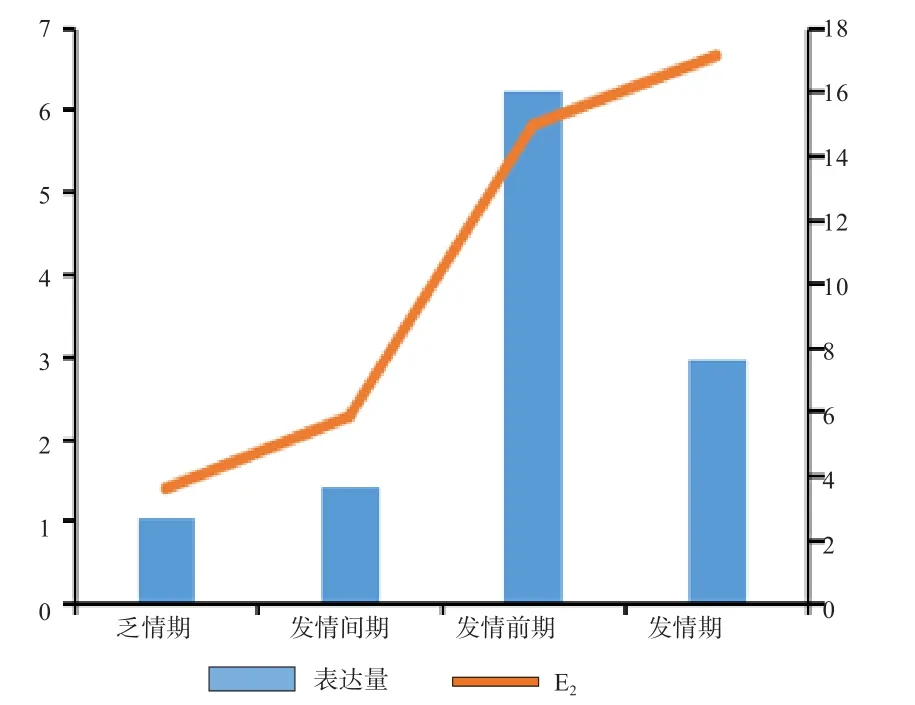
图4 E2浓度与BAD基因相对表达量
3 讨 论
BAD基因是与卵泡闭锁相关的促凋亡因子。王龙涛等[11]对BAD基因在小尾寒羊和萨福克羊卵巢、输卵管和子宫中的定位进行研究发现,BAD基因在原始卵泡、初级卵泡和次级卵泡呈现中度着染,而在3级卵泡中呈轻度着染;在小尾寒羊和萨福克羊卵泡期中BAD基因在卵巢卵泡、输卵管以及子宫内膜细胞中均有不同程度的表达,提示BAD基因的表达参与母羊生殖器官细胞凋亡的调控。BAD基因在小尾寒羊和萨福克羊生殖器官中表达有显著的差异[12],提示BAD基因在母羊生殖器官中的表达对于调控生殖器官细胞凋亡以及对母羊繁殖力有某种程度的影响,但具体调控机制有待进一步研究。本研究结果显示,BAD基因在发情前期的表达量极显著高于其他3个时期,这与前期相关研究结果一致,另一方面推测出BAD基因是与卵泡闭锁相关的促凋亡因子。
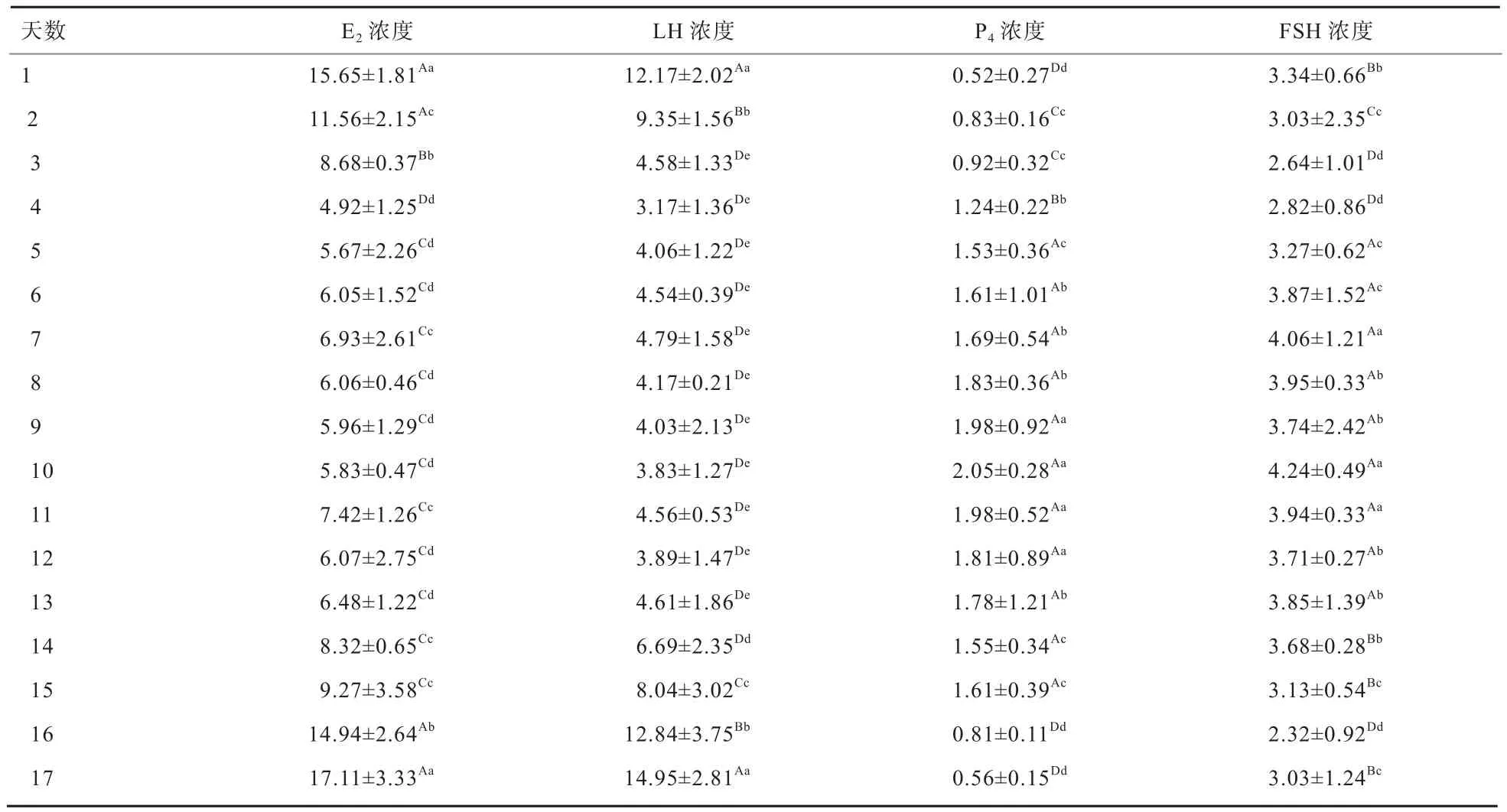
表2 敖汉细毛羊发情周期4种激素浓度
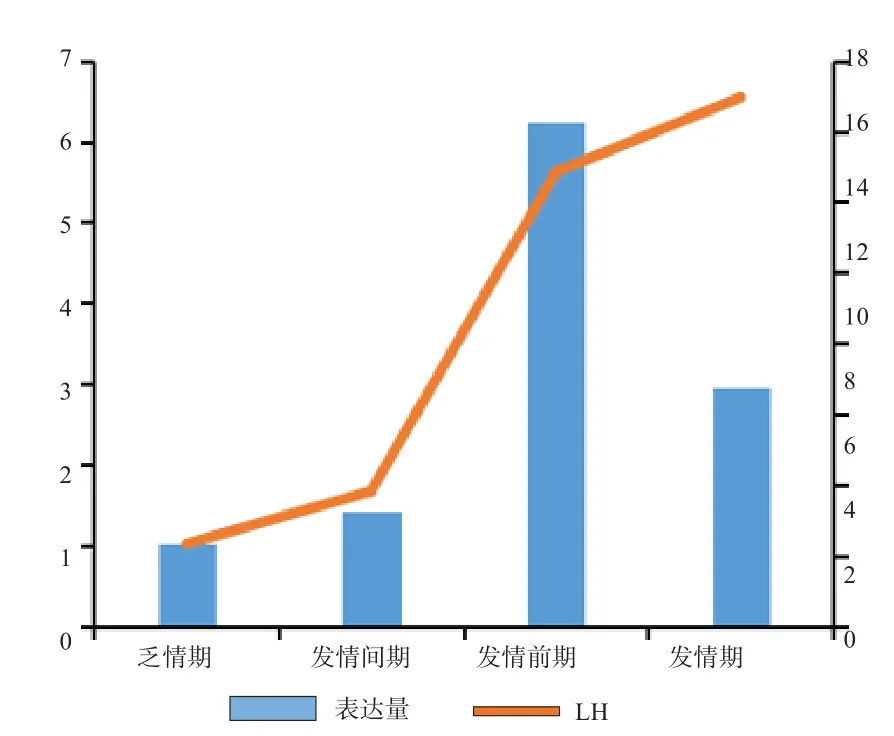
图5 LH浓度与BAD基因相对表达量
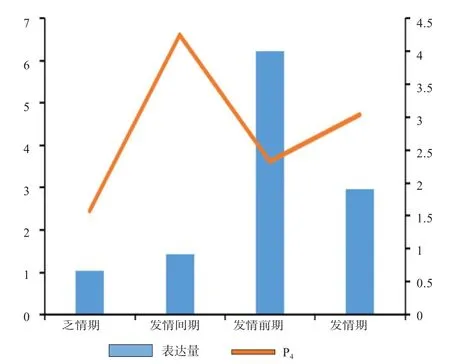
图6 P4浓度与BAD基因相对表达量
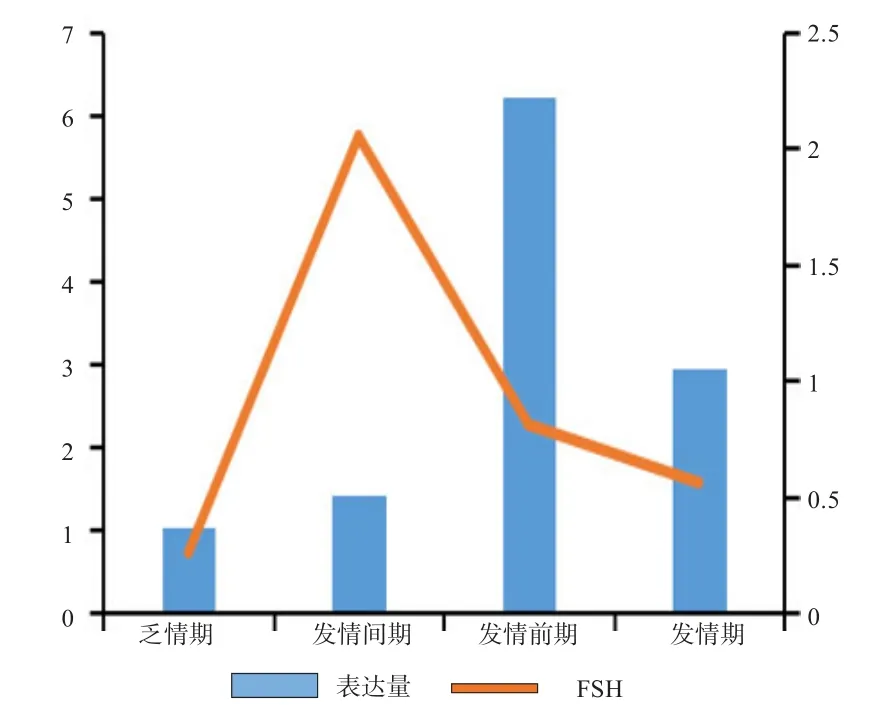
图7 FSH浓度与BAD基因相对表达量
绵羊的发情周期一般为16.5(14~20)d,本实验中的敖汉细毛羊发情周期为17 d。在发情前期,由于受FSH影响,卵泡开始明显生长,产生的E2增加,使得输卵管内膜细胞生长及其微绒毛增长,黏膜慢慢变厚。本研究中E2浓度在第1 天和第2 天的浓度显著高于其他时间段,与理论相符合,主要在动物的初情期前促进第二性征发育和垂体以及下丘脑有关生殖内分泌的活动。LH对维持黄体功能具有重要作用,发情后期也叫后情期,发情期之后,动物在LH作用下黄体迅速地发育。LH与FSH都是由腺垂体分泌,同属糖蛋白激素[13],在FSH的协同作用下促进雌性动物的卵泡成熟和排卵,使得排卵后的颗粒化细胞黄体化。在发情的第14天绵羊会进入卵泡期,这个时期FSH分泌激增,从而产生了排卵之前FSH高峰值,P4浓度会迅速下降,伴随着黄体的逐渐退化,同时E2的浓度会伴随着P4下降而快速升高,出现于LH峰平行的E2峰。本实验数据显示,LH浓度在发情前期和发情后期显著高于其他时期,这与LH的生理功能作用相一致,在后期促进黄体的发育。同样FSH在间期分泌增加协同LH来促进卵泡的成熟和排卵,在动物的发情中扮演着重要的角色。在发情周期中,P4的分泌量浓度变化与黄体的生长发育保持一致,在第8天的时候P4的分泌量达到最高水平,在发情前期开始下降。赵伟等[14]在对波尔山羊的研究中发现,P4在发情的第7天明显上升,到达第11天的时达到最大值,之后分泌量逐渐降低。从整体上来看,绵羊在黄体期的外周血中P4浓度处于比较高的水平;本实验数据显示,P4在发情间期处于较高的水平,发情期浓度较低。
近期研究表明黄体的退化受细胞凋亡调控。卢璐璐等[15]通过沉默卵泡颗粒细胞中BAD基因,运用放射免疫法得到P4会随着BAD基因的表达下降而极显著升高,E2的分泌量也有所下降但差异不显著。推测BAD基因可能通过调控P4的分泌量来控制绵羊的发情启动和维持发情[16]。葛晨霞等[17]研究表明,黄体的退化可能需要BAD基因参与,BAD基因的表达可能受到P4浓度的影响。通过对小鼠输卵管中BAD基因的研究发现,其在发情间期的表达呈上升趋势,而在发情期则逐渐降低,会随着发情不同阶段的变化而变化,与动物的发情启动密切相关[17]。本研究结果显示,P4在发情间期保持较高浓度,后随着BAD基因表达量的升高而显著降低。E2的分泌量随着BAD基因表达量的升高而升高,本实验与相关报道一致,从而推出BAD基因的表达对E2、P4的分泌有相应的促进和抑制作用。
本实验荧光定量PCR验证发现,在发情前期BAD基因的表达量极显著高于乏情期、发情期和发情间期;发情期的表达量极显著高于乏情期和发情间期;乏情期和发情间期的表达量基本相同,没有显著性差异。在沉默卵泡颗粒细胞中BAD基因的情况下,运用放射免疫法得到结果显示,P4会随着BAD基因的表达下降而极显著升高;E2的分泌量也有所升高但是差异不显著,反向验证了BAD基因抑制P4的表达[14]。P4的结果与本实验结果相一致,P4会随着BAD基因的表达升高而极显著降低。但本实验中E2的分泌量也随着BAD基因的表达升高而显著升高,这可能与实验动物的品种差异有关;FSH浓度与BAD基因的表达没有直接的相关性。综上结果表明,BAD基因的表达对卵巢的成熟起到了一定的促进作用,同时也影响了生殖激素的分泌,从而得出基因的表达对绵羊的发情有一定的控制作用。
4 结 论
BAD基因在发情前期的表达量极显著高于其他时期;E2和LH浓度在BAD基因表达量最高的发情前期维持在较高水平,P4的浓度维持较低水平,推断BAD基因的表达对卵泡的成熟起促进作用,同时也促进了E2和LH的分泌,抑制了P4的产生,进而影响细毛羊发情。
[1] Fan H Y, Richards J S. Minireview: Physiological and pathological actions of RAS in the ovary[J]. Med Sci, 2010,24(2): 286-298.
[2] 张书霞, 陈万芳, 鲍恩东. 细胞凋亡及其基因调控[J]. 中国兽医科技,1997, 27(3): 19-21.
[3] Hong Z, Wolfgang H, Christian De G. Bcl2-L-10, a novel antiapoptotic member of the Bc-l 2 family, blocks apoptosis in themitochondria death pathway but not in the death receptor path-way[J]. Hum Mol Genet, 2001, 10(21): B2329.
[4] Zhao Y, Li S, Childs E E,et al. Activation of pro-death Bc-l 2family proteins and mitochondria apoptosis pathway in tumornecrosis factor-alpha-induced liver injury[J]. J Biol Chem, 2001 276 (29): B27432.
[5] Rashmi R, Kumar S, Karunagaran D. Human colon cancer cells lacking Bax resist curcumin-induced apoptosis and Bax re-quirement is dispensable with ectopic expression of Smac ordownregulation of Bc-l XL [J]. Carcinogenesis, 2005, 26(4):B713.
[6] 卿晨, 丁健. Bcl-2基因家族在调节细胞凋亡中的作用[J]. 国外医学(分子生物学分册), 2000 (1) 10-16.
[7] Zong W X, Lindsten T, Ross A J,et al.BH3 - only proteins that bind pro -survival Bcl -2 family members fail to induce apoptosis in the absence of Bax and Bak[J]. Genes Dev, 2001,15(12): 1481.
[8] 李东侃, 宋跃. 外伤性眼球萎缩眼视神经组织中bcl-2相关死亡基因bad的表达及其意义[J]. 中国眼底病杂志, 2002,18(4): 276 -278.
[9] Ranger A M, Zha J, Harada H,et al. Bad - deficient mice develop diffuse large B cell lymphoma[J]. Proc Natl Acad Sci USA,2003, 100(16): 9324.
[10] 赵晓平.敖汉细毛羊遗传参数估计及核心群育种效果分析研究[D]. 呼和浩特:内蒙古农业大学, 2008.
[11] 王龙涛, 葛晨霞, 李向军, 等. 促凋亡基因(Bad)在卵泡期绵羊生殖器官中的表达[J]. 中国兽医学报, 2010, 30(12): 1712-1716.
[12] Kaipia A, Hsu S Y, Hsueh A J. Expression and Function of a Proapoptotic Bcl-2 Family MemberBcl-XL/Bcl-2-Associated Death Promoter(BAD) in Rat Ovary[J]. Endocrinology, 1997,138(12): 5497-5504.
[13] Langer R, Mutze K, Becker K,et al. Expression of class I his tone deacetylases(HDAC1 and HDAC)in oesophagealadenocarcinomas: an immunohistochemical study[J]. J Clin Pathol, 2010, 62(11): 994-998.
[14] 赵伟. 波尔山羊同期发情、超数排卵及其影响因素研究[D].成都: 四川农业大学, 2006.
[15] 卢璐璐, 储明星. 绵羊BAD基因影响常年发情性状的功能研究[J]. 中国兽医学报, 2015, 30(20): 1211-1215.
[16] 赵松华, 李洪涛, 张文祥, 等. 非繁殖季节中国美利奴羊血清E2、P4、FSH、LH激素变化规律研究[J]. 黑龙江畜牧兽医, 2012 (11): 49-51.
[17] 葛晨霞, 王龙涛, 李向军, 等. Bad基因在黄体期绵羊生殖器官中表达的比较研究[J]. 中国兽医学报, 2011, 31(3): 428-432.
