长链非编码RNA HULC在胃癌患者血清表达及临床意义
2018-03-20陈跃华范钰郎亚昆
陈跃华, 范钰, 郎亚昆
胃癌在常见恶性肿瘤中排第四位,在全球恶性肿瘤死亡中居第二位[1-2]。由于缺乏早期检测的理想生物标志物,超过80%的胃癌被诊断时已为晚期[2]。胃癌发生发展的机制尚不明确,限制了其治疗[3]。因此,探寻胃癌分子靶点和新的生物标志物是胃癌研究的热点[3-4]。
长链非编码RNA(Long non-coding RNA,LncRNA)定义为>200 nt的转录物,参与许多重要的细胞过程及发病机制。据报道,LncRNA在许多类型的肿瘤中差异表达[5-6]。几项研究表明,LncRNA在血液样品中非常稳定,因此可以对血液中的LncRNA进行定量检测[7-8]。循环LncRNA作为许多癌症类型的诊断和预后分子标志物已被广泛研究,包括肺癌、结直肠癌、肝癌、乳腺癌等[9-19]。 然而,与胃癌相关的特异性RNA仍然知之甚少[9,20-21]。有研究表明,HULC可以在体外促进不同的促致癌表型[22]、体内肿瘤生长[23]和血管发生[24]。这些研究共同表明,HULC失调在肿瘤发生中起关键作用。HULC在许多癌症包括肝细胞癌[25],胃癌[22],胰腺癌[26],骨肉瘤[27]和结直肠癌肝转移中异常上调[28]。Zhao等[24]在58例胃癌和配对相邻组织中定量HULC表达的研究中发现,HULC水平在胃癌组织中明显上调。本研究旨在通过观察LncRNA HULC在胃癌患者血清中的表达与临床病理之间的关系,提高胃癌早期诊断率,有效遏制肿瘤转移和扩散。
1 资料与方法
1.1 研究对象 2012年1月至2014年12月,以江苏大学附属医院肿瘤中心未接受过手术及放化疗的90例胃癌患者(胃癌组)及90名健康志愿者(对照组)作为研究对象。本研究通过江苏大学附属医院医学伦理委员会批准,患者及健康志愿者均已签署知情同意书。
1.2 研究方法 RNA提取 试剂TriIzol购自美国Invitrogen公司。反转录PCR及定量PCR试剂购自日本TaKaRa公司,LncRNA HULC:正向引物5’-ATCTGCAAGCCAGGAAGAGTC-3’,反向引物5’-CTTGCTTGATGCTTTGGTCTGT-3’;GAPDH:正向引物5’-TGTGTTGGCGTACAGGTCTTTG-3’,反向引物5’-GGGAAATCGTGCGTGACATT AAG-3’。
取胃癌患者静脉血5 ml,移入离心管,常温静置60 min,2 h内于4 ℃,2 000 r/min离心,吸取上层血清后,加入到无RNA酶的1.5 ml微量离心管中,置于-80 ℃冰箱。同时获取患者临床及随访资料用于分析。
用本实验已获得的RNA,反转录生成cDNA。按试剂盒说明步骤进行实验。反应条件37 ℃ 15 min,85 ℃ 5 s,反应产物保存于4 ℃冰箱。参照定量PCR反应试剂盒说明书对LncRNA HULC进行检测,实时PCR反应条件为:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸15 s,共40个循环。以GAPDH作为内参照,每组样本重复3次取均值。
1.3 统计学方法 采用SPSS 22.0软件进行统计分析。分别采用Mann-Whitney检验和t检验分析比较LncRNA HULC在胃癌组和对照组血清中的表达,及LncRNA HULC在胃癌患者血清中的表达与临床病理特征之间的关系,用受试者工作特征曲线(ROC)计算并评估血清LncRNA HULC在胃癌诊断中的敏感度和特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组与对照组一般情况比较 胃癌组男62例,女28例,年龄<60岁患者47例,≥60岁43例;对照组男60例,女30例,年龄<60岁45例,≥60岁45例,两组一般情况对比性别(χ2=0.102,P=0.750)、年龄(χ2=0.089,P=0.766)差异无统计学意义,具有一定可比性。
2.2 胃癌组与对照组血清LncRNA HULC表达比较 胃癌组血清LncRNA HULC表达水平与对照组相比较高,差异有统计学意义(P<0.01,图1)。
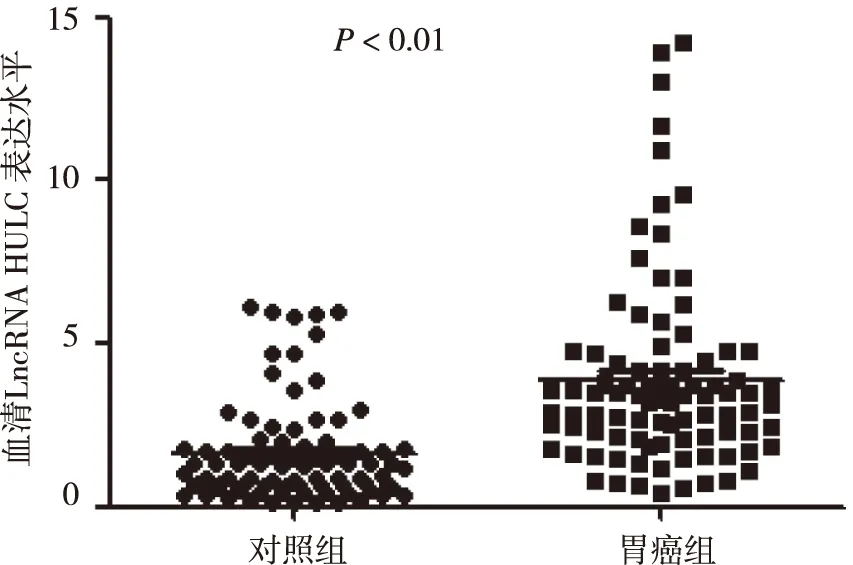
图1 血清LncRNA HULC在对照组与胃癌组中的表达
2.3 胃癌患者血清LncRNA HULC表达与临床病理之间的关系 在TNM Ⅲ、Ⅳ期以及恶性肿瘤已经有远处转移的患者中,LncRNA HULC的表达水平较高,且差异有统计学意义(P<0.05 )。进一步分析发现,LncRNA HULC和胃癌患者性别、肿瘤直径大小、年龄高低、组织分化程度、有无淋巴转移及血清CEA表达不相关,差异无统计学意义(P>0.05,表1)。
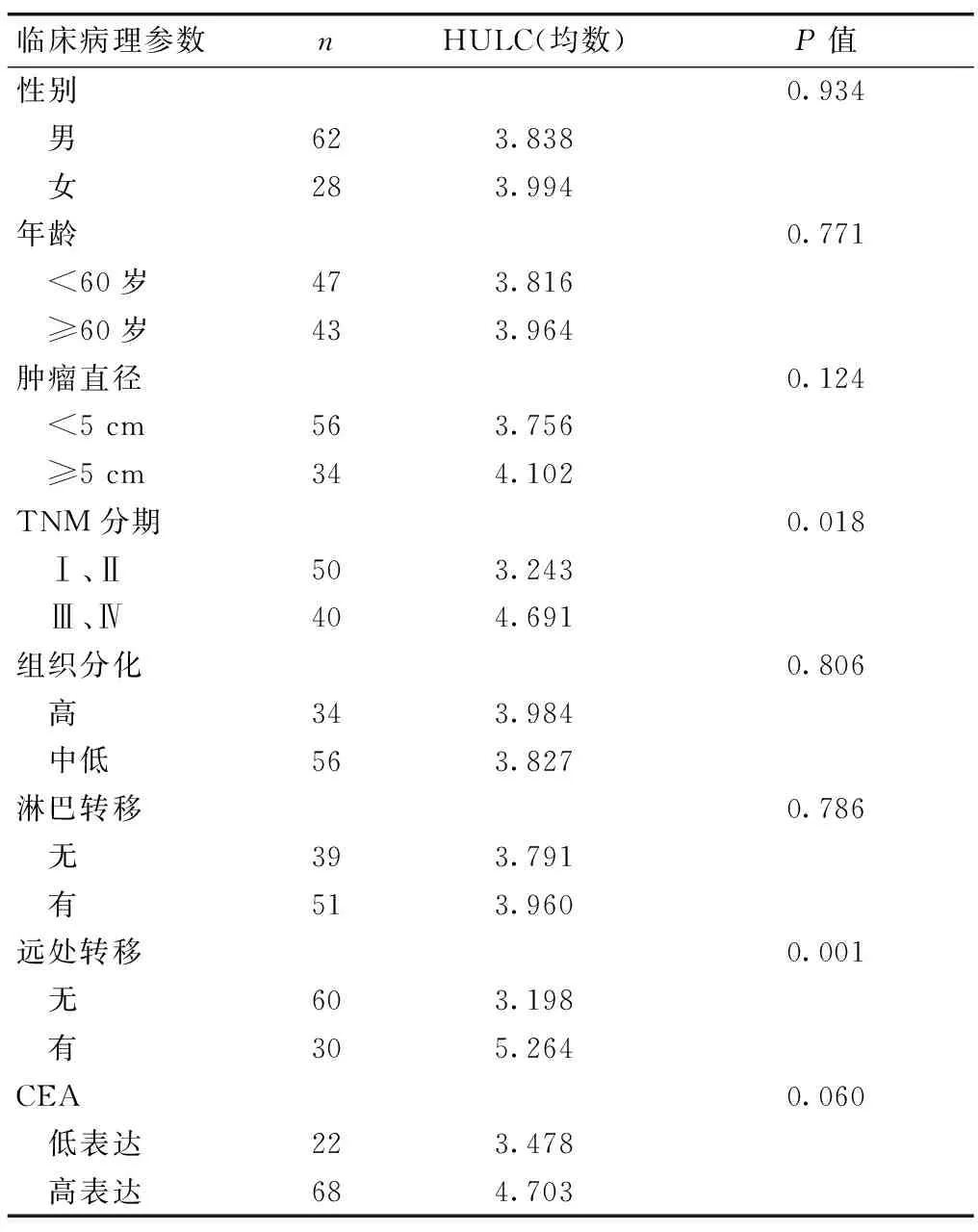
表1 胃癌临床病理与HULC表达水平之间的关系
2.4 血清LncRNA HULC诊断胃癌的可靠性 ROC曲线分析显示:血清LncRNA HULC诊断胃癌曲线下面积(AUC )为0.81。诊断胃癌的LncRNA HULC最优截断值为1.795,结果显示其灵敏度和特异度各为81.11%,75.56% (图2)。
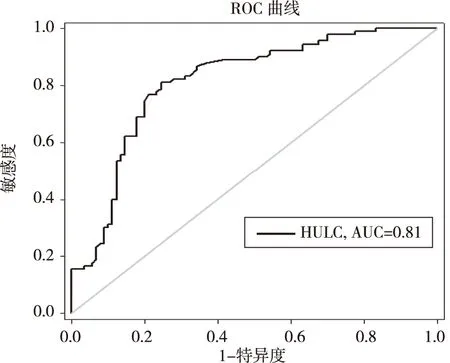
图2 LncRNA HULC诊断胃癌的ROC曲线
3 讨论
胃癌由多因素引起,包括患者体内癌基因激活、基因突变、DNA修复基因丢失等。在发展中国家,进展期胃癌的预后欠佳。因此,寻找能够影响和发现早期胃癌的良好新标志物需加快步伐。近来,研究提示LncRNA有可能作为理想的协助诊断及预后评估的生物标志物。HULC是位于染色体6p24.3上长链非编码RNA,在灵长类动物中高度保守[29]。HULC的转录产物长500个核苷酸,是拼接和聚腺苷酸化的非编码RNA,其定位于细胞质[30]。有研究表明,HULC在胃癌组织中显著上调,敲除可增加化疗药物诱导的凋亡[31]。
本研究显示,胃癌组LncRNA HULC表达量比对照组高,通过对比我们发现在TNM分期Ⅲ、Ⅳ期以及有远处转移的胃癌患者中血LncRNA HULC表达较高,且差异有统计学意义(P<0.05 )。进一步分析发现,LncRNA HULC与胃癌患者性别、肿瘤直径大小、年龄高低、组织分化程度、有无淋巴转移及CEA表达不相关(P>0.05)。ROC曲线分析显示,LncRNA HULC在胃癌诊断中的最优截断值为1.795,其灵敏度和特异度分别是81.11%,75.56%,AUC为0.81,说明LncRNA HULC在血清中的表达水平对胃癌诊断具有较好的敏感性和特异性。
本实验中观察到LncRNA HULC在胃癌血清中高表达,且取材方便,使得LncRNA HULC的血液检测成为可能,但实际应用于临床尚存在很多问题,如血清LncRNA HULC的检测是否能成为胃癌诊断的有效指标,需建立一个系统化、标准化检测体系,以及与其他肿瘤标志物能否协同作用以提高胃癌诊断率,这些有待进一步研究。
总之,对肿瘤相关LncRNAs研究仍处于初始阶段,随着研究的继续深入,血中LncRNA HULC检测有望成为胃癌诊断以及评估预后的重要指标之一。
[1] Hamashima C. Current issues and future perspectives of gastric cancer screening[J]. World J Gastroenterol, 2014,20(38):13767-13774.
[2] Liu HS, Xiao HS. MicroRNAs as potential biomarkers for gastric cancer[J]. World J Gastroenterol, 2014,20(34):12007-12017.
[3] Shao Y, Ye M, Jiang X, et al. Gastric juice long noncoding RNA used as a tumor marker for screening gastric cancer[J]. Cancer, 2014,120(21):3320-3328.
[4] Li P, Chen S, Chen H, et al. Using circular RNA as a novel type of biomarker in the screening of gastric cancer[J]. Clin Chim Acta, 2015,444:132-136.
[5] Diederichs S. The four dimensions of noncoding RNA conservation[J]. Trends in Genet, 2014, 30(4):121-123.
[6] Gutschner T , Diederichs S. The hallmarks of cancer: a long non-coding RNA point of view[J].RNA Biol, 2012, 9(6):703-719.
[7] Tsui NB, Ng EK, Lo YM. Stability of endogenous and added RNA in blood specimens, serum, and plasma[J]. Clin Chem, 2002,48(10):1647-1653.
[8] Ng EK,Tsui NB,Lau TK,et al.mRNA of placental origin is readily detectable in maternal plasma[J]. Proc Natl Acad Sci U S A,2003,100(8):4748-4753.
[9] Arita T, Ichikawa D, Konishi H, et al. Circulating long non-coding RNAs in plasma of patients with gastric cancer[J]. Anticancer Res, 2013,33(8):3185-3193.
[10] Gutschner T,Hämmerle M,Eissmann M,et al. The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J]. Cancer Res, 2013,73(3):1180-1189.
[11] Ji Q,Zhang L,Liu X,et al.Long non-coding RNA MALAT1 promotes tumour growth and metastasis in colorectal cancer through binding to SFPQ and releasing oncogene PTBP2 from SFPQ/PTBP2 complex[J].Brit J Cancer,2014,111(4):736-748.
[12] Lai MC, Yang Z, Zhou L, et al. Long non-coding RNA MALAT-1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplantation[J]. Med Oncol, 2012,29(3):1810-1816.
[13] Ren S, Liu Y, Xu W, et al. Long noncoding RNA MALAT-1 is a new potential therapeutic target for castration resistant prostate cancer[J]. J Urology, 2013, 190(6):2278-2287.
[14] Schmidt LH, Spieker T, Koschmieder S, et al. The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and induces migration and tumor growth[J]. J Thorac Oncol, 2011, 6(12):1984-1992.
[15] Wu XS,Wang XA,Wu WG,et al.MALAT1 promotes the proliferation and metastasis of gallbladder cancer cells by activating the ERK/MAPK pathway[J].Cancer Biol Ther,2014,15(6):806-814.
[16] Ying L,Chen Q,Wang Y,et al.Upregulated MALAT-1 contributes to bladder cancer cell migration by inducing epithelial-to-mesenchymal transition[J].Mol Biosyst,2012,8(9):2289-2294.
[17] Zhao Z, Chen C, Liu Y, et al. 17β-Estradiol treatment inhibits breast cell proliferation, migration and invasion by decreasing MALAT-1 RNA level[J].Biochem Biophys Res Commun,2014,445(2):388-393.
[18] Xiang-hua Liu,Zhi-li Liu,Ming Sun,et al.The long non-coding RNA HOTAIR indicates a poor prognosis and promotes metastasis in non-small cell lung cancer[J].BMC Cancer,2013,13(1):464.
[19] Ren S, Wang F, Shen J, et al. Long non-coding RNA metastasis associated in lung adenocarcinoma transcript 1 derived miniRNA as a novel plasma-based biomarker for diagnosing prostate cancer[J]. Eur J Cancer, 2013,49(13):2949-2959.
[20] Yang F, Bi J, Xue X, et al. Up-regulated long non-coding RNA H19 contributes to proliferation of gastric cancer cells[J]. FEBS J, 2012,279(17):3159-3165.
[21] Cao WJ, Wu HL, He BS, et al. Analysis of long non-coding RNA expression profiles in gastric cancer[J]. World J Gastroenterol, 2013,19(23):3658-3664.
[22] Panzitt K, Tschernatsch MM, Guelly C, et al. Characterization of HULC, a novel gene with striking up-regulation in hepatocellular carcinoma, as noncoding RNA[J]. Gastroenterology, 2007,132(1):330-342.
[23] Matouk IJ, A66asi I, Hoehherg A, et al.Highly upregulated in liver cancer noncoding RNA is overexpressed in hepatic colorectal metastasis[J].Eur J Gastro Hepatol,2009,21(6):688-692.
[24] Zhao Y, Guo Q, Chen J, et al. Role of long non-coding RNA HULC in cell proliferation, apoptosis and tumor metastasis of gastric cancer: a clinical and in vitro investigation[J]. Oncol Rep, 2014,31(1):358-364.
[25] Peng W, Gao W, Feng J. Long noncoding RNA HULC is a novel biomarker of poor prognosis in patients with pancreatic cancer[J]. Med Oncol, 2014,31(12):346.
[26] Sun XH,Yang LB,Geng XL,et al.Increased expression of IncRNA HULC indicates a poor prognosis and promotes cell metastasis in osteosarcoma[J].Int J Clin Exp Pathol,2015,8(3):2994-3000.
[27] Cui M, Xiao Z, Wang Y, et al. Long noncoding RNA HULC modulates abnormal lipid metabolism in hepatoma cells through an miR-9-mediated RXRA signaling pathway[J]. Cancer Res, 2015,75(5):846-857.
[28] Lu Z, Xiao Z, Liu F, et al. Long non-coding RNA HULC promotes tumor angiogenesis in liver cancer by up-regulating sphingosine kinase 1 (SPHK1) [J].Oncotarget,2016,7(1):241.
[29] Panzitt K, Tschernatsch MM, Guelly C, et al. Characterization of HULC, a novel gene with striking up-regulation in hepatocellular carcinoma, as noncoding RNA[J].Gastroenterology, 2007,132(1):330-342.
[30] Wang J,Liu X,Wu H,et al.CREB up-regulates long non-coding RNA, HULC expression through interaction with microRNA-372 in liver cancer[J].Nucleic Acids Res,2010,38(16):5366-5383.
[31] Zhang Y, Song X, Wang X, et al. Silencing of LncRNA HULC Enhances Chemotherapy Induced Apoptosis in Human Gastric Cancer[J]. J Med Biochem, 2016,35(2):137-143.
