“碘时钟实验”在中学化学教学中的应用初探
2018-03-19姜绍南耿志琴黄金兰
姜绍南 耿志琴 黄金兰
1“浓度、温度影响反应速率"的几个实验举例
目前正在教学中使用的江苏教育出版社出版的《高中化学必修2》讲述浓度、温度、催化剂对化学反应速率的影响时,所用的实验均为过氧化氢溶液的分解实验。在探究温度对化学反应速率的影响实验中,在室温和比室温高几十度的温度下,反应环境的温度对不使用催化剂的H2O2溶液的分解影响不明显,而且当加热H2O2溶液时,逸出的气泡中有水蒸气的干扰,无法通过观察气泡的产生速率来判断H2O2溶液的分解速率。在探究浓度对化学反应速率的影响实验中,浓度不同的H2O2溶液中使用了FeCl2溶液作为催化剂,这样同时引入了浓度和催化剂两个影响因素,增加了学生理解的难度。1991年人民教育出版社《高中化学第三册》讲述浓度、温度影响化学反应速率时,所用的实验为:不同条件下,Na2S2O2溶液与稀硫酸反应产生硫而使溶液变浑浊的时间不同。如今,一种著名的“碘时钟实验”正在被越来越多的教师应用到这一节内容的教学中来。
2“碘时钟实验”原理
本文讨论的“碘时钟实验”,采用的是过量的碘酸与亚硫酸反应,在反应后期能产生碘单质,碘与淀粉液反应瞬间变蓝,给学生一种震撼的视觉冲击。
实验反应原理如下:
反应开始时,前两个慢反应产生的I2迅速地被第三个反应(快反应)消耗掉,一开始进行的是总反应,反应式如下:
直到H2SO3全部反应完,第三个反应无法进行,这时的总反应如下:
这个总反应是由慢反应控制的,所以用淀粉液检测I2可以看到单纯改变浓度或温度对实验的影响。
3两种常见的配制及操作方法
两种配液方法所用试剂均为市场上可购买的碘酸钾、无水亚硫酸钠、可溶性淀粉以及浓硫酸等试剂。
3.1第一种方法
配成碘酸钾溶液、亚硫酸钠溶液、淀粉酸性液。
碘酸钾溶液的配制:称取0.9g碘酸钾溶于200mL蒸馏水,再稀釋至2500mL。亚硫酸钠溶液的配制:称取0.45g无水亚硫酸钠,配成2500mL溶液。淀粉酸性液的配制:称取5g可溶性淀粉,制成少量粉浆,再加入300mL沸水,搅匀后冷却至室温。将12.5mL浓硫酸配成100mL的稀硫酸,冷却至室温。冷却后,将稀硫酸与淀粉液混合,将溶液稀释为500mL。
验证浓度对反应速率的影响:取2只1000mL烧杯,1只烧杯中加入200mL碘酸钾溶液,另1只烧杯加入100mL碘酸钾溶液和100mL蒸馏水。再向2只烧杯中各加入50mL淀粉酸性液,搅匀后,同时加入200mL亚硫酸钠溶液并搅拌,立刻用电子秒表计下溶液变蓝的时间。
验证温度对反应速率的影响:可采用2个水槽水浴3种溶液,其中1个水槽盛有冰水混合物,另1个水槽盛有30℃左右的温水,视实验时的室内温度可以减少一组水浴实验。加料同上述两组的某一组相同即可,计下溶液变蓝的时间。
这个实验的缺点是:从配液开始到实验结束,药液保存时间在10h以上。因为亚硫酸钠会被氧化,特别是淀粉在酸的作用下会水解,中间产物为各种糊精及麦芽糖,最终生成葡萄糖,致淀粉失效,影响实验结果。
3.2第二种方法
配成稀的碘酸、稀的亚硫酸、淀粉液。
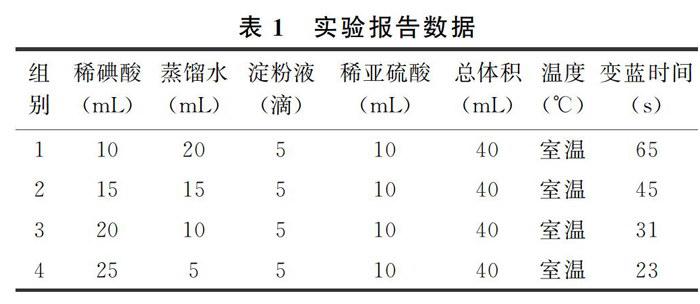
稀碘酸可用稀碘酸钾溶液与稀硫酸混合而成,稀亚硫酸可用稀亚硫酸钠溶液与稀硫酸混合而成。反应在锥形瓶中进行,按照表1中物质排列的先后次序依次添加到锥形瓶中,倒入亚硫酸时开始计时,并不停地摇动锥形瓶。实验报告数据见表1。
采用某一组加料,温度30℃时,变蓝时间为46s,温度0℃(冰水中)时,变蓝时间为87s。