维生素E和B12对冷冻精子活力和DNA的保护作用
2018-03-19郑九嘉陈霞张李雅金建远杨旭黄学锋费前进
郑九嘉,陈霞,张李雅,金建远,杨旭,黄学锋,费前进
(温州医科大学附属第一医院生殖医学中心,温州 325000)
精子冷冻技术在辅助生育技术中具有重要地位,对于某些重度少精子症患者的精子保存以及一些患者在进行可能损伤生育力的治疗(如需接受放、化疗治疗的年轻未生育患者)前进行精子冷冻保存,可使患者仍然保留自己生育的权利。因此,精子冷冻保存的研究对于生殖医学的发展具有重要意义[1]。
利用超低温保存精子时,在冷冻和复苏过程中细胞内冰晶的形成和溶液效应造成对精子的损伤,最为明显的是精子解冻后的复苏率和活动力下降。由于在冻融过程中会引起精子头部浆膜广泛肿胀、破损,精子膜结构不完整率增加,在胞内产生的过量活性氧(ROS)易导致精子DNA、蛋白质以及膜损伤等[2-4]。同时,精子在低温保存时精浆对精子的保护能力非常有限,因此有必要在冻融过程中通过添加外界有效的物质来保护精子。维生素E(Vit E)是机体中重要的抗氧化剂,其能抑制细胞内一系列ROS的形成,减少和消除ROS对精子的不良作用。Ball等[5]和罗海玲等[6]在马和羊的精液中添加Vit E后低温保存,与不添加Vit E的对照组相比,添加Vit E后的精子具有较高的活力和顶体完整率。Vit B12是另一种相对重要的维生素类物质,是目前发现的唯一含有金属钴元素的维生素,钴能够减少组织的耗氧量,从而提高机体对氧的耐受性,增加机体组织在缺氧环境中的活力。有研究发现,Vit B12作为一种生理活性物质,还具有改善精子外在环境,改进精子活力等作用[7]。本研究主要通过在精子冷冻保护剂中添加适当浓度的Vit E和B12,探索其对精子的冷冻保护作用,为精子的长期有效保存提供一定的理论基础,也为辅助生殖治疗中精子的质量提供保障。
资料与方法
一、研究对象
收集在本中心进行健康体检的32例正常男性志愿者精液标本,所有受试者均知情同意并签署知情同意书。受试者禁欲3~5 d,手淫法收集精液标本。所有入选男性经检查未发现睾丸、染色体、激素水平等异常,同时排除细菌、支原体、衣原体感染等可能影响精子质量的因素,排除器质性及功能性不育患者。
二、研究分组
选取无白细胞污染,精子浓度>50×106/ml且a+b级≥50%的正常标本32例,每1例精液标本分为3份,按添加维生素(添加剂量参照之前文献[8-9])的不同分为3组:对照组:精液中只添加常规冷冻保护剂;Vit E组:精液中添加常规冷冻保护剂和10 mM的Vit E[8];Vit B12组:精液中添加常规冷冻保护剂和1.0%的Vit B12[9]。
三、主要方法
1.精子浓度及活动力检测:收集到的精液标本在37℃ 20~30 min完全液化后按世界卫生组织《人类精液及精子宫颈黏液相互作用实验室检验手册》(第5版)行精液常规检查,采用西班牙MLCRORTICS.L公司的计算机辅助精子自动分析系统(SCA2002)检测精子浓度和活动力指标。
2.配制含Vit E、B12的精子冷冻保护液:1.5 g葡萄糖、1.3 g柠檬酸三钠二水加灭菌水至65 ml,加入15 ml甘油和1.3 g甘氨酸,完全溶解后用0.45 μm微孔滤器过滤,加入20 ml新鲜卵黄制成悬浮液,分别添加10 mM Vit E和1.0% Vit B12后于56℃水浴灭活40 min,调整pH至6.8~7.2,在超净台中将溶液以2 ml为单位分装成对照组、Vit E组、Vit B12组,-80℃保存备用。所有试剂均购自美国Sigma公司。
3.精子冷冻及解冻:精子冷冻:冷冻保护剂与精液按1:1混合(Vit E终浓度为5 mM,Vit B12终浓度为0.5%)。室温平衡10 min,4℃冰箱放置30 min,-20℃冰箱30 min,-80℃冰箱30 min,最后投入液氮(-196℃)保存72 h后复苏。精子解冻:将液氮中的精液标本取出后立即投入37℃水浴,使之迅速复温解冻。
4.检测精子存活率:按照世界卫生组织《人类精液及精子宫颈黏液相互作用实验室检验手册》(第5版)[10]推荐的伊红Y染色法检测精子存活率。
5.精子染色质扩散(SCD)法检测精子DNA完整性:SCD检测采用Halosperm试剂盒(Halotech DNA SL,西班牙),按试剂盒说明书步骤操作,简要步骤如下:精液标本调浓度为1×107/ml,60 μl加入溶解的低熔点琼脂糖凝胶混匀,取20 μl精子凝胶混合液于预处理载玻片上,4℃冰箱水平放置5 min。酸性DNA变性液中室温避光孵育7 min,避光裂解23 min;去残余裂解液后依次在70%、90%和100%乙醇中各脱水2 min。晾干后染色10~15 min。400倍光镜下观察,比较精子核和核周围晕轮大小,评价精子DNA碎片率(SDF)。
精子DNA损伤标准:根据晕轮直径与精子头部横径的比例不同,分为大、中、小和无晕轮4个等级:晕轮直径/精子头横径≥2/3为大晕轮;1/4 <晕轮直径/精子头横径<2/3为中晕轮;晕轮直径/精子头横径≤1/4为小晕轮;观察不到晕轮为无晕轮。大和中晕轮表示精子DNA完整无损伤;小和无晕轮表示精子DNA有一定程度损伤。
精子DNA晕轮直径测量:400倍光镜下不同视野随即选取50条精子,在显微测量尺下测量每条精子的晕轮直径,计算平均晕轮直径。
6.精子顶体酶活性检测:使用深圳华康生物医学工程有限公司的顶体酶试剂盒进行检测,严格按照试剂盒说明书进行操作。正常精子顶体酶活性为48.2~218.7 μIU/106/精子。
四、统计学处理
结 果
一、添加Vit E和B12对冷冻复苏后精子活动力和存活率的影响
在液氮中冷冻保存72 h的精液标本取出后立即于37℃水浴复苏,分别比较添加Vit E和Vit B12对精子活动力、存活率及顶体酶活性的影响,发现Vit E组(a+b)%精子数和精子存活率显著高于对照组(P<0.05),d%精子数显著低于对照组(P<0.01);Vit B12组的(a+b)%精子数和精子存活率有高于对照组的趋势,但无显著性差异(P>0.05)(表1)。

表1 3组精子复苏后精子活动力和存活率比较(-±s)
注:与对照组比较,*P<0.05,**P<0.01
二、添加Vit E和B12对冷冻复苏后精子顶体酶活性的影响
比较3组精子顶体酶活性发现,Vit E组顶体酶活性为(101.8±4.5)μIU/106/精子,Vit B12组为(101.7±4.80)μIU/106/精子,虽然都稍高于对照组的(99.38±4.57)μIU/106/精子,但组间比较无显著性差异(P>0.05)(图1)。
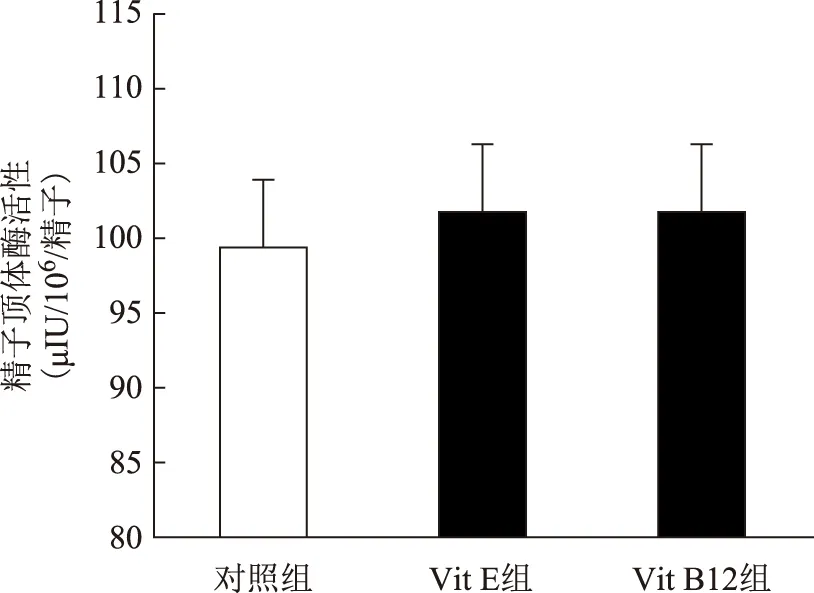
图1 3组精子顶体酶活性的比较
三、添加Vit E和B12对冷冻复苏后SDF的影响
Vit E组和Vit B12组的SDF均显著低于对照组(P<0.01),Vit E组和Vit B12组中代表精子DNA完整性的大晕轮精子百分数也显著高于对照组(P<0.01),而代表精子DNA发生损伤的小晕轮精子百分数在Vit E和Vit B12组中显著低于对照组(P<0.05)(表2)。
显微测量尺下随机测量精子DNA的晕轮直径见图2,Vit E组的精子晕轮平均直径[(6.76±0.14)μm]显著高于对照组[(6.09±0.18)μm](P<0.01),Vit B12组与对照组比较则无显著性差异(P>0.05)(表2)。
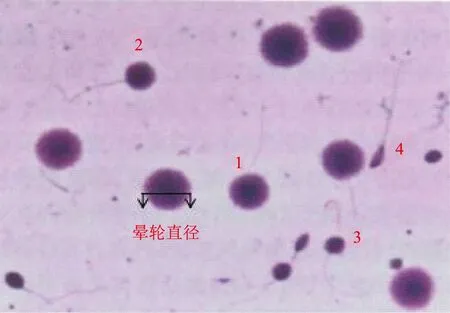
1:大晕轮精子;2:中晕轮精子;3:小晕轮精子;4:无晕轮精子图2 精子DNA扩散实验
讨 论
精子冷冻保存技术发展至今已有200多年的历史,近年来国内外研究均发现,影响人类精子冻融前后效果的主要因素有冷冻方法、冷冻保护剂的成分及冻存时间等[11]。研究表明,经过冷冻解冻处理后精子活动力、复苏率、顶体酶活性均会受到不同程度的影响,并且会加剧精子DNA损伤,导致精子冻融后质量及受精率的降低[12-13],这一直是困扰精子受精能力的一个重要问题。精子在冷冻和解冻过程中形成冰晶、产生过量ROS以及精子细胞膜的过氧化反应都会对精子活动力、复苏率、畸形率、DNA完整性和精卵融合造成不利影响。因此,要提高冷冻精子的能量代谢,获得较高的精子复苏率和活动力,必须保护细胞膜的完整和通透性的稳定,这是防止精子冷冻损伤的重要环节。

表2 3组精子复苏后SDF及晕轮情况的比较(-±s)
注:与对照组比较,*P<0.05,**P<0.01
目前普遍认为,精子细胞的凋亡[14]及氧自由基的过量产生[15]是影响精子常规参数和DNA损伤的主要因素。同时,精子DNA被认为是评价精子功能的一项重要指标,精子DNA损伤加剧会降低体外受精中的精子受精能力和胚胎发育潜能,降低临床妊娠率和增高流产率[16]。精子在冷冻和解冻过程中冰晶的形成会引起细胞结构和功能发生改变,并且该过程中大量ROS的产生使精子细胞膜发生过氧化反应以及对精子DNA完整性造成严重的破坏。目前观点认为,在精子冷冻保护剂中添加适当浓度的维生素可有效减少ROS对精子的不良作用,一些研究也已经证实了这个观点[17-18]。
Vit E对浆膜的磷脂有着特殊的亲和性,能预防或阻止脂质过氧化,使过氧化脂质无法生成,防止精子细胞膜氧化反应的发生,保护精子膜的功能,从而提高精子冷冻后的复苏率及活动力[17]。一些研究已经证实,通过在精子冷冻保护液中添加Vit E,可使解冻后的精子活动力及DNA损伤得到显著改善[19]。相对于Vit E在精子冷冻方面的研究,Vit B12在精子冷冻保护方面的研究相对较少。Neild等[20]研究发现,含Vit B12的精浆中谷草转氨酶(GOT)释放量明显下降,这可能是提高精子活动力的一个重要因素,因为在冷冻和解冻过程中,精子中的GOT会释放出来,从而导致精子的顶体肿胀和损坏,影响精子功能。迄今为止,国内外对Vit B12在人类精子冷冻保护中的作用研究相对较少,仅见一些学者在动物精子冷冻方面的研究,在动物研究中已发现Vit B12对精子冷冻确实有一定的保护作用,在精子冷冻保护液中添加Vit B12,具有维持精子顶体完整率、延长精子体外存活时间和提高解冻后精子活动力的作用[21-22]。
目前,维生素类物质对精子冷冻保护作用主要集中在动物精子的研究以及畜牧业中的应用,在人类精子冷冻保护方面的研究相对较少;同时,在众多的精子抗氧化冷冻保护剂中维生素的毒副作用相对较小。因此,维生素在精子冷冻保护中的应用研究具有一定前景,对于提高辅助生殖中的精子受精率也有非常重要的意义。本研究分析在精子冷冻保护剂中分别添加适当浓度的Vit E和Vit B12,液氮冻存72 h后复苏精子的活动力、存活率及SDF等各项指标变化,结果显示,Vit E能显著改善复苏后精子活动力、存活率及DNA完整性;而对于精子顶体酶活性的改善不是很明显,其原因可能是各组精子均在液氮超低温环境下保存,而酶主要是由蛋白质构成,超低温环境对蛋白质的空间结构及活性本身就有很好的保护作用,因此对酶的活性影响较少,单纯从顶体酶活性的角度考虑可能无太大差异;而添加Vit B12仅在改善精子DNA完整性方面有较明显效果,我们推测这与人类精子中的GOT释放及顶体结构和功能与动物精子存在一定的差异有关;另一方面,本研究纳入样本数较少可能也对研究结果存在一定的影响。
通过本研究,我们初步得出在精子冷冻保护剂中添加适当浓度的Vit E可以缓解冻融过程对精子造成的伤害,在一定程度上提高冻融后精子活动力、存活率及精子DNA完整性;虽然Vit B12组的精子活动力、存活率等指标略高于对照组但组间比较无显著性差异,提示Vit B12在精子冷冻保护方面的作用尚不明显。后续,我们将在以上结论的基础上继续探索Vit E和Vit B12对人类精子冷冻和复苏过程的保护作用,尤其是对弱精子症患者冻融后线粒体呼吸和氧化磷酸化功能的研究,为精子的长期有效保存提供一定的理论基础,也为实施辅助生殖精子的质量提供保障。
[1] 滕若冰. 人类精子冷冻保存的回顾与思考[J]. 医学与哲学,2010,31:39-41.
[2] 王尚乾,王巍. 人类精子冷冻损伤及保护的研究进展[J]. 中华男科学杂志, 2013,19:262-265.
[3] Karimfar MH,Niazvand F,Haghani K,et al. The protective effects of melatonin against cryopreservation-induced oxidative stress in human sperm[J]. Int J Immunopathol Pharmacol,2015,28:69-76.
[5] Ball BA,Medina V,Gravance CG,et al. Effect of antionxidants on presernation of motity,viability and acrosomal integrity of equine spermatozoa during storage at 5 degrees C[J]. Theriogenology,2001,56:577-589.
[6] 罗海玲,贾志海,朱士恩,等. 稀释液中添加维生素E对绵羊冷冻精液品质的影响[J].中国畜牧杂志,2004,40:7-9.
[7] 孙淑琴,蔡吉光,王立阁,等. 稀释液中添加不同浓度的维生素B12对牛精子活力的影响[J]. 吉林畜牧兽医,2003,(1):2-3.
[8] 陈娟,项兰兰,孙慧谨. 精液中维生素 B12和叶酸浓度与精液参数的相关性分析[J]. 检验医学与临床,2014,11:780-781.
[9] Kalthur G,Raj S,Thiyagarajan A,et al. Vitamin E supplementation in semen-freezing medium improves the motility and protects sperm from freeze-thaw-induced DNA damage[J]. Fertil Steril,2011,95:1149-1151.
[10] 世界卫生组织. 人类精液检查与处理实验室手册. 第五版.北京:人民卫生出版社,2010:20-25.
[11] 曹文雷. 精液冷冻研究进展及其与辅助生育技术的关系[J]. 中华男科学,2003,9:61-63.
[12] 许观照,张丽红,王时灿,等. 精子冻存技术及上游法精子处理技术对精子DNA完整性的影响[J]. 生殖医学杂志,2013,22:945-950.
[13] 何瑞冰,姜宏,汪存利,等. 精子DNA完整性与体外受精-胚胎移植临床结局的相关性研究[J]. 生殖医学杂志,2010,19:498-501.
[14] Huang CC,Lin DP,Tsao HM,et al. Sperm DNA fragmentation negatively correlates with velocity and fertilization rates but might not affect pregnancy rates[J]. Fertil Steril,2005,84:130-140.
[15] Mahfouz R,Sharma R,Thiyagarajan A,et al. Semen characteristics and sperm DNA fragmentation in infertile men with low and high levels of seminal reactive oxygen species[J]. Fertil Steril,2010,94:2141-2146.
[16] Evenson DP,Wixon R. Clinical aspects of sperm DNA fragmentation detection and male infertility[J]. Theriogenology,2006,65:979-991.
[17] Ollero M,Perez-Pe R,Muio-Blanco T,et al. Improvement of ram sperm cryopreservation protocols assessed by sperm quality parameters and heterogeneity analysis[J]. Cryobiology,1998,37:1-12.
[18] 郭学东,张丽娟,冯立国. 添加维生素B12对西门塔尔牛冷冻精液品质影响的初步观察[J]. 黑龙江动物繁殖,2011,19:50-51.
[19] Kalthur G,Raj S,Thiyagarajan A,et al. Vitamin E supplementation in semen-freezing medium improves the motility and protects sperm from freeze-thaw-induced DNA damage[J]. Fertil Steril, 2011,95:1149-1151.
[20] Neild DM,Gadella BM,Chaves MG,et al. Membrane changes during different stages of a freeze-thaw protocol for equine semen cryopreservation[J].Theriogenology,2003,59:1693-1705.
[21] 张磊,薛金果,李文芹. 维生素B12与柠檬酸三钠对波尔山羊精液品质及受胎率的影响[J].中国草食动物,2003,23:20-21.
[22] 张培松,周玉香,徐振鑫. 不同比例维生素B12稀释液对小尾寒羊精子存活时间的影响[J]. 黑龙江畜牧兽医,2003,(8):28-29.
