添加外源草酸青霉菌对污染土中砷形态及浓度的影响
2018-03-19郭玉炜季志强张亚莉
郭玉炜,季志强,张亚莉
(1.承德市农林科学院,河北承德 067000;2.廊坊职业技术学院,河北廊坊 065000)
砷(arsenic),元素符号 As,是变价元素,是全球公认的最重要的环境毒物之一,具有显著的内分泌干扰效应[1],能在植物、动物体内富集,并最终通过食物链危害人体健康[2-4]。自然界中砷可以以0价(As),-3 价(如 AsH3),+3 价(如砒霜 As2O3)和 +5价(Na3AsO4)存在。一般在土壤环境中多以+3和+5价存在。As(III)是毒性很强的原生质毒物,毒性强于As(V),被美国疾病控制中心(CDC)和国际防癌研究机构(IARC)确定为第一类致癌物[5-7]。因其特殊的类金属性和韧性[8],砷主要用于与铜、铅及其他金属形成合金。此外,砷的化合物还广泛用于制造防腐剂、染料、农药和医药等[9]。地壳中砷的含量为1.5~2.0 mg/kg,是其他元素的21倍。土壤中砷的本底值在0.2~40 mg/kg,而受砷污染土壤的含砷量在550 mg/kg。目前在环境介质中,全世界已经发现了大约40多种不同形态的砷。其中,无机砷包括亚砷酸(盐)(As(III))和砷酸(盐)(As(V));有机砷有单甲基砷酸(盐)(MMA(V))和二甲基砷酸(盐)(DMA(III))[10]。无机砷的毒性明显高于有机砷,即其毒性顺序为:As(III)>As(V)>MMA(V)>DMA(III)。
随着社会经济和工业的发展,全球许多国家面临严重的砷污染威胁。砷污染已成为人们普遍关注的环境污染问题之一。据统计,在美国国家环保局超级基金计划的污染场地中,有41%的污染场地存在砷污染问题[11]。在澳大利亚,共有超过10 000多个土壤砷污染场地[12]。在印巴次大陆的孟加拉国,以含砷地下水浇灌的水稻田中土壤平均砷含量高达101 mg/kg,是国际标准的4倍[13]。我国也是受砷污染最为严重的国家之一,新疆、内蒙古、陕西、湖南、云南、贵州、广西、广东、台湾等省区的砷污染均比较严重。环境中的砷污染导致作物产量降低及质量和品质下降,直接威胁到人畜健康[9]。在一些污染土壤中,砷浓度可能超过2 000 mg/kg[14]。植物和动物体内积累的砷最终会通过食物链传递到人体内,对人类的身体健康构成威胁,因此,在一些国家,还规定牲畜饲料中砷的含量不能高于0.2 mg/kg[15]。因而,如何有效地控制及治理土壤重金属的污染,改良土壤质量,将成为生态环境保护工作中十分重要的一项内容[16]。
砷污染土壤和水体的修复一直受到众多研究者的关注。目前,传统的物理修复和化学修复技术已取得一定成效,并形成了部分成熟的工艺流程。对于砷污染土壤的修复传统方法主要采用固定技术。对水体则主要采用膜分离、离子交换、凝聚沉淀等化学方法去除砷[17]。这些方法工程量大、投资费用高、同时还可能导致二次污染。目前,已经有研究者开发了多种除砷材料和除砷技术,如改性蒙脱石、铁铈复合氧化物材料、蜈蚣草的离体叶片等等。然而,对于微生物的代谢作用对砷的总量和各个砷形态浓度的影响却鲜见报道。
微生物修复是利用微生物,如细菌、真菌、放线菌和原生动物的生命代谢活动富集、分解或清除生长介质中的污染物。近年来,微生物修复技术因其环境友好型和低投入等优点得到迅速发展。大量高效降解菌株被筛选和研究,这给利用生物修复技术进行污染修复带来了活力与希望[18]。微生物是自然界中形体微小、单细胞或个体结构简单的多细胞,甚至无细胞结构的低等生物的通称。作为土壤中重要的活性胶体组分,微生物数量众多,比表面积大,带电荷多,且代谢旺盛。同时,土壤中的微生物与重金属(砷)间存在吸收和富集、溶解和沉淀、氧化和还原等作用的动态平衡。这对重金属包括砷的化学行为和生物有效性都会产生深刻的影响。目前对真菌的可利用性及其对溶液中砷行为影响的研究非常薄弱,对于真菌对转化砷形态以及降低土壤中的砷毒性的研究更是少之又少。微生物修复是生物修复技术的核心技术,在污染物治理,尤其是有机污染物的降解转化及水体污染修复方面展现了广阔的前景。虽然生物修复作为环境友好型的治理技术深得人心,但它本身也存在还未克服的问题。随着科学技术的发展和人类环保意识的提高,对环境污染认识的深入让人们对污染修复也提出了更高的要求。
本试验以外源真菌草酸青霉加入砷污染土壤中对砷形态转化为对象,探讨并比较了在灭菌和不灭菌2种条件下草酸青霉对砷形态转化的效果,为研究特定外源真菌在解决实际土壤砷污染问题的可行性方面提供理论依据,并为修复土壤砷污染提供数据支持。
1 材料和方法
1.1 材料
供试真菌为草酸青霉,它是一种能够分解纤维素的真菌;供试土壤采自河北省某一污灌水稻种植区,土壤的基本理化性质:pH值(H2O浸提,水土比为2.5∶1)7.72,有机质含量 9.82 g/kg,总铁 26.94 g/kg,碱解氮49.85 mg/kg,速效磷12.85 mg/kg,总砷含量83.4 mg/kg。
1.2 仪器与用具
生化培养箱(培养温度27℃,遮光培养)、烧杯(50,100,200,400,1 000 mL)、容量瓶(50,100,200,400,1 000 mL)、塑料杯、土壤溶液提取器、注射器、离心管、分光光度计、原子荧光仪。
1.3 试验设计
试验共设4个处理,分别为:(1)灭菌加菌种(灭菌+菌种),将培养钵中的含砷污染土用高温高压(0.15 MPa,121℃)灭菌,并将灭菌后的土壤冷却至室温,在实验室无菌的超净工作台中接种草酸青霉。(2)灭菌不加菌种(灭菌-菌种),将培养钵中的含砷污染土用高温高压(0.15 MPa,121℃)灭菌,直接冷却至室温不加菌种。(3)不灭菌加菌种(不灭菌+菌种),将培养钵中的含砷污染土在无菌条件下接种草酸青霉。(4)不灭菌不加菌种(不灭菌-菌种),将培养钵中的含砷污染土不做任何处理,放置待用。每个处理设置3个重复,共12个培养钵。
1.4 菌悬液的制备
配制200 mL液体培养基,取100只250 mL三角瓶进行灭菌,另取20只50 mL三角瓶进行灭菌。将菌种接种到上述灭菌后的50 mL三角瓶中,在摇床(30℃,108 r/min)振荡 1 d,取 5 mL培养基加入到上述250 mL三角瓶中,摇床(30℃,108 r/min)振荡3 d,完成菌悬液的制备。每200 g土加入0.6 mL该真菌菌悬液。
用锡箔纸将放好土壤的塑料杯盖好,分别标记灭菌加菌种、灭菌不加菌种、不灭菌加菌种、不灭菌不加菌种,重复处理按1,2,3进行标记。把标记好的杯子按顺序放入无菌的超净工作台中,把需要灭菌处理的取下锡箔纸,用接种棒进行接种。接种过程中要保证操作者和实验台都是无菌的。
1.5 试验方法
用蒸馏水洗净塑料杯,并用现制的超纯水再次清洗后自然晾干。每个杯子称取200 g土样,将称好的土样分别装于12个杯中。
按1.4的步骤进行灭菌和添加草酸青霉处理。浇超纯水使杯子中的土保持淹水状态,每个杯子的水液面高度保持一致,放入培养箱进行避光培养。将培养箱的温度设置为27℃。每个杯子埋入土壤溶液提取器,保证插入相同的深度(提取器白色部分要完全埋入土中)。
取样时,用10 mL注射器抽取土壤溶液,过孔径0.45 μm滤膜,注入10 mL离心管中,每个离心管加入50μL6mol/L优级纯盐酸,摇匀后放入-4℃冰箱冷藏待测。每月抽一次土壤溶液,记录开始培养的时间和每次取样时间。
1.6 测定方法
采用高效液相色谱与电感耦合等离子体质谱联用法(HPLC-ICP-MS)进行砷形态的测定,具体测定条件参数如下。
1.6.1 高效液相色谱HPLC 流动相为0.01 mol/L(NH4)2HPO4,0.01 mol/LNH4NO3,pH 值 6.2;流速为1 mL/min;进样体积为 20 μL。
1.6.2 电感耦合等离子体质谱仪ICP-MS 等离子功率为1 500 W;载气流量为0.9 L/min;补偿气流量为0.25L/min;进样深度为8mm;蠕动泵速为0.1rps;预混室(雾化室)温度为2℃。
1.7 数据分析
使用统计软件SPSS 11.5和Excel对试验数据进行方差分析以及多重比较。
2 结果与分析
2.1 土壤溶液中存在的砷形态
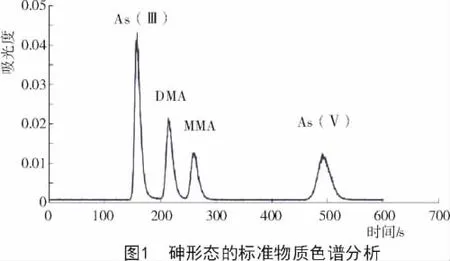
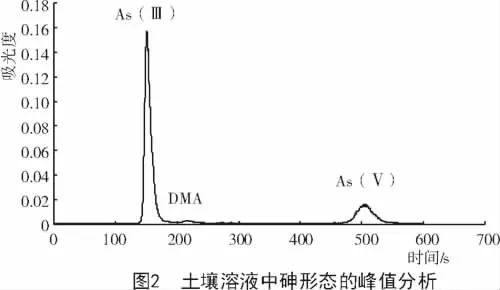
从图1可以看出,As(Ⅲ),DMA,MMA和As(Ⅴ)的出峰时间分别是160.157,211.160,267.262,459.541 s。土壤溶液中砷形态的一个峰如图2所示,由此可确定,土壤溶液中存在 As(III),As(V),DMA等3种砷形态,并未检测到MMA。
2.2 草酸青霉对灭菌/不灭菌土壤中不同砷形态质量浓度的影响
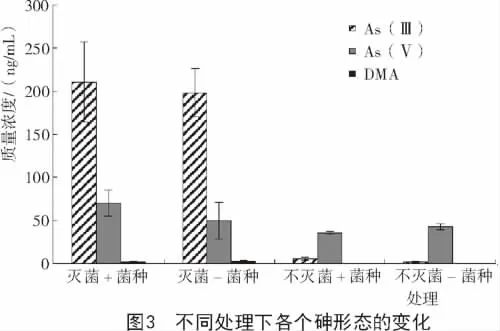
从图3可以看出,在灭菌的2种处理下,As(Ⅲ),As(Ⅴ)和DMA均可以被检测到,并且As(Ⅲ)为主要形态;不灭菌的2种处理下,均检测不到DMA,只能检测到 As(Ⅲ),As(Ⅴ),并且 As(Ⅴ)为主要形态。本研究从以下几方面对各个砷形态的浓度变化分别进行分析。
2.2.1 草酸青霉对灭菌/不灭菌土壤中As(Ⅲ)质量浓度的影响 由图4可知,不论土壤中是否加菌种,灭菌处理下土壤溶液中As(Ⅲ)质量浓度高于不灭菌处理下As(Ⅲ)质量浓度,其质量浓度从高到低排序为灭菌+菌种(210.7 ng/mL)>灭菌-菌种(198.1 ng/mL)>不灭菌+菌种(5.3 ng/mL)>不灭菌-菌种(2.2 ng/mL)。这可能由于土壤溶液中后来存在某种微生物,能够在淹水环境下参与砷的还原。在灭菌条件下,微生物的数量和种类相对于不灭菌条件下要少,因此,竞争作用要小。不灭菌处理下,土壤中由于微生物之间存在营养和其他方面的竞争,不利于该种微生物生存,砷主要以氧化态存在;而在灭菌土壤溶液中,其他微生物的竞争作用相对较小,该种微生物便可以参与土壤溶液中As(Ⅴ)的还原,导致灭菌处理土壤溶液中As(Ⅲ)质量浓度高于不灭菌处理土壤溶液中As(Ⅲ)质量浓度。还有可能是不灭菌处理条件下存在某种微生物可以参与砷的氧化,使As(Ⅲ)转化为As(Ⅴ)。灭菌处理使土壤溶液中的该种微生物数量和种类减少,因此,氧化能力变弱,使灭菌处理下的As(Ⅲ)质量浓度高于不灭菌条件下的As(Ⅲ)质量浓度。

在灭菌处理的土壤溶液中,加菌种的As(Ⅲ)质量浓度略高于不加菌种条件下的As(Ⅲ)质量浓度,并且2个处理下As(Ⅲ)质量浓度都很高。2个处理下的As(Ⅲ)质量浓度很接近,说明在灭菌的条件下是否加入外源菌种草酸青霉对土壤溶液中的As(Ⅲ)质量浓度影响很小。
在不灭菌处理的土壤溶液中,加菌种的As(Ⅲ)质量浓度略高于不加菌种的条件下As(Ⅲ)质量浓度,并且2个处理下的As(Ⅲ)质量浓度都很低。2个处理下的As(Ⅲ)质量浓度也很接近,说明在不灭菌的条件下,是否加入菌种对土壤溶液中As(Ⅲ)质量浓度的影响很小。
2.2.2 草酸青霉对灭菌/不灭菌土壤中As(Ⅴ)质量浓度的影响 从图5可以看出,不论土壤中是否加菌种,灭菌处理下土壤溶液中As(Ⅴ)质量浓度高于不灭菌处理下As(Ⅴ)质量浓度,其质量浓度从高到低排序为灭菌+菌种(70.4 ng/mL)>灭菌-菌种(49.5 ng/mL)>不灭菌-菌种(42.5 ng/mL)>不灭菌+菌种(35.6ng/mL)。并且4种处理下As(Ⅴ)的质量浓度差异相对于As(Ⅲ)质量浓度的差异显得很小。
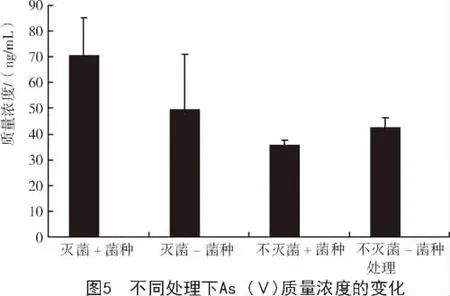
在灭菌处理的土壤溶液中,加菌种的As(Ⅴ)质量浓度高于不加菌种的土壤溶液中的As(Ⅴ)质量浓度。并且由于在灭菌处理的土壤溶液中,加菌种的As(Ⅲ)质量浓度同样高于不加菌种的土壤溶液中的As(Ⅲ)质量浓度。因此,可推测在灭菌的处理下,菌种的加入可能对于无机砷形态的土壤固定产生影响。
在不灭菌处理的土壤溶液中,加菌种的处理下As(Ⅴ)质量浓度低于不加菌种的As(Ⅴ)质量浓度。这可能是由于在不灭菌的土壤溶液中,草酸青霉的加入影响了无机砷形态的甲基化,使有机形态砷的质量浓度升高;又有可能是在不灭菌处理下,菌种的加入促进了上述具有砷还原能力的微生物的生长。不灭菌处理下,草酸青霉加入使该种微生物生长相对较好,将As(Ⅴ)还原为As(Ⅲ)。因此,在不灭菌的处理下,加菌种反而使土壤溶液中的As(Ⅴ)质量浓度低于不加菌种时土壤溶液中的As(Ⅴ)质量浓度。
2.2.3 草酸青霉对灭菌/不灭菌土壤中DMA质量浓度的影响 从图6可以看出,不论土壤中是否加菌种,灭菌处理下土壤溶液中DMA质量浓度高于不灭菌处理下DMA质量浓度,其质量浓度从高到低排序为灭菌-菌种(2.875 ng/mL)>灭菌+菌种(1.894 ng/mL)>不灭菌-菌种(忽略不计)>不灭菌+菌种(忽略不计)。这可能是由于在淹水条件下灭菌处理后的土壤中砷的生物甲基化作用强于不灭菌土壤中砷的生物甲基化作用。并且这种生物甲基化作用的微生物在灭菌条件下由于微生物之间竞争压力小,因此,生存能力、代谢能力较强,使土壤溶液中的DMA质量浓度较高,这也大大降低了土壤中砷的毒性。
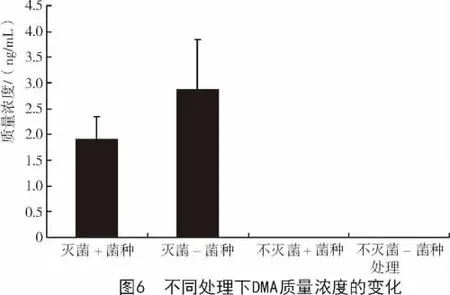
在灭菌处理的土壤溶液中,不加菌种的DMA质量浓度高于加菌种的土壤溶液中的DMA质量浓度。这可能是由于在淹水条件下,灭菌处理时,不加菌种的土壤中砷的生物甲基化作用强于加菌种的土壤中的砷的生物甲基化作用。其可能是由于这种能将砷甲基化的微生物在加入草酸青霉时由于竞争作用的增加导致该种微生物数量减少,代谢作用降低,因此,施加菌种时土壤溶液中的DMA质量浓度低于不加菌种的土壤溶液中的DMA质量浓度。
在不灭菌的土壤溶液中,不加菌种的DMA质量浓度和加菌种的土壤溶液中的DMA质量浓度都很低,可以忽略不计。说明在不灭菌的处理下,土壤中砷的生物甲基化作用很弱。这可能是由于在不灭菌时,土壤中的微生物种类和数量相对灭菌条件下的多,导致微生物之间的竞争压力过大,因此,具有砷的生物甲基化的微生物活性降低,使不灭菌的土壤溶液中,无论是否加入菌种,DMA质量浓度都可以忽略不计。
2.3 草酸青霉对灭菌/不灭菌土壤中总砷质量浓度的影响
由图7可知,不论土壤中是否加菌种,灭菌处理下土壤溶液中的总砷质量浓度高于不灭菌处理下总砷质量浓度,其质量浓度从高到低排序为灭菌-菌种(284.4 ng/mL)>灭菌+菌种(283.1 ng/mL)>不灭菌+菌种(53.1 ng/mL)>不灭菌-菌种(48.7 ng/mL)。并且无论是否加菌种,灭菌处理下土壤溶液中的总砷质量浓度与不灭菌处理下的总砷质量浓度都差距在200 ng/mL以上。这大大降低了土壤溶液中的总砷质量浓度,降低了土壤溶液中的砷毒性。这可能是由于灭菌处理后土壤中的砷被土壤胶体吸附,故土壤溶液中的砷质量浓度降低。
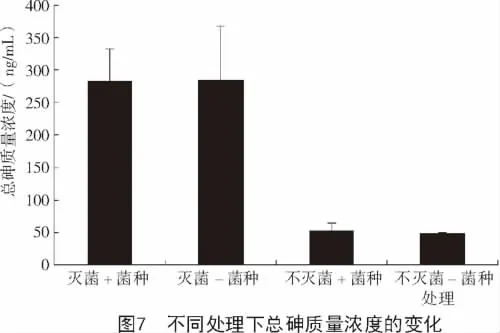
在灭菌处理的土壤溶液中,加菌种处理下的总砷质量浓度和不加菌种处理下的总砷质量浓度差别很小,且总砷含量都很高。这可能是由于在土壤淹水的条件下,在灭菌时,土壤中的砷主要以移动性强的无机砷形态存在,故在不灭菌时土壤溶液可测的总砷质量浓度较高。
在不灭菌的土壤溶液中,加菌种处理下的总砷质量浓度和不加菌种处理下的总砷质量浓度差别也很小,并且总砷质量浓度都维持在较低的水平。这可能是由于在不灭菌时,土壤微生物的影响或者是土壤没有经过高温处理土壤性质更适合砷被土壤胶体的吸附。
3 结论
本研究结果表明,土壤淹水条件下,在不灭菌不加菌种时,土壤溶液中的As(Ⅲ)质量浓度最低,为2.183 ng/mL;在不灭菌加菌种时,土壤溶液中的As(Ⅴ)质量浓度最低,为35.60 ng/mL;在灭菌不加菌种时,土壤溶液中的DMA质量浓度最高,为2.875 ng/mL;在不灭菌不加菌种时,土壤溶液中的总砷质量浓度最低,为48.74 ng/mL。
[1] KALTREIDER R C,DAVIS A M,LARIVIERE J P,et al.Arsenic alters the function of the glucocorticoid receptor as a transcription factor[J].Environmental Health Perspectives,2001,109:245-251.
[2]MANDAL B K,SUZUKI K T.Arsenic round the world:A review[J].Talanta,2002,58:201-235.
[3]ROSSMAN T G.Mechanism of arsenic carcinogenesis an integrated approach[J].Mutation Research,2003,533:37-65.
[4]曾希柏,和秋红,李莲芳,等.淹水条件对土壤砷形态转化的影响[J].应用生态学报,2010,21(11):2997-3000.
[5]PONTIUS J F W.A current load at the federal drinking water regulations[J].Journal American Water Works Association,1992,84:36-42.
[6]段桂兰,王利红,陈玉,等.植物超富集砷机制研究的最新进展[J].环境科学学报,2007,27(5):714-720.
[7]梁慧锋,刘占牛,马子川.新生态二氧化锰悬浊液的制备及对As(Ⅲ)氧化吸附机理的探讨[J].河北大学学报(自然科学版),2005,25(9):515-519.
[8]王箴.化工词典[M].北京:化学工业出版社,1993.
[9]吴佳,谢明吉,杨倩,等.砷污染微生物修复的进展研究[J].环境科学,2013(3):817-823.
[10] MEHARG A A,RAHMAN M M.Arsenic contamination of Bangladesh paddy field soils:Implications for rice contribution to arsenic consumption[J].Environmental Science and Technology,2003,37(2):229-234.
[11]AGENCYUSEP.Recent developments for in situ treatment ofmetal contaminated soil[M].Washington D C:the University of Washington Press,1997:1-12.
[12] FITZ W J.Arsenic transformations in the soil rhizosphere-plant system[J].Journal ofBiotechnology,2002,99(3):259-278.
[13]NORRA S.Impact of irrigation with As rich groundwater on soil and crops[J].Applied Geochemistry,2005,20(10):1890-1906.
[14]SMITH E,NAIDU R,ALSTON A M.Arsenic in the soil environment:Areview[J].Advances in Agronomy,1998,64:149-195.
[15]NICHOLSON F A,CHAMBERS B J,WILLIAMS J R,et al.Heavy metal contents of livestock feeds and animal manures in England and Wales[J].Bioresource Technology,1999,70:23-31.
[16]郑喜珅,鲁安怀,高翔.土壤中重金属污染现状与防治方法[J].土壤与环境,2002,11(1):79-84.
[17]陈怀满,郑春荣.中国土壤重金属污染现状与防治对策[J].人类环境杂志,1999,2(2):130-134.
[18]施积炎,陈英旭,林琦,等.根分泌物与微生物对污染土壤重金属活性的影响[J].中国环境科学,2004,24(3):316-319.
