高效液相色谱法测定甲基二磺隆在谷子和土壤中的残留及消解动态
2018-03-19王斌强张丽光张伟莉王吉祥郭平毅原向阳
刘 丹 ,王斌强 ,2,张丽光 ,张伟莉 ,王吉祥 ,宁 娜 ,郭平毅 ,原向阳
(1.山西农业大学农学院,山西太谷 030801;2.九江农业科学院,江西九江 332000;3.山西省农业科学院作物科学研究所,山西太原 030031)
甲基二磺隆是德国拜耳作物科学公司开发的一种新型茎叶除草剂世玛的主要成分,具有高效、低毒、环境友好等特点,可有效防除麦田一年生禾本科杂草和部分阔叶杂草[1-2],对谷田杂草防除有一定的利用价值。除草剂的不合理施用会导致农产品和谷田生态系统中的农药残留超标,对人类健康和生态环境造成毒害,并对后茬作物产生药害[3]。在当前大力提倡减肥减药和高度重视食品安全的大前提下,研究除草剂在谷田生态系统中的残留及消解动态,可以为谷田除草剂的合理施用、谷子系列产品的安全食用及谷田生态系统的可持续发展提供一定的理论依据。
当前,国内外主要采用液相色谱(HPLC)和液相色谱-质谱法(LC-MS/MS)检测磺酰脲类除草剂残留[4-6],其检测样品包括大豆[7]、大米[8]、玉米[9]、动物源性食品[10]、土壤[11-13]等,有关甲基二磺隆和谷子样品的残留分析报道较少。黄雅俊等[14]利用HPLC法建立了甲基二磺隆的色谱分析法;张少军等[15]采用液相色谱紫外检测法测定了甲基二磺隆在小麦和土壤中的残留动态;张婷等[16]采用高效液相色谱-串联质谱法测定了冀谷33号及土壤中咪唑乙烟酸的残留。
本试验在总结前人研究的基础上,采用分散固相萃取和HPLC检测技术,建立了甲基二磺隆在谷子植株、籽粒及土壤中的测定方法,并采用该方法研究了甲基二磺隆在谷子及土壤中的残留及消解特征,以期为甲基二磺隆和磺酰脲类除草剂在谷田的安全科学使用提供理论依据。
1 材料和方法
1.1 材料
供试谷子品种为晋谷21号。
1.2 试剂与仪器
世玛油悬浮剂(甲基二磺隆的含量为3%),甲基二磺隆标准品(97.84%);乙腈、甲醇、甲酸、冰乙酸、磷酸、三乙胺和氨水为色谱纯;无水硫酸镁、氯化钠、超纯水、C18固相萃取小柱、PSA(N-丙基乙二胺)和GCB(石墨化碳黑)。
日立Hitachi高效液相色谱仪带可变紫外检测器,高速组织捣碎机,超声波清洗器,旋转蒸发器,SK-1快速混匀器,砻谷机。
1.3 试验设计
于2014年在山西农业大学农作站按照文献[17]的要求进行田间试验,喷施除草剂为世玛油悬浮剂,推荐最高有效剂量为13.5 g/hm2,每公顷对水量450 L。随机完全区组设计,每小区30 m2,每个处理重复3次并设1 m宽保护行。
1.3.1 谷子消解动态试验 在谷子5~6叶期施药,喷施有效剂量为13.50 g/hm2。在施药后1 h,1,3,7,14,21,28,35 d 随机多点采集 1 kg 生长正常、无病害谷子植株,切成1 cm段、混匀,四分法留样200 g,同期采集空白样品,贴好标签,于-20℃保存,待测。
1.3.2 土壤消解动态试验 在空白地块上,按照有效剂量 27,54 g/hm2均匀喷施,喷药后 1 h,1,3,7,14,21,28,35 d 取土壤样品 1 kg,去除杂物后四分法留样500 g,-20℃冰柜中保存。
1.3.3 最终残留试验 在谷子5~6叶期,按照有效剂量6.75,13.50 g/hm2叶面均匀施药,设不施除草剂为空白对照。谷子成熟期分别采集秸秆、籽粒和土壤,粉碎秸秆、籽粒和土壤,留样500 g,-20℃冰柜中保存。
1.4 分析方法
1.4.1 样品前处理 准确称取一定量已粉碎的样品(20.0 g谷子植株、20 g小米和50.0 g土壤),置于250mL具塞三角瓶中,加入100.0mL提取液(乙腈-0.02 mol/L三乙胺为 8∶2),混匀 30 s,超声 5 min,布氏漏斗过滤至已装有7 g氯化钠的250 mL分液漏斗中,50 mL提取液再次洗涤滤渣,合并滤液,剧烈振荡2 min,室温下静置40 min,在35℃减压旋转蒸发至近干,取上清液于圆底烧瓶中,减压浓缩(35℃)近干,2 mL乙腈溶解,取1.5 mL至已装有10 mg GCB和150.0 mg无水硫酸镁的2 mL离心管中(土壤不净化),混匀30 s,5 000 r/min离心5 min,上清液经4.5 μm滤膜过滤,待测。
1.4.2 液相色谱条件 紫外检测器(UV);Exl-C18不锈钢色谱柱(4.6 mm×250 mm,5 μm);流动相为V(乙腈)∶V(0.01 mol/L磷酸)=50∶50;流速为1.0 mL/min;柱温为 25 ℃;进样量为 10 μL;检测波长为233 nm;保留时间为7.4 min。
1.4.3 标准曲线的绘制 称甲基二磺隆标准品0.1 g,乙腈溶解,配制成1.0 g/L的甲基二磺隆储备液 100 mL。再分别稀释成 0.02,0.10,0.50,1.00,5.00,10.00,20.00 mg/L的系列标准溶液,按1.3.2的条件测定,重复3次。以色谱峰面积为纵坐标、质量浓度为横坐标,绘制甲基二磺隆的标准曲线。
1.4.4 添加回收试验 取空白植株20 g、小米20 g,添加0.02,0.10,0.50 mg/kg 3个水平;取空白土壤50 g,添加 0.008,0.100,0.500 mg/kg 3 个水平,按1.4.1和1.4.2进行回收率测定,每处理重复5次。
2 结果与分析
2.1 色谱条件的选择
通过SP-756紫外分光光度计采集10 mg/L甲基二磺隆标样在205~295 nm的吸收值,发现在233 nm附近有较高吸收值。本试验比较了甲醇-水和乙腈-水2种不同溶剂配比的流动相。结果显示,乙腈-水流动相体系保留时间和分离效果较好,将磷酸加入水相后峰形改善,拖尾减小。在比较了不同浓度磷酸-水相后,发现浓度为0.01mol/L,pH为3.6时,峰形最佳,故选择乙腈∶磷酸(0.01 mol/L)=50∶50(V∶V)作为流动相。
2.2 样品前处理的选择
本试验比较了乙腈、甲醇及其与水、氨水和三乙胺混合作为提取剂,不同提取配比对目标化合物的回收率列于表1。由表1可知,乙腈/水和乙腈/三乙胺(8/2)提取剂的回收率均大于90%,由于甲基二磺隆在碱性条件下溶解度大于中性,结构稳定,易于短时间保存样品,故选择乙腈/三乙胺(8/2)作为提取剂。在提取液中加入适量NaCl有利于有机相与水相分层,提高目标物在有机相中的溶解度,起到部分净化的作用。在净化试验比较了固相萃取C18小柱、PSA和GCB,研究发现,GCB较C18小柱和PSA回收率高,且能较好地去除色素,故选GCB作为吸附剂。分别对比了不同剂量GCB的净化效果,发现并无显著变化,回收率均能够达到75%以上,最终选择10.0 mg GCB作为吸附剂净化提取液。

表1 不同提取剂的平均添加回收率
2.3 标准曲线及检出量
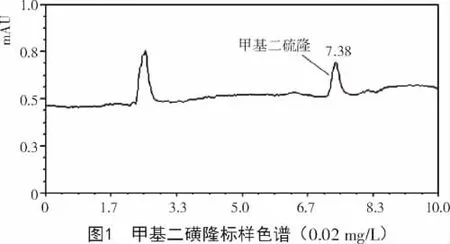
甲基二磺隆在0.02~20.00 mg/L浓度范围内峰面积与浓度具有良好的线性相关性,线性回归方程为 y= 11 324x-804.14,决定系数 R2=0.999 4。以3倍信噪比计算得出该检测方法的最小检出量为0.2 ng;根据添加回收试验,植株、籽粒最低检测浓度为0.02 mg/kg,土壤为0.008 mg/kg,相关甲基二磺隆标样图谱如图1所示。
2.4 添加回收率
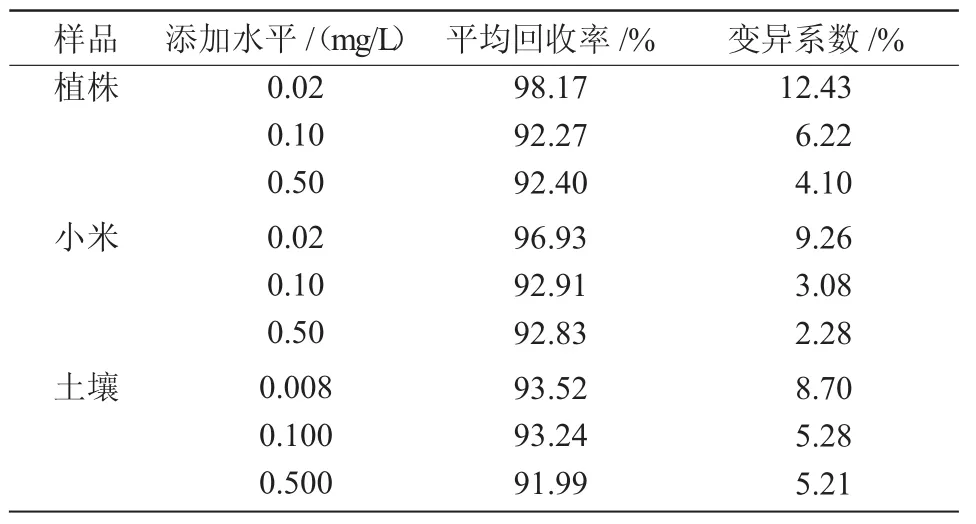
表2 甲基二磺隆在不同样品中的添加回收率及变异系数(n=5)
从表 2 可以看出,在 0.02,0.10,0.50 mg/kg 3 个添加水平下,甲基二磺隆在籽粒和植株中的平均添加回收率分别为92.83%~96.93%和92.27%~98.17%,变异系数分别为2.28%~9.26%和4.10%~12.43%;在 0.008,0.100,0.500 mg/kg 3个添加水平下,甲基二磺隆在土壤中的平均回收率为91.99%~93.52%,变异系数为5.21%~8.7%。回收率都大于80%,符合农药残留分析要求[18],可应用于实际残留检测。
2.5 消解动态
从表3可以看出,甲基二磺隆在谷子植株和土壤中的消解动态符合一级动力学方程,在植株中的理论半衰期为6.4 d,土壤中的理论半衰期为16.6~18.7 d。由试验结果可知,甲基二磺隆属于较易降解除草剂,在土壤中消解速率较慢。
2.6 最终残留
由表4可知,距喷药105 d后,收获期籽粒、秸秆和土壤样品均未检出甲基二磺隆,说明残留量都低于最低检测浓度。目前,我国及国际上还未制定谷子相关样品中甲基二磺隆的残留限量(MRL)和土壤中的残留限量(MRL)。我国和澳大利亚规定,小麦中甲基二磺隆的MRL值为0.02 mg/kg,日本制定小麦中的MRL值为0.03 mg/kg[19]。由试验结果可知,在该检测方法下,甲基二磺隆在谷子秸秆、籽粒及土壤中的最终残留均小于最低检测浓度,甲基二磺隆在谷子样品中的最终残留均小于国内外规定的小麦中MRL值。
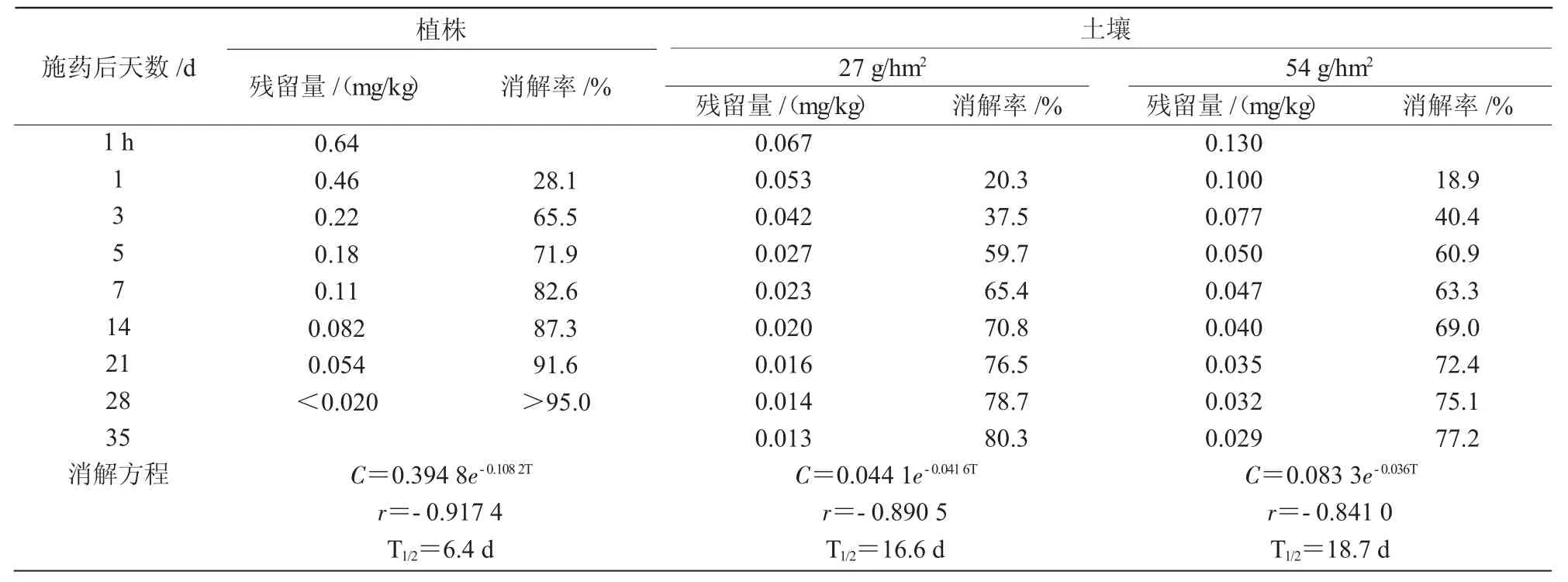
表3 甲基二磺隆在植株和土壤中的消解动态

表4 甲基二磺隆在谷子和土壤中的最终残留量
3 结论
本试验建立了一种简便、经济、安全的高效液相色谱法,测定谷子植株及土壤中甲基二磺隆残留;消解试验结果表明,甲基二磺隆是一种较易降解的除草剂;采用该方法测定小米和秸秆中甲基二磺隆,其最终残留量均低于我国和美国制定的相关MRL标准。由此可知,世玛3%甲基二磺隆乳剂于谷子5~6叶期喷施1次,喷施有效剂量为6.75~13.5 g/hm2,小米及秸秆最终残留量未超标,不会对人畜造成危害,对土壤环境安全。
[1]王斌强.甲基二磺隆对谷子的安全性及其残留分析研究[D].太谷:山西农业大学,2015.
[2]原国辉,高一风,周永玲,等.3%世玛乳油防除麦田雀麦等杂草试验[J].农药,2002,41(2):35,34.
[3]王大宁,董益阳,邹明强.农药残留检测与监控技术[M].北京:化学工业出版社,2006.
[4]吕萍萍,徐晓曦.农药残留对食品安全的影响及其检测新技术的研究进展[J].农学学报,2012,2(6):65-67.
[5]吕晓玲,佘永新,王荣艳,等.磺酰脲类除草剂残留检测技术及其研究进展[J].分析测试学报,2009,28(7):875-880.
[6]李佳蔚,黄会,韩典峰,等.磺酰脲类除草剂毒性及多残留检测技术研究进展 [J].食品安全质量检测学报,2017,8(2):367-374.
[7]祁彦,占春瑞,张新忠,等.高效液相色谱法测定大豆中磺酰脲类除草剂的残留[J].农药,2005,44(2):76-78.
[8]隋凯,李军,卫锋,等.固相萃取-高效液相色谱法同时检测大米中 12种磺酰脲类除草剂的残留 [J].色谱,2006,24(2):152-156.
[9]丁菲,李范珠,储晓刚,等.玉米中9种磺酰脲类除草剂的超高效液相色谱-串联质谱法同时测定[J].分析测试学报,2011,30(1):53-57.
[10]刘锦霞,张莹,丁利,等.高效液相色谱-串联质谱法测定动物源性食品20种磺酰脲类除草剂残留 [J].分析化学,2011,39(5):664-669.
[11]BOSSI R,VEJRUP K,JACOBSEN C S.Determination of sulfonylurea degradation products in soil by liquid chromatography-ultraviolet detection followed by confirmatory liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,1999(2):575-582.
[12]DINELLI G,VICARI A,BRANDOLINI V.Detection and quantitation of sulfonylurea herbicides in soil at the ppb level bycapillary electrophoresis[J].J Chromatogr A,1995(12):201-207.
[13]叶贵标,张微,崔昕,等.高效液相色谱/质谱法测定土壤10种磺酰脲类除草剂多残留 [J].分析化学,2006,34(9):1207-1212.
[14]黄雅俊,郭利丰,黄晓华.1.2%二磺·甲碘隆油悬浮剂的高效液相色谱分析[J].农药,2011,50(2):119-120,127.
[15]张少军,杨更亮,郑振山,等.甲基二磺隆在小麦和土壤中的残留动态研究[J].河北农业大学学报,2009,32(3):12-16.
[16]张婷,师志刚,王根平,等.咪唑乙烟酸对冀谷33生长发育的影响及对后茬作物的安全性[J].中国农业科学,2015,48(24):4916-4923.
[17]农业部农药检定所.农药登记残留田间试验标准操作规程[M].北京:中国标准出版社,2007.
[18]卫生和计划生育委员会,农业部,国家食品药品监督管理总局.食品中农药最大残留限量GB 2763—2016[S].北京:中国标准出版社,2016.
[19]农业部农药检定所.农药最大残留限量数据库[DB/OL].http://202.127.42.84/tbt-sps/mrlsdb/queryMrlsdb.do,2017-11-20/2018-02-24.
