脂多糖对部分神经胶质细胞NgR表达的实验研究
2018-03-19王清萍张士发
王清萍,张士发
(皖南医学院第一附属医院 弋矶山医院 儿科,安徽 芜湖 241001)
随着围产医学的发展及新生儿重症监护(neonatal intensive care unit,NICU)技术的不断提高,早产儿的出生率和存活率越来越高,导致早产儿神经系统后遗症[1](认知、行为障碍、视听功能异常和脑瘫)发病率逐年增加,从而影响早产儿的生存质量,给家庭社会带来严重的负担。
早产儿和低出生体质量儿脑损伤主要原因是早产儿脑白质损伤(white matter damage,WMD)[2]。脑白质主要是由星形胶质细胞、少突胶质细胞和轴突共同组成。少突胶质前体细胞(oligodendrocytes precursor cells,OPCs)对缺氧、炎性介质、谷氨酸毒性等多种损伤较其他阶段的少突胶质细胞敏感,所以OPCs是早产儿WMD的关键性靶细胞。在细菌感染时,脂多糖(lipopolysaccharide,LPS)与小胶质细胞(microglia,MG)上的特异性受体TLRs结合,使其激活,被激活的小胶质细胞分泌大量肿瘤坏死因子α(tumor necronecrosis factor,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、活性氮(reactive nitrogen species,RNS)、活性氧(reactive oxygen species,ROS)、NO等免疫应答分子,直接损伤少突胶质细胞特别是OPCs[3],使脑白质髓鞘化受损,最终髓鞘发育不良。Nogo-A是在中枢神经系统髓磷脂中发现的一种抑制轴突生长的蛋白,与其受体复合体NgR结合,将信号传入细胞内,导致细胞内Rho/Rho激酶的活化,调控多种细胞的增殖、分化、凋亡/坏死。最近研究发现,Nogo-A和NgR还存在于中枢神经系统发育阶段的神经前体细胞中,对神经前体细胞分化和神经突触生长及可塑性变化具有调控作用[5]。感染是否影响MG和OPCs上的NgR表达及炎症因子的释放从而引起脑白质的损伤,目前机制尚不明确。本实验采用细胞体外培养,应用脂多糖诱导,观察NgR在MG和OPCs的表达情况及TLR-4在MG的表达情况,并监测相关炎症因子,初步探讨NgR的表达在TLR-4介导的神经胶质细胞释放炎性细胞因子中的作用。
1 材料与方法
1.1 材料 健康5月龄SD孕鼠,SPF级,购自南京市江宁区青龙山动物繁殖场,动物自由进食水。实验主要试剂CD11b-FITC(Biolegend),O4-PE(美国R&D公司),脂多糖(LPS,Biosharp),TLR4抑制剂TAK-242(日本Takeda制药有限公司),RNA抽提试剂(Trizol)(Takara公司),逆转录试剂盒(Takara公司),TNF-α ELISA试剂盒(美国R&D公司)。
1.2 方法
1.2.1 早产SD大鼠OPCs和MG的分离培养和鉴定 取孕16~17 d的SD大鼠,在颈部皮下注射米非司酮150 μg/只诱导早产,在孕22 d前出生大鼠为早产鼠,在无菌条件下取早产SD大鼠脑皮质,再采用振荡法结合差速贴壁法获取OPCs和MG。分别用特异性抗体CD11b和O4对MG和OPCs进行细胞免疫组织化学鉴定。
1.2.2 特异性NgR shRNA慢病毒感染MG和OPCs 将(1~2)×105个细胞种于6孔培养板中。培养1 d后将1 mL的病毒液加入到6孔板中,轻柔混匀,加入6~8 μL Polybrene。培养基和病毒等试剂充分混匀后,把细胞板放回培养箱孵育。培养6~8 h后观察细胞状态,加入1 mL的新鲜培养基。感染24 h后更换新鲜的培养基。
1.2.3 共同培养、分组和诱导 取培养2 d的MG和OPCs,在Transwell共培养系统中进行共培养,将MG加入Transwell上室,OPCs加入下室。分别在Transwell下室内加入无血清化学条件培养基进行孵育(无血清培养基含有胰岛素、去铁转铁蛋白、bFGF、PDGF)。分组:第1组:OPCs单独培养对照组。在培养板的每孔加入与对照组LPS等量的DMEM/F12培养液;第2组:OPCs单独培养诱导组。在培养板的每个孔中加入脂多糖100 μg/L;第3组:MG和OPCs共同培养对照组。在Transwell上室内加入和对照组LPS等量的DMEM/F12培养液;第4组:MG和OPCs共同培养诱导组。在Transwell上室内加入脂多糖100 μg/L;第5组:OPCs和MG共同培养加TLR-4抑制剂诱导组。先在上室中加入100 μg/L的TAK-242,24 h后再加入脂多糖100 μg/L;第6组:NgRShRNA转染OPCs共同培养诱导组。将慢病毒转染的OPCs细胞置于Transwell下室,MG置于上室共同培养,在上室内加入脂多糖100 μg/L;第7组:NgRShRNA转染MG单独培养诱导组。将慢病毒转染的MG细胞培养液中加入脂多糖100 μg/L。加入LPS孵育48 h后,分别收集各组培养液上清和细胞进行相关检测。
1.2.4 实时荧光定量聚合酶链式反应(PCR)检测OPCs、MG的NgR和MG的TLR-4基因的表达情况 均由上海捷瑞生物工程有限公司合成荧光定量PCR需要的NgR、TLR-4上下游引物。同时合成内参基因GAPDH序列上下游引物NgR Forward:5′-CGCATCTCTTTCTGCATGGC-3′,Reverse:5′-GTGCAAGAGGAGACGGTCAA-3′,TLR-4 Forward:5′-GCTGGTTGCAGAAAATGCCA-3′,Reverse:5′-AGGA GTACCTCTATGCAGGG-3′,GAPDH Forward:5′-ACTTTGGCATCGTGGAAGGG-3′,Reverse:5′-ACTTGGCAGGTTTCTCCAGG-3′。①细胞总RNA的提取:按RNA提取试剂说明书操作,Trizol提取总RNA,所提取RNA的OD260/OD280值在1.8~2.0之间。②RNA逆转录反应体系和程序:5×PrimeScript RT Master Mix 2 μL+Total RNA 3 μL+RNase Freed H2O 7 μL,逆转录反应条件:37 ℃,15 min(逆转录反应);85 ℃,5 s(逆转录酶的失活反应)。③聚合酶链反应(polymerase chain reaction,PCR)反应体系:SYBR Premix Ex TaqTM Ⅱ(2×)12.5 μL +PCR Forward Primer(10 μmol/L)1 μL+PCR Reverse Primer(10 μmol/L)1 μL+DNA 模板2 μL+ddH2O 8.5 μL,预变性(重复1次:95 ℃,30 s);退火:PCR反应(重复40次,95 ℃,5 s;60 ℃,30 s);溶解。用real-time PCR仪(ABI Step One Plus real-time PCR,Bio-Rad)获得目的基因和内参基因Ct值。④实验均重复3次,结果以2-ΔΔct值反映目的基因mRNA的表达水平。
1.2.5 酶联免疫吸附试验(ELISA)检测TNF-α含量 培养细胞48 h后,收集上清。按照试剂盒说明书操作步骤检测细胞分泌TNF-α的含量。
2 结果
2.1 免疫荧光法观察早产SD大鼠的MG和OPCs 在倒置显微镜下观察纯化后的小胶质细胞,呈多态性,其中以圆形、分枝状多见(如图1)。观察纯化后的少突胶质细胞前体,培养12 h左右细胞就开始贴壁生长,培养3 d后,细胞胞体呈小圆形,有两个或三个突起(如图2)。
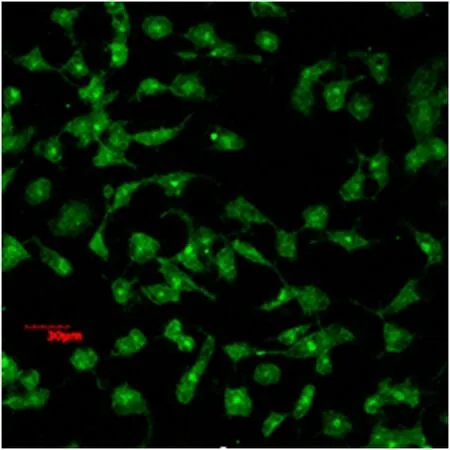
图1 CD11b-FITC免疫荧光染色阳性的小胶质细胞
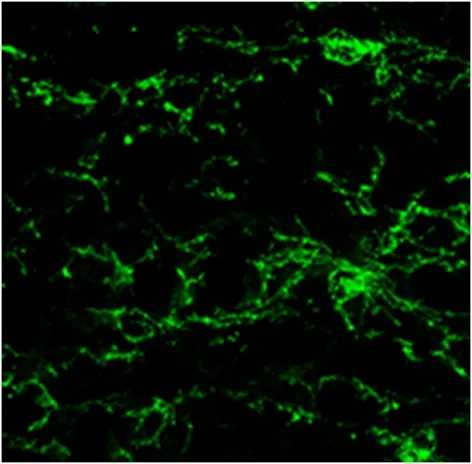
图2 O4-PE免疫荧光染色阳性的少突胶质前体细胞
2.2 脂多糖刺激和慢病毒干扰后MG的TLR-4 mRNA的表达情况 结果显示第4组MG的TLR-4 mRNA的表达水平高于第3、5、7组,差异有统计学意义(P<0.05),第7组与第3组差异无统计学意义(表1)。
表1 各组中MG的TLR-4基因mRNA的表达强度比较

组别MG的TLR-4mRNA表达强度OPCs和MG共同对照组0.4005±0.2384aOPCs和MG共同培养诱导组1.2010±0.3553bOPCs和MG共同培养加TLR⁃4抑制剂诱导组0.1023±0.4543cNgRShRNA转染MG单独培养诱导组0.4896±0.2006aF11.54P0.03
相同字母组之间比较P>0.05;不同字母组之间比较P<0.05。
2.3 各组TNF-α的含量情况 结果显示第4组TNF-α的释放量高于其他6组,差异有统计学意义(P<0.05)(表2)。
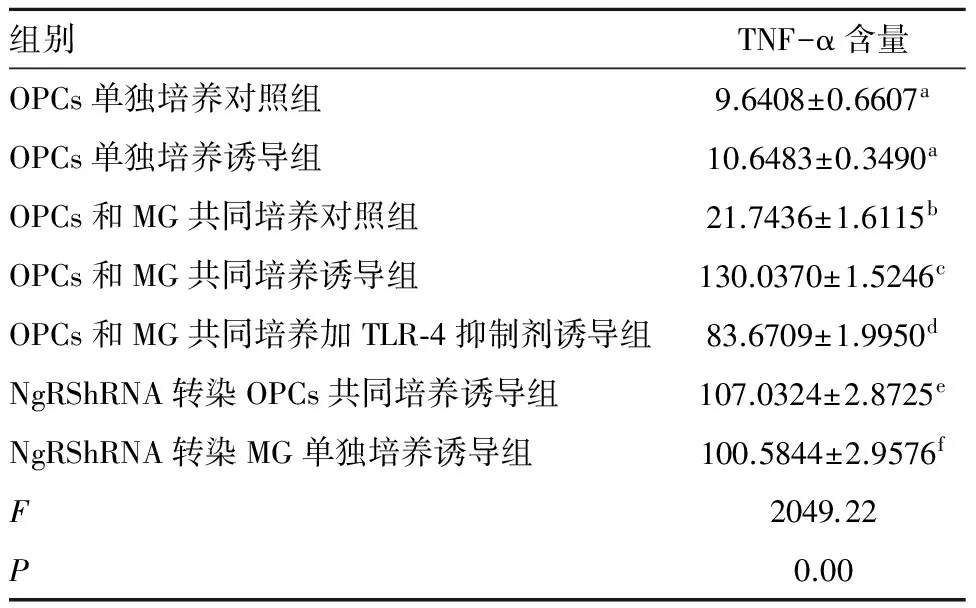
表2 各组中TNF-α含量的比较 pg/mL
相同字母组之间比较P>0.05;不同字母组之间比较P<0.05。
2.4 脂多糖刺激和慢病毒干扰后小胶质细胞的NgR mRNA的表达情况 结果显示第4组MG的NgR mRNA的表达水平低于第3、5、7组,差异有统计学意义(P<0.05),第7组与第3组差异无统计学意义(表3)。
表3 各组中MG的NgR基因mRNA的表达强度比较

组别MG的NgRmRNA的表达强度OPCs和MG共同培养组0.1048±0.0305aOPCs和MG共同培养诱导组1.0758±0.1859bOPCs和MG共同培养加TLR⁃4抑制剂诱导组0.4195±0.1121cNgRShRNA转染MG单独培养诱导组0.1145±0.0441aF47.01P0.00
相同字母组之间比较P>0.05;不同字母组之间比较P<0.05。
2.5 脂多糖刺激和慢病毒干扰后少突胶质细胞前体的NgR mRNA的表达情况 结果显示第2、4、5组OPCs的NgR mRNA的表达水平高于第1、3、6组,差异有统计学意义(P<0.05)(表4)。
表4 各组中OPCs的NgR基因mRNA的表达强度比较
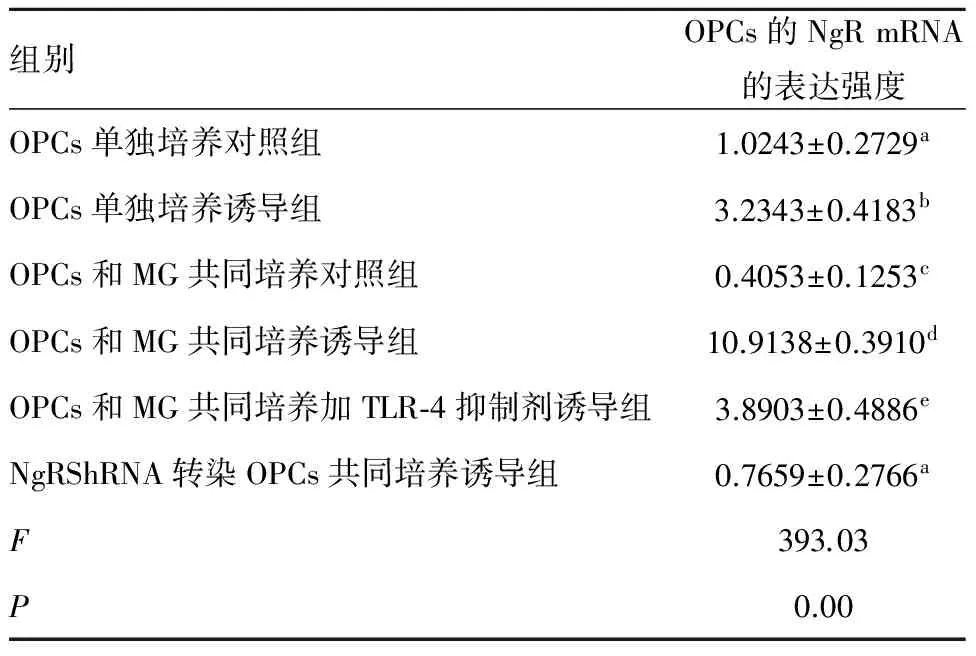
组别OPCs的NgRmRNA的表达强度OPCs单独培养对照组1.0243±0.2729aOPCs单独培养诱导组3.2343±0.4183bOPCs和MG共同培养对照组0.4053±0.1253cOPCs和MG共同培养诱导组10.9138±0.3910dOPCs和MG共同培养加TLR⁃4抑制剂诱导组3.8903±0.4886eNgRShRNA转染OPCs共同培养诱导组0.7659±0.2766aF393.03P0.00
相同字母组之间比较P>0.05;不同字母组之间比较P<0.05。
3 讨论
近年来大量实验研究表明宫内感染是早产儿脑损伤的重要原因[6],宫内感染引起的早产儿脑损伤可能与多种细胞因子增多有关。LSP可被MG/巨噬细胞表面的TLRs识别,激活TLR4-NF-κB通路从而引起炎症介质(如TNF-a)的上调,并释放、分泌一系列免疫应答分子、神经毒性物质产生细胞毒性作用,对脑损伤有重要的作用[7-8]。TNF-a是炎性反应的主要因子,也可以引起其他大多细胞因子的释放,并可抑制OPCs的分化成熟,还可以诱导凋亡最后引起髓鞘损害和轴突病变,从而导致早产儿脑白质损伤[9]。
本实验结果显示,LPS刺激MG后,MG的TLR-4 mRNA表达量和TNF-α释放量增高,并高于OPCs和MG共同对照组及TLR-4抑制剂处理组。证明TLR-4作为脂多糖的特异性受体,参与了LPS激活MG活化并释放TNF-α的过程,TLR-4抑制剂可以减轻MG的炎症反应及对神经细胞的损伤。NgRshRNA转染MG单独培养诱导组MG的TLR-4 mRNA表达量低于共同培养诱导组,但和共同培养对照组差异无统计学意义。说明脂多糖诱导MG表达大量TLR-4的需要NgR的介导,其具体机制尚需进一步探讨。
研究表明NgR还表达于CNS中活化的MG和巨噬细胞中,调节这些吞噬细胞的运动[10],这说明NgR在神经炎症性反应中也起一定的作用。国内外关于脑白质OPCs及MG表达NgR的文献极少,目前没有发现有关NgR与细胞炎性因子之间的关系的报道和研究。唐军等[11]通过体外培养OPCs,发现OPCs在缺氧缺血造模后10 min,NgR的表达量较正常时增高,并随着缺氧缺血时间的延长,NgR的表达量进行性增高。
本实验结果显示MG经LPS诱导后,MG上的NgR的mRNA和释放的TNF-α较共同对照组增高;TLR-4抑制剂处理组MG的NgR的mRNA的表达量和释放的TNF-α较OPCs和MG共同培养诱导组减少;提示TLR-4可能存在上调NgR基因表达的作用,具体机制尚不清楚,需进一步研究。NgR特异性ShRAN转染MG单独培养诱导组,MG的NgR的表达和共同对照组差异无统计学意义,此组释放的TNF-α较共同培养诱导组减少,但没有TLR-4抑制剂处理组降低明显。提示MG的NgR参与了调节炎性细胞因子TNF-α的释放。
本实验结果显示OPCs单独培养组经LPS诱导后,细胞上的NgR的mRNA较单独对照组增高,但TNF-α差异无统计学意义。NgR特异性ShRAN转染OPCs共同培养诱导组,OPCs的NgR较共同培养对照组差异无统计学意义,但TNF-α释放量较OPCs和MG共同培养诱导组减低,说明OPCs不是免疫细胞,故OPCs不能释放炎性细胞因子,但OPCs的NgR参与了MG释放TNF-α的调节。
通过细菌感染致脑白质损伤实验性研究的进一步深入,可以为今后国内外脑白质损伤及后遗症的病因研究提供新的思路,并为预防、治疗脑白质损伤提供新的有效的解决方法,从而减少早产儿的病死率及残疾患儿的出生率,减轻社会及家庭的负担。
[1] BACK SA,MILLER SP.Brain injury in premature neonates:a primary cerebral dysmaturation disorder[J]?Ann Neurol,2014,75(4):469-486.
[2] MWANIKI MK,ATIENO M,LAWN JE,etal.Long-term neurodevelopmental outcomes after intrauterine and neonatal insults:a systematic review[J].Lancet,2012,379(9814):445-452.
[3] FALAHATI S,BREU M,WAICKMAN AT,etal.Ischemia-induced neuroinflammation is associated with disrupted development of oligodendrocyte progenitors in a model of periventricular leukomalacia[J].Dev Neurosci,2013,35(2-3):182-196.
[4] BORRIE SC,BEAUMER BE,BANDTLOW CE.The Nogo-66 receptor family in the intact and diseased CNS[J].Cell Tissue Res,2012,349(1):105-117.
[5] SCHWAB ME.Functions of Nogo proteins and their receptors in the nervous system[J].Nat Rev Neurosci,2010,11(12):799-811.
[6] LAN L,TAO J,CHEN A,etal.Electroacupuncture exerts anti-inflammatory effects in cerebral ischemia-reperfusion injured rats via suppression of the TLR4/NF-κB pathway[J].Int J Mol Med,2013,31(1):75-80.
[7] KANG BK,KIM MK,KIM SY,etal.Anti-neuroinflammatory effects of uncaria sinensis in LPS-stimulated BV2 microglia cells and focal cerebral ischemic mice[J].Am J Chin Med,2015,43(6):1099-1115.
[8] MIT SOV E,KACE ROVSKYY M,KREJSEK J,etal.Umbilicalcord blood soluble Toll-like receptor 2 in pregnancies complicatedby preterm premature rupture of membranes[J].Ceska Gynekol,2013,78(4):365-372.
[9] ALMOLDA B,GONZALEZ B,CASTELLANO B.Antigen presentation in EAE:role of microglia,macrophages and dendritic cells[J].Front Biosci (Landmark Ed),2011,16:1157-1171.
[10] FRY EJ,HO C,DAVID S.A role for Nogo receptor in macrophage clearance from injured peripheral nerve[J].Neuron,2007,53(5):649-662.
[11] 唐军,姚裕家,钟琳.NgR在新生大鼠少突胶质前体细胞系的表达和缺氧缺血后变化的意义[J].中国当代儿科杂志,2007,9(5):445-448.
