蝮蛇毒抑制心肌缺血再灌注损伤中血小板活化机制的探讨
2018-03-19高恬媛张根葆
高恬媛,张根葆,2,靳 文,季 娜
(皖南医学院 1.病理生理学教研室;2.蛇毒研究所 安徽省重点实验室,安徽 芜湖 241002)
心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury,MIRI)广泛见于临床,是造成临床溶栓治疗、冠脉搭桥术和心脏移植失败的重要原因。血小板活化因子(platelet activating factor,PAF)是一种磷脂递质,血小板、中性粒细胞、肥大细胞、内皮细胞等均可分泌,是目前发现的作用最强的脂质递质,也是最有效的血小板聚集诱导剂。研究表明,MIRI可促进PAF释放,激活血小板,促进血栓形成[1-2]。本实验室前期已经成功从皖南蝮蛇粗毒中分离纯化出蝮蛇毒血小板抑制因子(platelet inhibitor fromAgkistrodonhalysvenom,AHV-PI),其分子质量约31 ku。家兔在体实验发现其有抗血小板聚集的作用,与保护血小板超微结构,减少其颗粒内容物释放有关,但具体作用机制尚不明确[3]。本实验通过复制大鼠在体心肌缺血/再灌注损伤模型,旨在观察AHV-PI对其作用及其可能机制,为AHV-PI的临床应用提供理论和实验依据。
1 材料与方法
1.1 动物及分组 雄性SD大鼠36只,体质量(250±25)g,清洁级,由苏州市工业园区爱尔麦特科技有限公司提供,许可证编号:SCXK(苏)20130002。大鼠随机分为6组(n=6):正常对照组、I/R模型组、阳性对照组(PAF抑制剂银杏内酯BN52021,4 mg/kg)、AHV-PI低、中、高剂量组(0.05、0.1、0.2 mg/kg)。模型组经腹腔注射1 mL的生理盐水,阳性对照组注射同体积的4 mg/kg银杏内酯B稀释液,AHV-PI低、中、高剂量组注射同体积的(0.05、0.1、0.2 mg/kg)AHV-PI。正常对照组不复制I/R模型,仅腹腔注射同体积的生理盐水。
1.2 药品与试剂 AHV-PI由皖南医学院蛇毒研究所提供;银杏内酯(BN52021)购于Sigma公司;血小板活化因子(PAF)ELISA试剂盒购于武汉华美生物工程有限公司;ADP购于Sigma公司;TTC试剂购于Amresco公司。
1.3 仪器 HX-300S动物呼吸机(成都泰盟科技有限公司);RM6240生物信号采集系统(成都仪器厂);Model-680酶标仪美国(Bio-Rad公司);血小板聚集仪(Helena Laboratories公司)。
1.4 I/R模型制备 大鼠腹腔注射1.5%戊巴比妥钠(0.3 mL/100g),麻醉后背部固定于鼠台,常规颈部手术,行气管插管,连接呼吸机,RM6240 生物信号采集处理系统监测Ⅱ导联心电变化。分离胸肌,断开左侧第2~4肋骨,暴露心脏,撕开心包膜,于肺动脉圆锥与左心耳间,以冠状静脉为标志,找到冠状动脉左前降支,并于冠状动脉左前降支起始部下2 mm 处用6-0手术线结扎,手术线两端各套一个细小乳胶管圈,拉紧结扎线使细小乳胶管压迫左冠状动脉前降支而致闭塞。以结扎后心前区发绀伴随T波高耸或ST段抬高(>0.2 mV)作为结扎成功的标志。结扎后立即腹腔注射给药,结扎30 min后剪断结扎线,再灌注120 min后采集标本。
1.5 标本采集与指标检测 颈总动脉取血,用3.8%枸橼酸钠(1∶9)抗凝,常温静置30 min,离心10 min(3000 r/min)收集血浆,冰冻保存,采用酶联免疫吸附双抗体夹心法(ELISA)定量测定PAF含量;将血样离心(1000 r/min,10 min)后取富含血小板血浆(RPR),剩余再离心(3000 r/min,10 min)取贫血血小板血浆(PPP),采用ADP(25 μL,50 μmol/L)诱导比浊法测定血小板聚集率(取血后2 h内完成);剪取心肌组织做好标记后,立即用冰生理盐水冲净血迹,吸水后-70℃冰冻10 min,从心底至心尖切成5片,每片厚度2 mm,0.2%TTC 37℃水浴箱中避光孵育20 min,观察心肌切片颜色变化(由于缺血梗死部位乳酸脱氢酶会失活,TTC与乳酸脱氢酶结合,梗死部位染成白色,非梗死部位为红色),拍照后采用 Image J软件计算梗死面积。梗死面积百分比(%)= 梗死面积/横切片总面积×100%[4]。
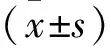
2 结果
2.1 AHV-PI对缺血再灌注大鼠血小板聚集率的影响 图1可见,与正常对照组相比,模型组血小板最大聚集率上升;与模型组相比,AHV-PI中、高剂量组血小板最大聚集率均降低(F=73.64,P<0.05)。
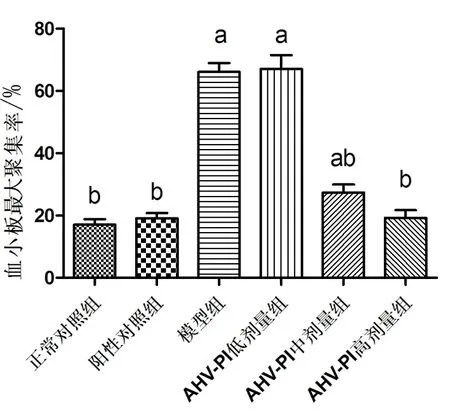
aP<0.05vs.正常组,bP<0.05vs. 模型组。
2.2 AHV-PI对缺血再灌注大鼠血小板活化因子(PAF)含量的影响 表1中可见,与正常对照组相比,模型组中PAF含量增加(P<0.05);与模型组相比,AHV-PI中、高剂量组均降低(P<0.05),差异有统计学意义。
2.3 TTC染色 由图2可见,AHV-PI低剂量组与模型组的缺血梗死发白非常明显,AHV-PI高剂量组TTC染色后没有明显的心肌缺血梗死发白的变化。由图3可见,与模型组[(48.04±13.93)%]相比,阳性对照组[(10.93±1.95)%]、AHV-PI中剂量组[(14.76±5.79)%]、高剂量组[(3.94±1.03)%]心肌梗死面积百分比均降低(F=25.46,P<0.01)。
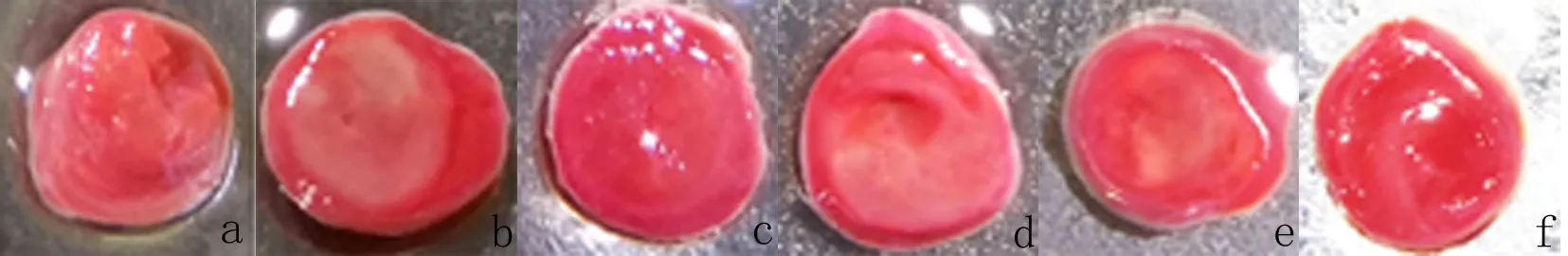
a:正常对照组;b:模型组;c:阳性对照组;d:AHV-PI低剂量组(0.05 mg/kg);e:AHV-PI中剂量组(0.1 mg/kg);f:AHV-PI高剂量组(0.2 mg/kg)。
图2 TTC染色后各组心肌染色结果
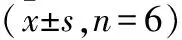
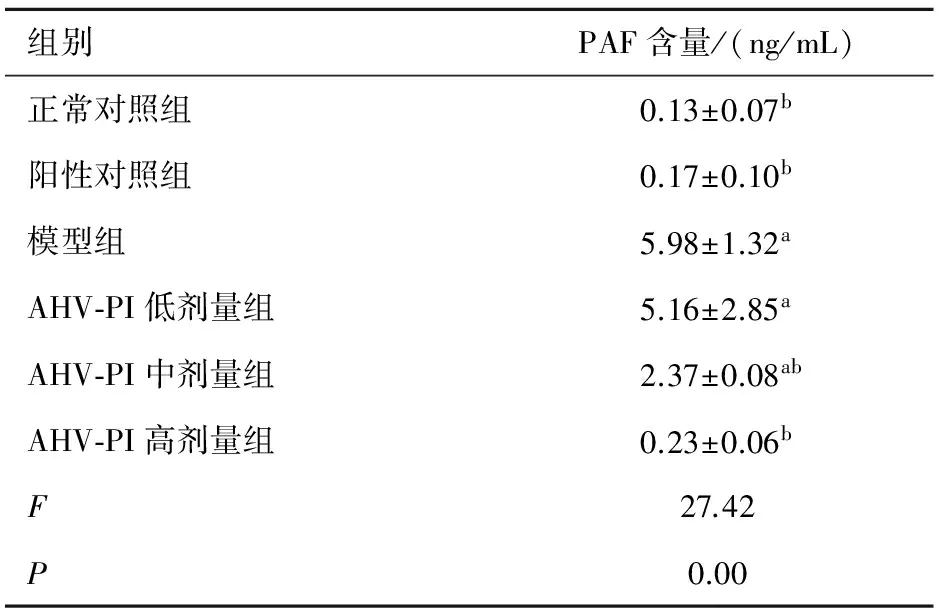
组别PAF含量/(ng/mL)正常对照组0.13±0.07b阳性对照组0.17±0.10b模型组5.98±1.32aAHV⁃PI低剂量组5.16±2.85aAHV⁃PI中剂量组2.37±0.08abAHV⁃PI高剂量组0.23±0.06bF27.42P0.00
aP<0.05vs.正常组,bP<0.05vs. 模型组。
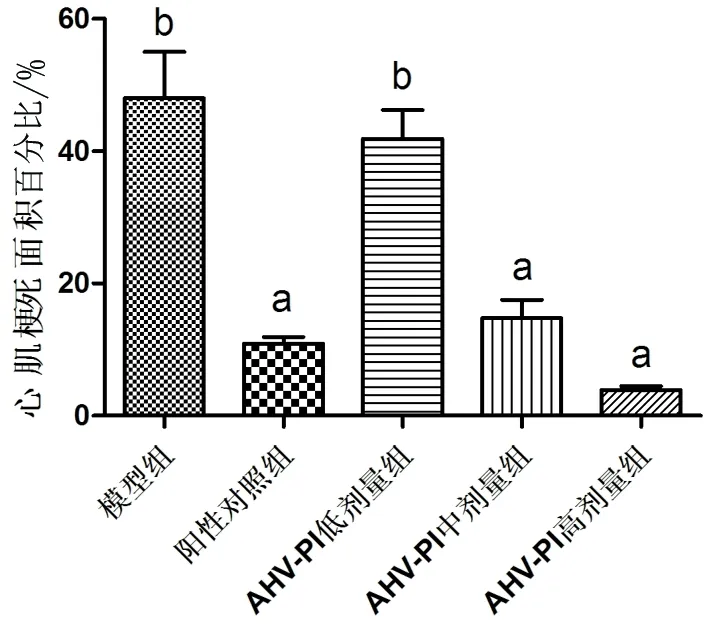
aP<0.01vs.模型组,bP<0.01vs.对照组。
图3 TTC染色后各组心肌梗死面积
3 讨论
研究发现,再灌注损伤会引起血小板的活化聚集[5],再灌注损伤主要与血小板激活引起冠状动脉无复流现象有关。目前临床上治疗ST段抬高的急性心肌梗死最有效的疗法[6]是经皮冠状动脉介入手术,但相当一部分病人手术后出现心外膜冠状动脉无复流,这是导致左心室收缩舒张功能障碍的危险因素。无复流现象形成机制包括:肿胀的心肌细胞压迫微血管;肿胀的毛细血管内皮细胞突出到毛细血管腔;心肌细胞挛缩压迫毛细血管;中性粒细胞堵塞微脉管系统;血小板聚集、微血栓、血小板脂质碎片等栓塞毛细血管;微血管床的破坏;毛细血管痉挛和功能障碍,再灌注损伤[6]。其中血小板在再灌注损伤引起无复流现象中扮演重要角色。血小板激活会产生微血栓导致微循环障碍,也会产生炎症介质、血管活性物质导致冠状动脉无复流,且当去除血小板后会显著减少无复流区域[7]。
本实验室前期研究发现AHV-PI可以降低血浆中纤维蛋白原含量,可能具有纤溶酶活性[3]。研究发现,PAF与受体结合才能产生活性,结合后可使纤维蛋白原的结合位点暴露,血小板与血小板之间相互反应[8]。BN52021是 PAF拮抗剂,是一种银杏叶提取物,通过降低PAF水平及与潜在的PAF受体结合产生效应[9]。PAF与其受体结合的复合物主要通过5种途径来产生活性:与G蛋白偶联,调控磷脂酶,调控Ca2+浓度,调控蛋白激酶,调控基因表达[1]。本实验利用BN52021进行阳性对照,旨在探讨AHV-PI对再灌注中产生的PAF的影响程度。本研究还发现模型组血小板聚集率上升,PAF水平升高,TTC染色显示模型制造成功,AHV-PI中、高剂量组血小板聚集率降低,PAF水平降低,TTC染色梗死面积减少,这说明AHV-PI对大鼠心肌缺血再灌注损伤有修复作用,可以降低血小板的活化聚集。缺血再灌注中,PAF可以通过第二信使IP3、DAG等直接参与,或者通过炎性细胞活化,如血小板,多形核中性粒细胞加重缺血后心肌细胞损伤[10-11];PAF还可致内皮与基底的组织相连蛋白破坏,促进血小板黏附,形成小血栓,大量的炎性细胞聚集并侵入,最后在内皮细胞损伤处出现纤维蛋白沉积[12]。
综上所述,大鼠心肌缺血再灌注损伤时血小板分泌的血小板活化因子增加,AHV-PI可以降低血小板中PAF释放,减少血小板活化,降低血小板聚集率,减少心肌梗死面积,减轻再灌注损伤。
[1] 袁奇,张小华,乔延江.血小板活化因子及其受体拮抗剂的研究进展[J].中华中医药杂志,2011,26(7):1568-1571.
[2] CLAUDIA PENNA,ELEONORA BASSINO,GIUSEPPE ALLOATTI.Platelet activating factor:the good and the bad in the ischemic/reperfused heart[J].Experimental Biology & Medicine,2011,236(236):390-401.
[3] 黄璐,张根葆,闵志雪,等.蝮蛇毒血小板抑制因子对动脉血栓形成的影响及机制研究[J].中国临床药理学与治疗学,2012,17(12):1355-1360.
[4] YUAN Z,CAI T,TIAN J,etal.Na/K-ATPase tethers phospholipase C and IP3 receptor into a calcium-regulatory complex [J].Mol Biol Cell,2005,16(9):4034-45.
[5] PAUL A,GURBELVICTOR L,SEREBRUANY STEVEN F,etal.Regional and systemic platelet function is altered by myocardial ischemia-reperfusion[J].Journal of Thrombosis and Thrombolysis,1995,1(2):187-194.
[6] ZHOU H,HE XY,ZHUANG SW,etal.Clinical and procedural predictors of no-reflow in patients with acute myocardial infarction after primary percutaneous coronary intervention[J].World Journal of Emergency Medicine,2014,5(2):96-102.
[7] MEINRAD GAWAZ.Role of platelets in coronary thrombosis and reperfusion of ischemic myocardium[J].Cardiovascular Research,2004,61(3):498-511.
[8] 傅洁民.血小板活化因子对血小板的作用[J].生理科学进展,1989,20(1):40-44.
[9] XIA SH,XIANG XH,CHEN K,etal.Roles of BN52021 in platelet-activating factor pathway in inflammatory MS1 cells[J].World J Gastroenterol,2013,19(25):3969-3979.
[10] BITENCOURT CS,BESSI VL,HUYNH DN,etal.Cooperative role of endogenous leucotrienes and platelet-activating factor in ischaemia-reperfusion-mediated tissue injury[J].J Cell Mol Med,2013,17(12):1554-65.
[11] 金鸣,臧宝霞,吴伟,等.芦丁拮抗血小板活化因子与受体结合的作用[J].中草药,2005,36(3):390-392.
[12] 王志彬,张继平.血小板活化因子研究进展[J].公共卫生与预防医学,2008,19(6):46-49.
