聚左旋丙交酯纳米纤维联合骨髓间充质干细胞修复大鼠脊髓损伤的效果
2018-03-19张晓峰段艳伟严怀宁潘永飞
高 锋,张晓峰,段艳伟,严怀宁,潘永飞,叶 荣
脊髓损伤对于当前临床治疗来说是个难点,在既往的临床治疗过程中,特别是所谓“金标准”的自体神经移植,往往会带来诸如供体神经缺少、供区部位损伤及修复效果不理想等并发症[1]。随着组织工程研究的进一步深入,发现了诸如聚羟基丁酸(polyglycolic acid, PGA),聚左旋丙交酯(poly(L-lactic acid), PLLA)等这类高分子材料不仅可以模拟细胞外基质,还可以为细胞的黏附和生长提供良好的环境[2]。在既往的研究中发现,PLLA在体外可促进干细胞的增殖分化,体外对脊髓损伤亦有一定的修复作用。在本研究中,笔者制备了PLLA支架,进一步研究了其体外对细胞的作用及体内脊髓损伤修复的作用。
1 材料与方法
1.1 PLLA纳米纤维膜制备 制备PLLA纤维的溶液配制如下:PLLA和PEO以质量比9∶1混合溶于TFE中,终浓度为2 wt %。将制备好的静电纺丝溶液置于注射器中,注射器一端连接6#不锈钢针头(内径为0.5 mm),另一端与注射泵相连,泵的推进速度为5 ml/h。铝箔作为纳米纤维的接收端,在针头和收集端的距离为20 cm,并施加12 kV的高压直流电,其中针头接正极,收集端接负极。制备的所有纤维都放入真空干燥箱中60 ℃ 24 h去除有机溶剂残留[3]。
1.2 骨髓间充质干细胞的提取 取SD大鼠1只(出生4周左右,雌雄不限,体重150 g左右,江苏省动物实验中心),以2%戊二醛腹腔注射麻醉后,75%乙醇浸泡3 min后,从大鼠股骨下端抽取骨髓,将骨髓与含10%FBS的MEM全培养液以1∶8的体积比例混匀,接种于50 ml培养瓶,于标准培养条件下(5%CO2、37 ℃)培养,2 d后首次换液,以后每3~4 d换1次液。待培养至第12~14 d,细胞覆盖瓶底面积80%左右,用0.1%胰蛋白酶和0.02%的EDTA于标准培养条件下消化5 min,按照1∶3的比例传代培养,以后待细胞基本长满,按上述方法消化传代,从而纯化并扩增BMSCs[4]。
1.3 干细胞培养及活性检测 将制备得到的PLLA纳米纤维支架材料切割为圆形,直径略小于48孔板的孔径,以75%乙醇消毒5 min,然后用0.01 mol/L的PBS洗3遍。将P3 BMSCs(Bone mesenchymal stem cells)制备成5×106/ml的细胞悬液,接种PLLA纳米纤维膜上,利用虹吸原理使BMSCs均匀分布。在培养1、4、7 d后,用细胞计数试剂盒CCK-8(Dojindo,日本)进行检测,CCK-8溶液以1∶10稀释于α-MEM培养液中混匀,每个样品加入220 μl稀释液后于5% CO2培养箱中37 ℃孵育3 h,然后每孔取100 μl液体转移到96孔板中,在微孔板读板仪(Symergy HT,Bio-tek,美国)上读取450 nm波长处吸光值。样品中剩余含CCK-8的培养液弃去,加入新鲜培养液继续培养,可连续测数天的吸光值。实验重复3次,每次每样品设置6个重复。对照组为未在纤维膜上培养的干细胞。
1.4 干细胞向神经方向的分化检测 接种细胞1 d,待细胞与材料融合后,将样品从培养箱中取出,吸除培养液,每孔中加入200 μl事先配制好的RA诱导液(碧云天,中国),乙醇擦拭,放入培养箱中。24 h后在倒置显微镜下观察对照组细胞形态变化,每隔3 d换1次液。于加入RA诱导液后第3、6天,从实验组、对照组进行Nestin、MAP-2抗体(Sigma公司,美国)的免疫荧光染色,观察神经元样细胞的生成情况。实验重复3次,每次每样品设置6个重复。
将所需材料从培养板中取出,放入新的培养板中,用PBS冲洗1次去除残留的溶液。每片材料加入事先配制好的固定液1(2%tritonX-100,0.5%甲醛-PBS溶液)200 μl浸泡5 min,PBS冲洗1次,加入固定液2(4%甲醛-PBS溶液)200 μl浸泡20 min。PBS冲洗3遍去除残留溶液,每孔200 μl加入1%BSA-PBS,置于37 ℃恒温箱中封闭1 h。取出后每孔加入200 ul一抗兔抗大鼠Nestin-IgG,MAP2-IgG(用1%BSA稀释200倍)置于4 ℃冰箱中过夜。取出样品,用PBS漂洗,每孔加入200 μl加入ALexa-Fluor 488标记的羊抗兔二抗(用1%BSA稀释200倍),在避光条件下置于37 ℃恒温箱中孵育1 h。染细胞核,取出样品,PBS漂洗后每孔加入50 μl加入Hoechst 33342(Sigma公司,美国),室温下避光孵育30 mins。最后用PBS漂洗后封片置于光共聚焦显微镜下观察(北爱尔兰Andor公司)。
1.5 大鼠脊髓损伤模型的建立 成年SD大鼠48只,体重200~250 g,雌雄不限,随机分为4组,联合组12只,纤维膜植组12只,干细胞组12只,空白组12只。大鼠以2%戊巴比妥钠(Sigma公司,美国)(2 ml/kg)腹腔麻醉后,俯卧位固定于手术台上,取后正中切口,逐层显露T8-10椎板,行全椎板切除,暴露出硬脊膜,采用改良的Allen重物打击法[5],在硬脊膜表面放置一直径约3.0 mm的圆形垫片,用重10 g的铜制重物沿玻璃导管从25 mm高处垂直自由下落击打在垫片上,造成脊髓损伤。打击后大鼠出现摆尾反射,双下肢及躯体回缩样扑动,麻醉清醒后双下肢弛缓性瘫痪为造模成功。PLLA联合干细胞移植组在造模后在损伤部位周围,植入有干细胞黏附的PLLA纳米纤维膜,PLLA纳米纤维移植组在损伤部位周围,植入PLLA纳米纤维膜,骨髓间充质干细胞移植组在损伤部位周围,植入5 μl的干细胞悬液,密度约105/μl,空白组损伤部位周围,植入5 μl的培养液。逐层缝合切口。术后予以大鼠5万U青霉素肌注预防感染,每日1次,连续3 d,注意保暖,分笼饲养,每天2次行膀胱按摩协助排尿直至建立反射性排尿。
1.6 运动功能评分 于术后2、4、8周对大鼠进行BBB功能评分[6],由非本组实验人员但是熟悉评分标准者完成。
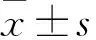
2 结 果
2.1 干细胞的培养和活性检测 无论是否在PLLA纳米纤维膜上的干细胞,在细胞接种后4~6 h,可见有圆形、透亮的细胞贴壁;培养第2~4天可见细胞形态变为长梭形、成纤维细胞样或多角形,呈放射状,形成小集落。当传到第3代时,细胞形态较均一,多为长梭形或纺锤状。CCK-8检测发现在培养后的第1天及第4天,干细胞的增殖两组之间的比较无明显差异,而第7天的时候在PLLA膜上的干细胞增殖是要好于单纯培养的干细胞的(图1)。

图1 BMSCs细胞活性检测图
BMSCs在普通培养皿中以及在PLLA纳米纤维膜上培养1、4、7 d后的CCK-8细胞活性检测,从图中,我们可见在培养后的第1、4天两组之间的细胞活性比较未见明显差异(P>0.05),培养7 d后,在PLLA纳米纤维膜上的BMSCs增殖情况要好于普通培养皿中的BMSCs(P<0.05)
2.2 干细胞向神经方向分化的检测 将P3 BMSCs接种至材料上,加入RA诱导后,于24 h后在倒置显微镜下观察,可见部分细胞胞体开始回缩变小,边缘不规整,突起逐渐伸出,呈不规则或圆形,周边折光性强。第6天时,镜下出现两种形态的细胞,一种细胞体积较小,胞体两侧大多伸长出几个短小和一个较长的突起;另一种细胞体积较大,胞体周围长出很多放射状的突起。未在材料上培养的干细胞,加入RA诱导后,细胞胞体亦开始出现回缩,以及突起伸出,第6天时亦可以观察到两种形态的细胞,但是数量上较材料组要少(图2)。

图2 干细胞向神经细胞方向分化第6天观察图(标尺:100 μm)
A.在材料上干细胞向神经细胞方向的分化,可见较多的细胞有神经样细胞的形态;B.在普通培养皿中干细胞向神经细胞方向的分化,可见神经样细胞较少
将P3 BMSCs接种至材料上,加入RA诱导后,3 d后进行免疫组化观察,可见Nestin染色阳性而MAP-2染色阴性,6 d后观察发现Nestin染色阴性而MAP-2染色阳性,对照组染色与材料组染色情况相似,3 d时可见Nestin染色阳性而MAP-2染色阴性,6 d后观察发现Nestin染色阴性而MAP-2染色阳性,但是无论Nestin染色还是MAP-2染色均少于材料组(图3)。
2.3 大鼠术后运动功能评分 BBB评分详见表1,术后2周,各组之间比较未见明显差异,术后4周,PLLA纳米纤维+干细胞组、PLLA纳米纤维组与干细胞组之间未见明显差异,均优于空白对照组,术后8周,PLLA纳米纤维+干细胞组优于PLLA纳米纤维组及干细胞组,PLLA纳米纤维+干细胞组、PLLA纳米纤维组与干细胞组,均优于空白对照组。

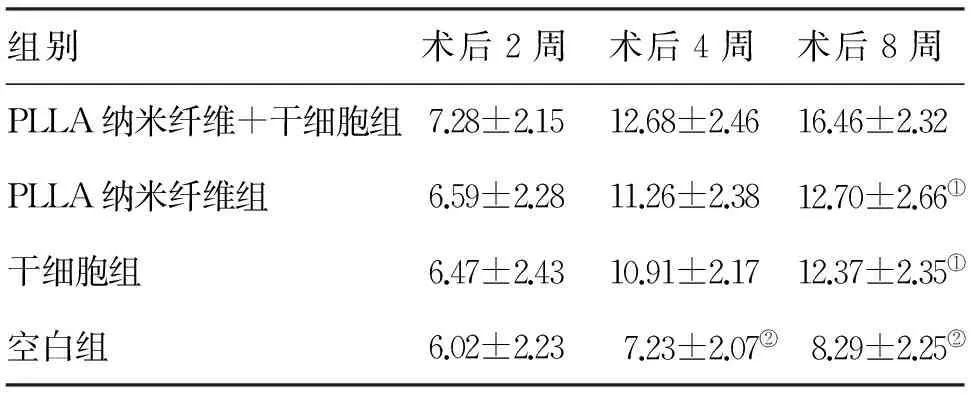
组别术后2周术后4周术后8周PLLA纳米纤维+干细胞组7.28±2.1512.68±2.4616.46±2.32PLLA纳米纤维组6.59±2.2811.26±2.3812.70±2.66①干细胞组6.47±2.4310.91±2.1712.37±2.35①空白组6.02±2.237.23±2.07②8.29±2.25②
注:与PLLA纳米纤维+干细胞组比较,①P<0.05;与另外三组比较,②P<0.05
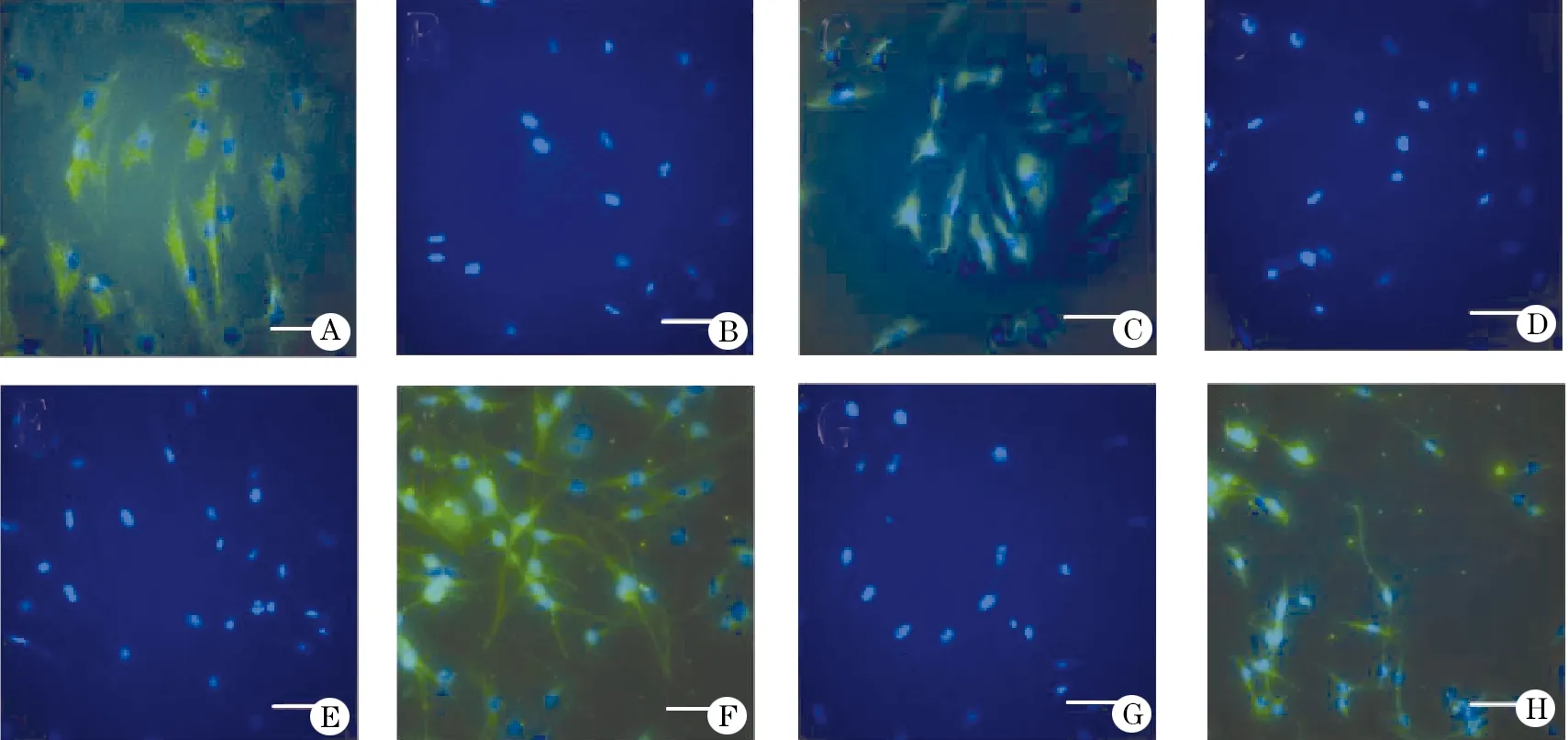
图3 干细胞向神经方向分化的免疫组化图
A.在PLLA纳米纤维膜上的干细胞经RA诱导3 d后的Nestin染色; B.在PLLA纳米纤维膜上的干细胞经RA诱导3 d后的MAP-2染色;C.干细胞经RA诱导3 d后的Nestin染色;D.干细胞经RA诱导3 d后的MAP-2染色;E.在PLLA纳米纤维膜上的干细胞经RA诱导6 d后的Nestin染色;F.在PLLA纳米纤维膜上的干细胞经RA诱导6 d后的MAP-2染色;G.干细胞经RA诱导6 d后的Nestin染色;H.干细胞经RA诱导6 d后的MAP-2染色(标尺:100 μm)
3 讨 论
利用组织工程技术修复受损的脊髓,是近年来发展起来的一项重要的治疗策略。生物材料可以连接受损脊髓的远近端,可以诱导再生的轴突从近端长向远端[7, 8]。理想的支架材料应该具备易于细胞黏附、生物相容性好等特点。PLLA具有优异的生物材料性能,在生物材料领域中被广泛应用[9]。PLLA是一种无毒、可生物降解的高分子生物材料.并且具有良好的生物相容性,其降解最终产物为CO2和H2O,中间产物乳酸也是人体正常的糖代谢产物,目前已在多种组织工程领域中应用[10]。应用静电纺丝技术将PLLA制作成纳米纤维支架材料,具有高孔隙率及高比表面积,有利于细胞生存所需的营养物质的转运,可容纳更多的细胞生存。在脊髓损伤的治疗中,生物支架的主要作用是引导细胞的迁移、增殖、分化及凋亡,且能通过防止瘢痕形成及聚集生长因子而促进神经再生[11]。Matsumoto等[12]研究发现,PLLA合成膜在脊髓组织中有很好的生物相容性和快速的降解率,Li和Shi[13]报道,多孔隙的PLLA导管表面积增加,不但可用于周围神经损伤的修复,对于脊髓损伤也有潜在的应用价值。纳米纤维支架具有较高的比表面积,Ma和Zhang[14]首次利用液一液相分离技术成功地制备出了PLLA三维纳米纤维支架,纤维直径为50~500 nm,这种纳米纤维支架在促进神经元轴突生长,选择性地增加蛋白质吸附,促进成骨细胞分化和矿化方面具有积极的意义。笔者在实验中亦发现在体外实验中,在PLLA纳米纤维材料上的干细胞比在普通培养皿中培养的干细胞有更好的黏附和增殖能力。
有实验发现,神经干细胞与PLLA支架材料复合培养后,神经干细胞在材料表面生长良好且黏附紧密,Hoechst染色显示细胞形态正常,未见明显的凋亡和坏死[15]。神经干细胞在PLLA材料培养14 d后,神经元染色显示细胞分化良好,且神经轴突沿纳米纤维方向生长。类似地,在本研究中,笔者发现体外诱导干细胞分化为神经样细胞的研究中,PLLA膜上的干细胞确实体现了比普通培养皿中的干细胞有更好更快的分化能力。
种子细胞和支架材料在组织工程中是两个重要的要素。因此,种子细胞的选择亦是关键问题。BMSCs是骨髓中的一种具有自我增殖、多向分化潜能的细胞,可分化为成骨细胞、软骨细胞、脂肪细胞、神经细胞和肌细胞。BMSCs来源丰富并且在体外易于分离,提纯和扩增,既避免了自体的免疫排斥反应,又不会引起社会伦理道德问题,同时它也是基因治疗的理想受体细胞。BMSCs移植后可定向、定位分化为各类功能细胞,替代补充缺失细胞的结构和功能,释放神经递质、产生神经营养因子等,促进神经组织再生和抑制神经变性[16],在特定的条件下能分化为神经元和神经胶质细胞[17]。研究显示,神经损伤后 BMSC 移植可上调相关细胞因子的表达,促进神经细胞的再生以及神经细胞的修复从而发挥保护作用,将 BMSC 移植脑缺血再灌注后,BMSCs可促进少突胶质细胞增殖,以及激活 JAK2/STAT3 信号通道以及激活 MAPK 信号通道从而发挥神经保护作用[18]。笔者发现,本研究BMSCs移植在脊髓损伤处对于大鼠脊髓损伤恢复是有一定帮助作用的。但是亦有研究发现,BMSCs移植和分化效率很低,并且体内不一定能向神经细胞分化,另外其存活率也很低,修复效果并不理想[19]。细胞移植与组织工程技术相结合,主要是各种生物支架材料的应用,不仅可以直接填充脊髓损伤的缺损,而且还可以为BMSCs的迁移和贴附生长分化提供良好的微环境[20]。故本研究中,笔者将BMSCs种植于PLLA支架材料上,移植修复大鼠脊髓损伤,具有良好的修复效果。笔者在此研究中只是初步应用BMSCs复合支架材料对大鼠脊髓损伤进行了修复研究,而对于BMSCs种植在PLLA支架材料上,移植进入大鼠脊髓损伤处的生物学行为,以及修复机制等,尚需进一步的研究。
[1] Metin U, Anup D.Sharma,etal.Development of multifunctional films for peripheral nerve regeneration[J].Acta Biomaterialia, 2017(56): 141-152.
[2] 张燕青, 曾园山, 何留民, 等.聚左旋丙交酯纳米纤维支架与大鼠脊髓组织相容性的研究[J].组织工程与重建外科杂志, 2009, 5(3): 143-147.
[3] Lü L X, Zhang X F, Wang Y Y,etal.Effects of hydroxyapatite-containing composite nanofibers on osteogenesis of mesenchymal stem cells in vitro and bone regeneration in vivo[J].ACS Appl Mater Interfaces, 2013,5(2):319-330.
[4] 高 锋, 张晓峰, 段艳伟, 等.经骨髓间充质干细胞诱导分化的神经样细胞移植对大鼠脊髓损伤的修复作用[J].武警医学, 2016, 27(3): 285-288.
[5] Khan T, Havey R M, Sayers S T,etal.Animal models of spinal cord contusion injuries[J].Lab Anim Sci, 1999, 49(2):161-172.
[6] Basso D M, Beattie M S, Bresnahan J C.A sensitive and reliable locomotor rating scale for open-field testing in rats[J].J Neurotrauma, 1995, 12(1):1-21.
[7] Gregory ERutkowski, Carole A.Heath Development of a Bioartificial Nerve Graft.II.Nerve Regeneration in vitro Biotechnol[J].Prog, 2002, 18(2): 373-379.
[8] 张燕青, 曾园山, 何留民, 等.两种高分子支架对骨髓间充质干细胞生长的影响[J].组织工程与重建外科杂志, 2007, 3(6): 305-308.
[9] Kabiri M,Oraee-Yazdani S,Dodel M,etal.Cytocompatibility of a conductive nanofibrous carbon nanotube/poly (L-Lactic acid) composite scaffold intended for nerve tissue engineering[J].EXCLI J,2015,14:851-860.
[10] Guarino V, Causa F, Taddei P.Polylactic acid fibre-reinforced polycaprolactone scaffolds for bone tissue engineering[J].Biomaterials, 2008, 29(27): 3662-3670.
[11] Zhang N, Yah H, Wen X,etal.Tissue-engineering approaches for axonal guidance[J].Brain res rev, 2005, 49(1): 48-64.
[12] Matsumoto M, Chosa E, Nabeshima K,etal.Influence of bioresorhable,unaintered hydroxyapatite/poly-L-lactide composite films on spinalcord, nerve roots, and epidural space[J].J Biomed Mater Res,2002,60(1):101-109.
[13] Li J, Shi R.Fabrication of patterned multi-walled poly-L-lactic acid conduits for nerve regeneration[J].J Neurosci Methods, 2007, 165(2): 257-264.
[14] Ma P X,Zhang R.Synthetic nano-scale fibrous extracellular matrix[J].J Biomed Mater Res, 1999, 46(1): 60-72.
[15] 林成楷, 戎利民, 刘 斌.多壁碳纳米管/聚左旋乳酸复合纳米纤维支架材料与小鼠神经干细胞的生物相容性[J].中国组织工程研究,2017,21(6): 940-945.
[16] Alexanian A R.Epigenetic modifiers promote efficient Generation of neural-like cells from bone marrow-derived mesenchymal cells grown in neural environment[J].J Cell Biochem, 2007, 100(2): 362-371.
[17] Zhang W, Zeng Y S, Zhang X B,etal.Combination of adenoviral vector-mediated neurotrophin-3 gene transfer and retinoic acid promotes adult bone marrow cells to differentiate into neuronal phenotypes[J].Neurosci Lett, 2006, 408(2):98-103.
[18] Bao C, Wang Y, Min H,etal.Combination of Ginsenoside Rg1 and Bone Marrow Mesenchymal Stem Cell Transplantation in the Treatment of Cerebral Ischemia Reperfusion Injury in Rats[J].Cell Physiol Bio-chem, 2015, 37(3): 901-910.
[19] Wei C C, Lin A B, Hung S C.Mesenchymal stem cells in regenerative medicine for musculoskeletal diseases: bench, bedside, and industry[J].Cell Transplant, 2014, 23(4-5): 505-512.
[20] 李 昂, 李 波, 魏志坚, 等.骨髓间充质干细胞治疗脊髓损伤的研究进展[J].中国脊柱脊髓杂志, 2016, 26(1): 90-94.
