乙肝相关肝癌组织中Jagged-1的表达及其临床意义
2018-03-19禹建峰武烨晔吴衢敏郑明生黄腾飞杨国荣
禹建峰,武烨晔,吴衢敏,郑明生,黄腾飞,杨国荣
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内发病率第六、死亡率第三的恶性肿瘤[1]。与西方国家不同,我国肝癌的主要病因是慢性乙型肝炎感染,其新发病例数约占全球总数的50%,且发病率和死亡率呈逐年上升的趋势[2]。根治性肝切除术仍然是乙肝相关肝癌的主要治疗方式之一,但其术后5年的肿瘤复发率约70%,且针对复发肿瘤仍缺少有效的干预手段[3, 4]。因此,当下急需探索可能影响肝癌预后的新分子、新靶点,将其转化应用于临床,以改善肝癌的治疗效果。
Notch信号通路主要由4个受体(Notch-1、Notch-2、Notch-3、Notch-4)和5个配体(Jagged-1、Jagged-2、DLL-1、DLL-3、DLL-4)组成[5]。现阶段Notch信号通路的配体或者受体对于不同类型肝脏恶性肿瘤的具体作用及机制仍不明确[6]。Jagged-1蛋白为Notch的配体之一,文献[7]报道它可能参与了肝癌的进展,其表达可能与西方人群的肝癌预后密切相关,但其与乙肝相关肝癌临床预后的研究甚少。基于此,我们检测了110例乙肝相关肝癌组织及其对应癌旁组织中Jagged-1蛋白的表达情况,并分析了其与临床病理和术后随访资料之间的关系。
1对象与方法
1.1 对象 收集2008-11至2012-06就诊我院并接受肝切除术治疗的肝癌患者110例。其中,男92例(83.6%),女18例(16.4%);平均52.5岁,年龄>50岁的72例(65.5%)。纳入标准:(1)病理证实为HCC;(2)乙肝表面抗原阳性;(3)术前未接受其他任何治疗;(4)无其他恶性疾病病史;(5)肝功能Child-Pugh分级为A或B;(6)无远处转移,主要门静脉或肝静脉未发生肿瘤侵犯。排除标准:(1)长期饮酒史、非酒精性脂肪肝疾病及丙肝抗体阳性等;(2)临床资料不全或术后失访;(3)手术切缘阳性。
根据术前影像学对肿瘤的评估,以及血生化值、CTP评分对肝功能的评价制定肝脏切除方案,如果患者全身情况和肝功能均较好、现有的技术条件下可将肿瘤切除的且术后有足够的肝组织剩余,则对患者实施肝切除术。
1.2 组织芯片蜡块构建 收集患者的癌与癌旁的组织蜡块,经HE染色、芯片的设计、TMA受体蜡块的制备、TMA模块的处理、组织阵块切片及质检等工序后,最终构建成组织芯片。
1.3 免疫组织化学染色 检测Jagged-1蛋白在肝细胞癌组织及其对应癌旁组织的表达:组织芯片经过拷片、脱蜡、梯度脱水、高压抗原修复、阻断内源性过氧化物酶、血清封闭、一抗孵育、二抗孵育、DAB显色及苏木精复染后,采用双盲法由两位研究者对结果进行组织芯片评分。评分标准如下:阴性为未染色,阳性为细胞浆染棕黄色,PBS液代替一抗设空白对照。高倍镜下观察4个视野,计数200个细胞,按阳性细胞的百分比进行评分(0分,全阴性或阳性细胞≤5%;1分,阳性细胞6%~20%;2分,阳性细胞21%~50%;3分,阳性细胞>50%)。定义0分和1分为低表达组,2分和3分为高表达组。
1.4 随访和观察终点 患者术后第1年每月随访一次,随后每3~6个月随访一次。随访时,常规检查全血细胞计数、凝血功能、肝功能、乙肝病毒抗原和抗体、乙肝病毒DNA定量和甲胎蛋白(Alpha fetoprotein,AFP)水平,常规进行腹部超声,CT和(或)MRI每6个月进行一次,如果怀疑有肿瘤复发或远处转移则会进一步检查。肿瘤复发的诊断标准同最初HCC的诊断标准,复发的肿瘤采取外科手术、介入和索拉菲尼等治疗手段。本研究随访观察截止日期为2017年6月,患者死亡或肿瘤复发作为终点事件,总体生存的计算是从手术到死亡或者最后一次随访,肿瘤复发是从手术到术后第一次诊断复发或转移。入组患者未见非肿瘤死亡病例。
1.5 统计学处理 采用R语言进行统计学分析。连续变量采用Studentt检验,分类变量采用χ2检验,非正态分布资料采取Mann-Whitney秩检验。寿命表法计算入组患者术后的复发率及生存率;生存或复发曲线由Kaplan-Meier法绘制。P<0.05为差异有统计学意义。
2 结 果
2.1 乙肝相关肝癌组织及对应癌旁组织中Jagged-1蛋白的表达 Jagged-1蛋白阳性染色主要位于胞浆中,肝癌组织中Jagged-1蛋白高表达率(44.5%)显著高于对应癌旁组织(22.3%)(χ2=12.16,P<0.0001,图1)。

图1 乙肝相关肝癌组织及其对应癌旁组织中Jagged-1蛋白的表达
A.癌旁组织(SP,×40); B. 癌组织(低表达组)(SP,×40); C.癌组织(高表达组)(SP,×40);D. 癌旁组织(SP,×400); E. 癌组织(低表达组)(SP,×400); F. 癌组织(高表达组)中的表达(SP,×400)
2.2 Jagged-1蛋白的表达水平与乙肝相关肝癌患者临床病理特征的关系 Jagged-1高表达和低表达组乙肝病毒DNA载量、总胆红素、白蛋白、凝血酶原时间、丙氨酸氨基转移酶、甲胎蛋白、肝硬化、肿瘤个数、BCLC分期等方面无统计学差异,仅MVI这项有统计学差异,高表达组的MVI发生率高于Jagged-1蛋白低表达组(75.5%vs41.0%,P<0.001,表1)。
2.3 Jagged-1蛋白的表达水平与乙肝相关肝癌患者临床预后的关系 Jagged-1蛋白高表达组与低表达组的1、3、5年总体生存率分别是87.5%、64.1%、46.5% 和 96.7%、84.5%、66.9%,差异有统计学意义(P=0.0139);1、3、5年肿瘤复发率为29.8%、53.6%、65.5% 和18.7%、39.9%、53.8%,差异无统计学意义(P=0.0903, 图2)。
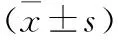
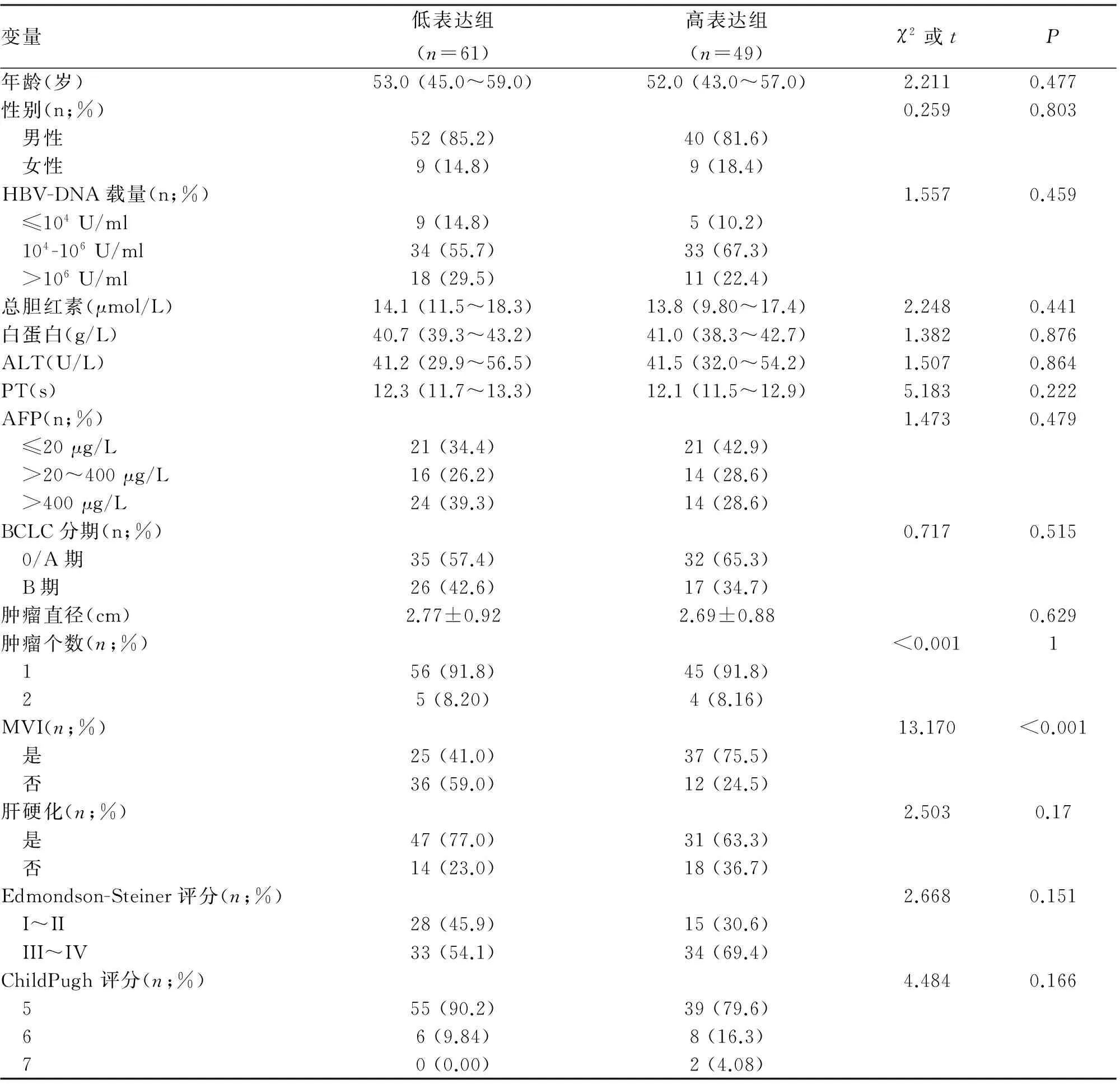
变量低表达组(n=61)高表达组(n=49)χ2或tP年龄(岁)53.0(45.0~59.0)52.0(43.0~57.0)2.2110.477性别(n;%)0.2590.803 男性52(85.2)40(81.6) 女性9(14.8)9(18.4)HBV-DNA载量(n;%)1.5570.459 ≤104U/ml9(14.8)5(10.2) 104-106U/ml34(55.7)33(67.3) >106U/ml18(29.5)11(22.4)总胆红素(μmol/L)14.1(11.5~18.3)13.8(9.80~17.4)2.2480.441白蛋白(g/L)40.7(39.3~43.2)41.0(38.3~42.7)1.3820.876ALT(U/L)41.2(29.9~56.5)41.5(32.0~54.2)1.5070.864PT(s)12.3(11.7~13.3)12.1(11.5~12.9)5.1830.222AFP(n;%)1.4730.479 ≤20μg/L21(34.4)21(42.9) >20~400μg/L16(26.2)14(28.6) >400μg/L24(39.3)14(28.6)BCLC分期(n;%)0.7170.515 0/A期35(57.4)32(65.3) B期26(42.6)17(34.7)肿瘤直径(cm)2.77±0.922.69±0.880.629肿瘤个数(n;%)<0.0011 156(91.8)45(91.8) 25(8.20)4(8.16)MVI(n;%)13.170<0.001 是25(41.0)37(75.5) 否36(59.0)12(24.5)肝硬化(n;%)2.5030.17 是47(77.0)31(63.3) 否14(23.0)18(36.7)Edmondson-Steiner评分(n;%)2.6680.151 I~II28(45.9)15(30.6) III~IV33(54.1)34(69.4)ChildPugh评分(n;%)4.4840.166 555(90.2)39(79.6) 66(9.84)8(16.3) 70(0.00)2(4.08)
注:HBV-DNA,乙肝病毒DNA;ALT,丙氨酸氨基转移酶;PT,凝血酶原时间;AFP,甲胎蛋白;BCLC分期,巴塞罗那临床肝癌分期;MVI,微小血管侵犯。表1中非正态分布的数据使用中位数(四分位数间距)表达

图2 乙肝相关肝癌术后Jagged-1高表达组与低表达组患者的总体生存率和肿瘤累积复发率曲线
3 讨 论
Notch信号通路作用广泛,它不仅在正常细胞的增殖、分化及凋亡等方面发挥了作用,而且还参与了肿瘤新生血管的生成和远处转移[8]。在肝脏研究领域,Notch信号通路已经被证实可能与肝脏血管、胆管的发育密切相关,而且还参与了肝脏损伤的修复过程[9]。但是,它对于肝细胞癌的具体作用和机制仍存在争议:有一些研究认为,它可能促进了HCC的发生发展;而另一些研究则认为,它可能抑制了HCC的进展[10]。关于Jagged-1蛋白相关研究主要集中在西方人群,而我国肝细胞癌患者的病因与西方不同,主要以慢性乙型病毒性肝炎为主。已有研究报道乙型肝炎X蛋白可能通过活化Notch信号通路,从而参与了乙肝相关肝癌的进展[11]。鉴于Notch通路上不同配体和受体所激活的下游信号通路在HCC中发挥的作用是各不相同的[12],因此我们课题组挑选了Jagged-1蛋白作为研究对象。本研究的结果也发现了乙肝相关性肝癌组织中Jagged-1蛋白的表达水平升高,且与患者的临床预后密切相关。
本研究结果显示,Jagged-1蛋白在部分肝癌组织中较癌旁组织呈相对高表达,并且Jagged-1高表达患者的1、3、5年生存率低于Jagged-1表达水平低的患者,提示Jagged-1蛋白在乙肝相关肝癌组织中的表达水平与临床预后相关。2013年, Razumilava等[13]提出了以Notch信号通路中被激活的不同配体或者受体作为分子标志物,从分子层面对肝脏恶性肿瘤进行重新分型。而本研究结果也显示了Notch信号通路的配体Jagged-1蛋白有希望作为一种新的肝脏肿瘤标志物应用于临床的诊断分型、精准治疗及预后分析等。
本研究结果还显示,Jagged-1蛋白的表达水平与患者肝癌组织的MVI相关。肝癌的MVI指仅在镜下可见的肝癌细胞侵犯门静脉、肝静脉或其他由血管内皮细胞包绕的微血管,切除标本的总体发生率21%~57%[14]。肝细胞癌高转移高复发的特性是影响其远期疗效的主要瓶颈,而MVI是导致肝癌术后肿瘤复发的重要危险因素[15]。文献[7, 16]报道,Jagged-1蛋白可能参与了HCC的发生发展,并与肝脏血管的发育形成密不可分。肝细胞癌是人体最富含血管的恶性肿瘤,现阶段以索拉菲尼为代表的抑制血管生成的药物已广泛应用于临床,并取得了一定疗效。至今已经有多种Notch信号通路相关的小分子抑制剂和单抗药物正处于临床前或早期临床研究阶段,其中Jagged-1的单抗药物已经进入了肝纤维化疾病的Ⅰ期临床实验,并展示了出了良好的应用前景[17]。因此,本研究预示以Jagged-1为靶点的相关治疗将同索拉菲尼等抑制血管生成药物一样,未来将会在肝细胞癌治疗领域有所建树。
本研究存在以下不足:(1)样本量偏小,需要多中心的临床研究进一步证实我们的研究结果。(2)本研究利用组织芯片进行免疫组化染色,仅从蛋白水平检测Jagged-1的表达。未来还需要通过体内外实验,从DNA水平、mRNA水平及蛋白水平等多方面对Jagged-1蛋白的功能和作用机制进行深入研究。(3)组织芯片上的肿瘤组织仅为原发肿瘤的一部分,鉴于肿瘤的异质性,组织芯片中Jagged-1的表达水平尚不能完全代替肿瘤整体的表达水平。
综上所述,Jagged-1蛋白在乙肝相关肝癌组织中的表达水平增高,且与不良的临床预后密切相关,它可能在肝癌的MVI发生发展过程中起到重要作用。此项研究为Jagged-1蛋白的临床转化及应用奠定了理论基础。
[1] Forner A, Llovet J M, Bruix J. Hepatocellular carcinoma [J]. Lancet, 2012, 379(9822): 1245-1255.
[2] Chen W,Zheng R,Baade P D,etal.Cancer statistics in China, 2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Bruix J, Sherman M, American Assocition For The Study of Liver D. Management of hepatocellular carcinoma: an update [J]. Hepatology, 2011, 53(3): 1020-1022.
[4] Poon R T. Prevention of recurrence after resection of hepatocellular carcinoma: a daunting challenge [J]. Hepatology, 2011, 54(3): 757-759.
[5] Andersson E R, Sandberg R, Lendahl U. Notch signaling: simplicity in design, versatility in function [J]. Development, 2011, 138(17): 3593-3612.
[6] Gil-Garcia B, Baladron V. The complex role of NOTCH receptors and their ligands in the development of hepatoblastoma, cholangiocarcinoma and hepatocellular carcinoma [J]. Biol Cell, 2016, 108(2): 29-40.
[7] Tschaharganeh D F, Chen X, Latzko P,etal. Yes-associated protein up-regulates Jagged-1 and activates the Notch pathway in human hepatocellular carcinoma [J]. Gastroenterology, 2013, 144(7): 1530-1542.
[8] Hori K, Sen A, Artavanis-Tsakonas S. Notch signaling at a glance [J]. J Cell Sci, 2013, 126(Pt 10): 2135-2140.
[9] Geisler F, STtrazzabosco M. Emerging roles of Notch signaling in liver disease [J]. Hepatology, 2015, 61(1): 382-392.
[10] Viatour P, Ehmer U, Saddic L A,etal. Notch signaling inhibits hepatocellular carcinoma following inactivation of the RB pathway [J]. J Exp Med, 2011, 208(10): 1963-1976.
[11] Gao J, Xiong Y, Wang Y,etal. Hepatitis B virus X protein activates Notch signaling by its effects on Notch1 and Notch4 in human hepatocellular carcinoma [J]. Int J Oncol, 2016, 48(1): 329-337.
[12] Greenhill C. Liver cancer: different effects of the Notch receptors in liver cancer revealed [J]. Nat Rev Gastroenterol Hepatol, 2014, 11(12): 703.
[13] Razumilava N, Gores G J. Notch-driven carcinogenesis: the merging of hepatocellular cancer and cholangiocarcinoma into a common molecular liver cancer subtype [J]. J Hepatol, 2013, 58(6): 1244-1245.
[14] Goessling W. Deciphering hepatocellular carcinoma: from bench to bedside and back [J]. Gastroenterology, 2009, 137(3): 786-788.
[15] Dupont Bierre E, Compagnon P, Raoul J L,etal. Resection of hepatocellular carcinoma in noncirrhotic liver: analysis of risk factors for survival [J]. J Am Coll Surg, 2005, 201(5): 663-670.
[16] Mccright B, Lozier J, Gridley T. A mouse model of Alagille syndrome: Notch2 as a genetic modifier of Jag1 haploinsufficiency [J]. Development, 2002, 129(4): 1075-1082.
[17] Morell C M, Strazzabosco M. Notch signaling and new therapeutic options in liver disease [J]. J Hepatol, 2014, 60(4): 885-890.
