槲皮素对缺氧人肝癌细胞HepG2增殖及HIF-1α、VEGF的影响
2018-03-19陆艳玲王荣荣冯胜进
韦 艳,陆艳玲,王荣荣,冯胜进,梁 钢
肝细胞癌是严重影响人类生命健康的恶性肿瘤之一。肝癌细胞的快速增殖及耗氧量使细胞处于低氧的微环境中,低氧环境所启动的低氧诱导因子HIF-1α是重要的核转录因子,能调控涉及肿瘤增殖和转移、血管生成、能量代谢等相关下游基因的转录和翻译[1,2]。血管表皮生长因子(vascular endothelial growth factor,VEGF)是HIF-1α重要的靶基因之一,是促进肿瘤血管生长的重要因子,目前,研究以HIF-1α /VEGF信号通路为靶点的抗肿瘤药物已成为热点,槲皮素是一种广泛存在于自然界的黄酮类化合物,已有大量的体内外研究证实槲皮素可通过多种机制抑制肿瘤细胞增殖、诱导分化、促进凋亡发挥其抗肿瘤活性[3-5],本实验通过模拟低氧环境,测定槲皮素对肝癌细胞HepG2增殖能力、HIF-1α以及VEGF表达的影响,探讨其可能的机制。
1 材料与方法
1.1 材料 人肝癌细胞HepG2保种于广西医科大学实验中心,槲皮素(纯度>99%)购自成都曼思特生物科技有限公司,胰蛋白酶购自美国Hyclone 公司,胎牛血清购自杭州四季青公司, 四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)均购自美国Sigma 公司;兔抗人多克隆抗体HIF-1α、VEGF为Santa Cruz产品,总RNA提取试剂盒购自北京天根生化科技公司,反转录试剂盒和Real-time PCR 试剂盒购自大连TaKaRa 公司,PCR 引物由上海生工公司合成,实时定量荧光PCR 检测仪为美国Applied Biosystems公司,酶标仪为美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 HepG2于含10%胎牛血清的RPMI 1640 培养液中,37 ℃,5%CO2培养, 相差倒置显微镜观察细胞生长情况,0.25%胰酶消化传代,取对数生长期细胞用于实验。采用化学缺氧诱导剂CoCI2模拟缺氧微环境,加入培养液的终浓度为150 μmoI/L。
1.2.2 MTT法检测细胞增殖能力 分组:正常对照组,缺氧组(化学缺氧剂CoCl2加入培养液的终浓度为150 μmol/L,模拟低氧微环境),缺氧+槲皮素组 (槲皮素为37.8 μmol/L,该槲皮素的浓度为48 h对细胞10%抑制率浓度)取对数生长期的HepG2细胞悬液以1×105个/ML的浓度接种于96孔培养
板,每孔100 μl,培养12 h,加入作用药物,每孔终体积200 μl,再分别培养12、24、48、72 h,终止培养后每孔加入5 mg/ml MTT 20 μL,继续培养4 h,弃培养液,每孔加入DMSO 150 μl震荡15 min,酶标仪测定波长492 nm处光密度值,实验不同日重复3次。
1.2.3 Real-time PCR检测HIF-1α、VEGF mRNA表达 实验分组同MTT法,各组细胞均培养48 h。按trizol说明书提取细胞总RNA,测定RNA纯度及浓度,反转录试剂盒合成cDNA。引物序列:β-actin正义引物5′-GCATGTACGACAGAGCCGTACGC-3′, 反义引物5′TCAACGCAGACATATCCAGC-3′长度为263 bp,HIF-1α 正义引物5′-CAGTACACACAGCGTACGC-3′长度为175 bp,反义引物5′TCAAGCCAGACATATGCACC-3′。VEGF正义引物5′-TGAC-TTGACTCGAGTCCTG-3′, 反义引物5′-TACGTCCT-AGCCGAGATCG-3′长度为206 bp,运用ABI PRISM7900 PCR仪进行扩增。反应程序: 条件为95 ℃ 2 min(1个循环),90 ℃ 20 s,55 ℃ 30 s,68 ℃ 50 s(40个循环),采用2-ΔΔCt法计算检测基因mRNA 的相对表达量,实验不同日重复3次。
1.2.4 Western Blot检测HIF-1α、VEGF蛋白表达 实验分组同MTT法,各组细胞均培养48 h。蛋白裂解液提取各组细胞总蛋白,bradford法测定蛋白质浓度。定量后进行SDS-PAGE垂直电泳,湿法PVDF转膜,5%脱脂牛奶封闭过夜,4 ℃与一抗稀释液(1∶200)孵育过夜,TBST清洗3次,与二抗稀释液孵育2 h, ECL发光,显影,扫描后应用quanity-one软件进行分析。
1.2.5 统计学处理 应用SPSS 16.0 软件进行统计分析,采用方差分析,多组资料两两比较采用LSD-t 多重检验,P<0.05为差异有统计学意义。
2 结 果
2.1 MTT法检测细胞增殖能力 各组细胞光密度值如表1,各组细胞增殖能力如图1,在12 h时,各组细胞光密度值差异无统计学意义,即各组细胞在12 h增殖能力无差异。在24、48、72 h,各组细胞光密度值差异均有统计学意义(P<0.05),缺氧组细胞增殖能力较正常对照组降低,与缺氧组比较,缺氧+槲皮素组在24、48、72 h细胞增殖能力降低。
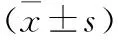

时间(h)正常对照组缺氧组缺氧+槲皮素组F120.369±0.0120.354±0.0130.351±0.0240.903240.640±0.0160.551±0.021①0.435±0.023②78.354481.287±0.0250.851±0.028①0.717±0.013②494.601721.738±0.0271.268±0.018①0.984±0.037②535.436
注:与正常对照组比较, ①P<0.05, 与缺氧组比较, ②P<0.05
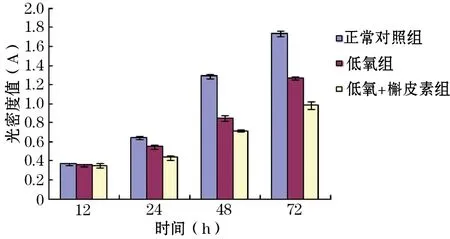
图1 各组细胞增殖能力的比较
2.2 各组细胞HIF-1α、VEGF mRNA表达 与正常组比较,HepG2细胞在低氧状态下HIF-1α、VEGF mRNA表达上调(P<0 05),槲皮素作用后VEGF mRNA表达下调(P<0 05),对HIF-1α mRNA表达无影响,各组基因相对表达量见表2。
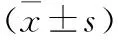
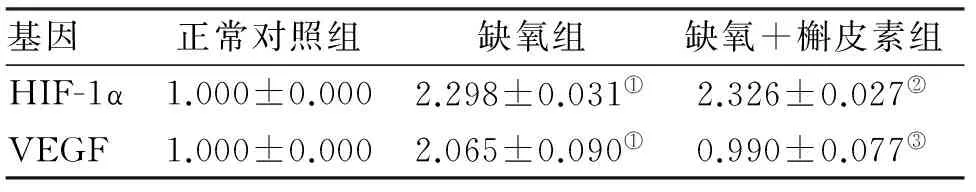
基因正常对照组缺氧组缺氧+槲皮素组HIF-1α1.000±0.0002.298±0.031①2.326±0.027②VEGF1.000±0.0002.065±0.090①0.990±0.077③
注:与正常组比较,①P<0.05;与缺氧组比较,②P>0.05;与缺氧组比较,③P<0.05
2.3 Western Blot检测HIF-1α、VEGF蛋白表达 各组细胞HIF-1α 、VEGF蛋白相对表达量见表3,蛋白表达区带见图2。在低氧状态下HepG2细胞HIF-1α 、VEGF 蛋白表达上调(P<0.05),槲皮素作用后对低氧细胞中HIF-1α蛋白表达无影响,而下调VEGF 蛋白表达(P<0.05)。
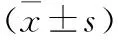
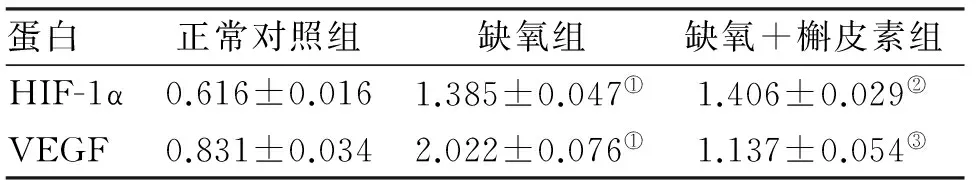
蛋白正常对照组缺氧组缺氧+槲皮素组HIF-1α0.616±0.0161.385±0.047①1.406±0.029②VEGF0.831±0.0342.022±0.076①1.137±0.054③
注:与正常组比较,①P<0.05;与缺氧组比较,②P>0.05;与缺氧组比较,③P<0.05

图2 各组细胞HIF-1α 、VEGF蛋白表达区带
3 讨 论
HIF-1α是低氧诱导因子家族中受到氧浓度调节的主要因子,在缺氧情况下,HIF-1α的泛素-蛋白酶体降解途径被阻断导致其在细胞内蓄积,从而启动下游因子的转录与翻译。VEGF是受HIF-1α调控的下游因子之一,HIF-1α与VEGF的缺氧反应元件结合后启动其转录与翻译,使其相关产物表达增加。VEGF作为血管生长重要的诱导因子之一,对促进细胞增殖,抑制细胞凋亡等作用具有重要意义。CoCl2是较常用的低氧模型诱导剂,该实验通过CoCl2诱导建立肝癌细胞HepG2缺氧的微环境,HepG2细胞在CoCl2诱导下, HIF-1α与VEGF表达均上调,达到了建立缺氧模型的目的。
在常氧环境下,槲皮素通过多种机制对肝癌细胞的增殖、迁移、侵袭具有抑制作用[6,7],但是在缺氧环境中槲皮素对肝癌细胞影响的研究较少。本实验结果表明,在低氧环境中,槲皮素可抑制肝癌HepG2细胞的增殖,并且降低细胞中高表达的VEGF。肝癌细胞的生长、浸润和转移依赖于其肿瘤血管生成,许多实验研究都呈现了VEGF 在肝癌组织及细胞中高表达的情形。VEGF 能通过旁分泌形式特异性作用于血管内皮细胞,通过增加血管通透性,使血浆蛋白外渗并与其他蛋白结合形成纤维网络,最终形成血管化的结缔组织,并且作为内皮细胞特异性的有丝分裂原,通过与内皮细胞膜上Flt1和Flk1/KDR两个特异性受体结合,直接刺激内皮细胞分裂增殖,诱导新血管生成[8]。目前已有研究表明,槲皮素可通过调控VEGF的表达抑制肿瘤细胞的生长,有研究者通过MTT及Transwell 小室模型实验发现槲皮素体外可抑制肾癌细胞ACHN的增殖和侵袭能力,并且可下调VEGF蛋白的表达,从而推测槲皮素对VEGF蛋白表达的影响可能是其抑制ACHN增殖的机制[9]。在体外槲皮素还能抑制白血病细胞NB4生长并诱导其凋亡,同时可抑制白血病细胞分泌VEGF[10]。因此槲皮素通过下调VEGF表达抑制肿瘤血管生长可能成为其抗肿瘤的新通道。实验结果还显示槲皮素在低氧环境下对HIF-1α基因与蛋白的表达差异无统计学意义,可能在低氧环境下槲皮素对肝癌细胞中高表达的HIF-1α无调控作用。首先,槲皮素对低氧环境中肝癌细胞增殖的抑制作用可能是通过降低VEGF的表达实现的,而与HIF-1α表达无关,槲皮素可能没有通过HIF-1α /VEGF信号通路调节VEGF的表达。其次,除了HIF-1α之外,VEGF还可受多个上游基因的调控,如环氧化酶(COX-2),蛋白激酶B(AktB),内皮抑素(ES)等[11-13],槲皮素可能通过其他信号通路间接影响了VEGF的表达。最后,本次实验采用的槲皮素作用浓度为细胞10%抑制率浓度,可能该浓度还未足以刺激细胞中HIF-1α达到转录及翻译的水平改变,致使低氧细胞中下HIF-1α mRNA 及蛋白表达无差异。
总之,本实验研究观察到了槲皮素体外低氧环境中对人肝癌细胞HepG2增殖力的抑制作用,并且下调VEGF的表达,可能是槲皮素抑制肿瘤细胞生长的又一个机制。
[1] Semenza G.Signal transduction to hypoxia-inducible factor1 [J].Biochemical pharmacology ,2002,64(8):993-998.
[2] Ellis L,Hammers H,Pili R.Targeting tumor angiogenesis with histone deacetylase inhibitors [J].Cancer Lett,2009,280(2):145-153.
[3] Ma L,Feugang J M,Konarske P,etal.Growth inhibitory effects of quercetin on bladder cancer cell [J].Front Biosci,2006,11(9):2275-2285.
[4] Bishayee K,Ghosh S,Mukherjee A,etal.Quercetin induces cytochromec release and ROS accumulation to promote apoptosis and arrest the cesscycle in G2/M,in cervical carcinoma:signal cascadeand drug-DNA in- teraction[J].Cell Profif ,2013,46(2):153-163.
[5] Borska S,Chmielewska M,Wysocka T,etal.In vitro effect of quercetin on human gastric carcinoma:Targeting cancer cells death and MDR[J].Food Chem Toxicol,2012,50(9):3375-3383.
[6] 刘 锋,李 刚,胡明道,等.槲皮素对人肝癌高转移细胞生长及侵袭能力的影响[J].昆明医科大学学报,2014,35(5):29-32.
[7] 史桂兰,黄 琳,卿海燕,等.槲皮素对人肝癌SMMC-7721 细胞生长抑制及诱导凋亡作用[J].中国实验诊断学,2015,19(1):17-19.
[8] Hicklin D J,Ellis L M.Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis [J] .J Clin Onco,2005,23(5):1011-1027.
[9] 范宗荣,张志强,于德新,等.槲皮素对人肾癌细胞株细胞增殖、侵袭及其VEGF表达的影响[J].安徽医科大学学报,2012,47(8):887-889.
[10] 钟 璐,陈芳源,王 海,等.槲皮素在体外对NB4细胞形态及VEGF分泌的影响[J] .中华肿瘤杂志,2006,28(1):25-27.
[11] Shi X Y,Xi L,Weng D H,etal.Clinicopathological Significance of VEGF-C,VEGFR-3 and Cyclooxygenase-2 in Early-Stage Cervical Cancer[J].International Journal of Biomedical Science,2008,4(1):58-63.
[12] Zhang H,Fagan D H,Zeng X,etal.Inhibition of cancer cell proliferation and metastasisbyinsulinreceptor down regulation[J].Oncogene,2010,29(17):2517-2527.
[13] Huszthy P C,Brekken C,Pedersen T B,etal.Antitumor efficacy improved by local delivery of species-specific endostatin[J] .Neurosurg,2006,104(1):118-128.
