沉水植物在富营养化水体原位生态修复中的功能
2018-03-17张之浩吴晓芙
张之浩,吴晓芙 ,李 威
(中南林业科技大学 a.生命科学与技术学院,b. 环境科学与工程学院,湖南 长沙 410004)
原位生态修复技术最早应用于土壤修复工程中,因其具有低成本、无能耗、少管理、生态景观效果好的特点,加之能在污染现场就地治理更大面积的污染,近年来已被广泛应用于湖泊、内河、景观水等地表水面源污染的治理工程[1]。
目前,国内外常见的原位生态修复技术中通常是将不同的沉水植物和挺水植物搭配使用,这是为了提供水下更丰富的生态位和更宽泛的环境温度适应性[2],从而构建更稳定、持久、协调的水生生态系统。沉水植物能将水体中的氮、磷等作为营养物质直接吸收[3]、能通过光合作用提高水体中的溶解氧、能增加水下生态位从而抑制悬浮物[4]等特点使其在原位生态修复技术中不可或缺。此外沉水植物还可以向水体中释放化感物质从而抑制浮游藻类的生长[5],从而达到更佳的净水效果。而现阶段,研究多集中在挺水植物的去污应用研究,沉水植物的去污抑藻效率研究却鲜见报道,仅有的研究也多在实验室内完成,实验影响因素设计较为单一[6-14],很难为日后的实际工程应用提供理论依据。而本研究设计的中试试验完全在植物自然生存环境下开展,以典型富营养化水体为原水,对6种中南地区常见的沉水植物开展了耐污与去污抑藻能力对比研究。
1 材料与方法
1.1 测试植物
沉水植物分别采用苦草Vallisneria natans、金鱼藻Ceratophyllum demersum、轮叶黑藻Hydrilla verticillata、狐尾藻Myriophyllum verticillatum、伊乐藻Elodea canadensis和菹草Potamogeton crispus6种。均为中南地区常见的水生景观植物,分别购置于湖北洪湖某育苗基地或采于湖南长沙某人工湿地,后于苗圃开放空间内的玻璃缸中进行扩大培养。
1.2 实验用水
用于耐污与去污能力比较的实验所采用的原水取自某大学校区生活污水,稀释到预设浓度范围后加入容器备用。为凸显低浓度暴露实验下沉水植物对蓝绿藻生长的抑制效应,原水中加入采自于某景观塘的富营养化水[15-16],以提供蓝绿藻,其主要污染物浓度如表1所示。

表1 原水主要污染物浓度Table 1 Pollutant concentration of experimental wastewater (mg/L)
1.3 实验方法
实验采用玻璃水箱的规格为60 cm×50 cm×40 cm,植物试样苦草、金鱼藻、轮叶黑藻、狐尾藻、伊乐藻和菹草各设置3个重复,生物浓度设置为10 g/L 。空白对照组3个重复,共7组21个处理。植物先在清水中种植,每天加入等量原水以提供营养,经耐污培养,观察植物生长正常后开始取水样测定。
实验在苗圃内的开放空间进行,实验周期内气温保持在14~25 ℃范围内。实验开始一周左右测定其耐性生理酶指标:脯氨酸、丙二醛,完成一个试验周期后,测定植物生物量、株高、根系长度与数量。实验过程中,每隔7天(7、14、21、28 d)取样一次,测定指标包括:TN、TP、COD、SS、NH3-N和叶绿素a(mg/L)值、气温、pH值、DO等数据。为消除水分蒸发对试验效果的影响,实验各阶段采样后均以纯水补充,以保证各组水箱水位相同。
1.4 数据测定与分析
沉水植物生长适应性指标(株高、根系数和根系长度)将采用3株植物的平均值计算;耐性生理特性指标:脯氨酸用电位滴定法测定、MDA用TBA法测定。常规水质指标:pH值和DO用便携检测仪现场测定, COD、TN、TP、NH3-N 、SS和叶绿素a均采用国标法在实验室检测。实验数据采用了Microsoft Excel 2007软件统计及计算,单因素方差分析采用SPSS 19.0统计软件计算,绘制图表采用Sigma Plot12.5软件。
2 结果与分析
2.1 沉水植物的耐污能力
脯氨酸和丙二醛(MDA)含量是植物抗性生理研究中的常用指标,可以作为沉水植物耐污能力比较的重要指标[17]。从脯氨酸的含量来看(见图1),初始浓度较高的是金鱼藻,黑藻、狐尾藻和伊乐藻,苦草和菹草脯氨酸的初始浓度较低;试验后期,金鱼藻脯氨酸的含量降幅最大,其次是苦草、狐尾藻和黑藻,而菹草的脯氨酸含量较初始浓度有较大增幅。从丙二醛的含量来看,狐尾藻、苦草、金鱼藻和黑藻均保持较高水平,后期降幅较大的是狐尾藻、黑藻和苦草。综合来看,实验初期金鱼藻和黑藻对水体富营养胁迫有较高的耐性(即抗逆性),苦草和狐尾藻次之;而到了实验末期,狐尾藻、苦草、金鱼藻和黑藻的脯氨酸和MDA含量均出现大幅下降,表现出良好的适应性。而菹草的脯氨酸和丙二醛指标含量均呈上升趋势,表现为对污水环境的不适应性。
植物生长情况(见图2)也是衡量植物对污水适宜性的一个重要指标。从沉水植物的整体生物量增加来看,狐尾藻、轮叶黑藻、苦草增加量最大:狐尾藻为414.1 g,轮叶黑藻为359.8 g,苦草为353.7 g。从植物株高变化来看,金鱼藻、菹草和黑藻增加量最大,金鱼藻为1.67倍、菹草为1.62倍,黑藻为1.58倍。从根系长度来看,金鱼藻、黑藻和狐尾藻的根系长度净增量最明显,分别是6.4、5.8和4.6 cm。从根系数量来看,根系较多的植物是苦草和菹草,但菹草对污水的适应性较差,完成1个试验周期后根系数量增加量很少,而苦草、黑藻和伊乐藻的根系数增量最大,分别是11根、9根和8根。
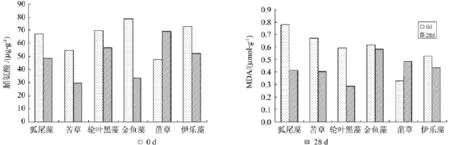
图1 6种沉水植物的脯氨酸和丙二醛含量Fig.1 The praline and MDA content of 6 species of aquatic plants
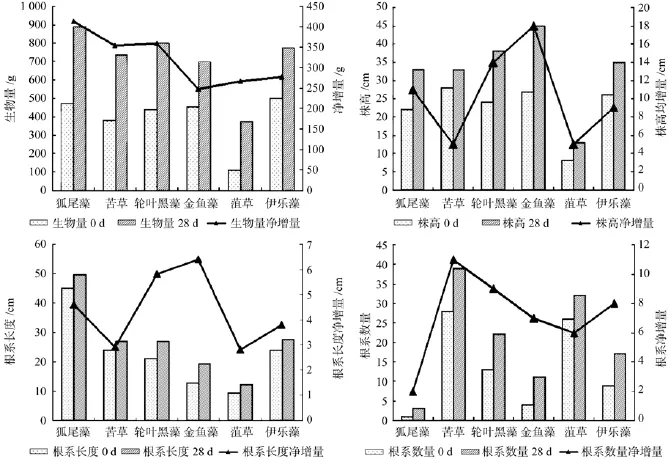
图2 6种水生植物的生长适应性比较Fig.2 Comparison of growth adaptability of six species of aquatic plants
2.2 沉水植物的去污效应
由图3可知,6种沉水植物对种植水体中COD的去除效果均比较明显,且在实验后期与对照组形成显著差异。而6种沉水植物之间COD的去除效果差异不大,其中金鱼藻、黑藻和狐尾藻对COD的去除果较好,分别为67.11%、66.85%和66.44%。
由图4可知,6种沉水植物对种植水体中NH3-N的去除率均明显高于对照组,且去除过程较为一致。由图可以看出,在实验开始阶段(0~7 d)6种沉水植物对NH3-N的去效率更为明显,之后(7~28 d)由于原水中NH3-N浓度的降低使得对其的去除效率也渐放缓,其中去除率最高的3种沉水植物分别是黑藻81.31%、苦草81.20%和金鱼藻80.58%。
由图5可以看出,TN的浓度随时间的变化与NH3-N的曲线相似,实验初期(0~7 d)即开始急剧下降,在后期(21~28 d)到达相对稳定的阶段。实验组对TN的去除效率远高于对照组,其中去除效果较好的3种沉水植物分别是黑藻80.16%、苦草75.81%和金鱼藻75.55%。
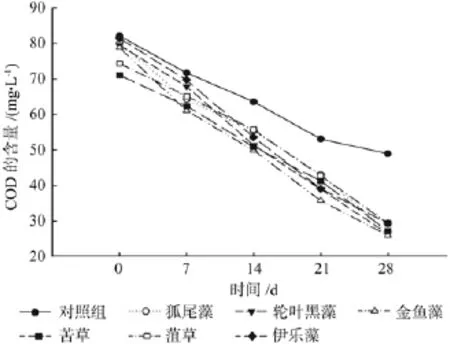
图3 各处理对COD的净化效果Fig.3 The puri fi cation ef fi ciency of COD under each treatment
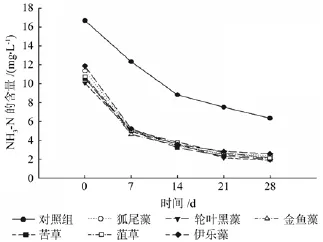
图4 各处理对NH3-N的净化效果Fig.4 The puri fi cation ef fi ciency of NH3-N under each treatment

图5 各处理对TN的净化效果Fig.5 The puri fi cation ef fi ciency of TN under each treatment
图6是不同处理下原水中TP浓度的去除曲线。由图可以看出,前半阶段(0~14 d)实验组与对照组均表现出对TP相似的去除效果,到实验后期实验组的去除效果显著优于对照组,但实验组组间的差异不大。去除效果表现较好的3种沉水植物分别是苦草88.13%、黑藻86.98%和伊乐藻85.96%。

图6 各处理对TP的净化效果Fig.6 The puri fi cation ef fi ciency of TP under each treatment
图7是不同处理下原水中悬浮颗粒物浓度(SS)的去除曲线。由图可以看出,实验前半段(0~14 d)由于实验组和对照组中的SS浓度都比较高,故随时间变化的趋势均较为明显。后期(14~28 d),由于沉水植物能提供更多的生态位,实验组对SS的去除效率明显优于对照组,但实验组组间差异不明显。去除效果表现较好的3种沉水植物分别是狐尾藻89.89%、菹草89.41%和黑藻89.07%。

图7 各处理对SS的净化效果Fig.7 The puri fi cation ef fi ciency of SS under each treatment
图8图9分别反映了不同处理下原水pH值和DO的变化情况。由图可知,完成一个试验周期后,处理组的pH值和DO均高于对照组。其中狐尾藻的pH值达到了8.36,而种植水中溶解氧(DO)浓度增幅最大的3种沉水植物分别是狐尾藻44.63%、苦草25.11%和黑藻24.31%。
2.3 沉水植物的抑藻效应

图9 各处理下的DOFig.9 The DO under each treatment
叶绿素a是一种衡量富营养化水体中藻类光合作用潜力的指标,可反映水体中藻类生物量的变化[18]。图10显示,实验测得不同阶段狐尾藻、苦草、黑藻和金鱼藻种植水中的叶绿素a浓度均呈下降趋势,其中苦草和黑藻下降趋势最为显著。菹草种植水中的叶绿素a浓度下降不明显,而伊乐藻则与对照组相似,叶绿素a浓度逐步升高。
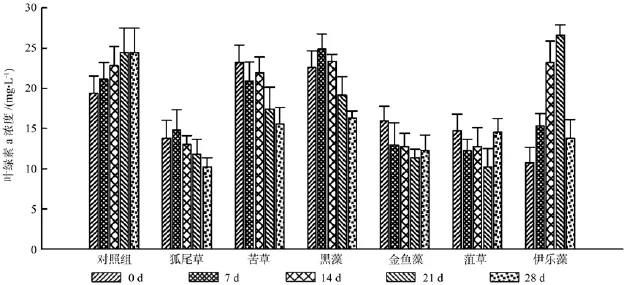
图10 各处理中浮游藻类的叶绿素a浓度Fig.10 The chlorophyll a content of phytoplankton under each treatment
浮游藻类的相对生长速率(RGR)可直观反映藻类单位时间内的增加量。图11显示,相较于空白组,5组试样中的浮游藻类RGR曲线均呈不同幅度的下降态势,其中狐尾藻和黑藻均是先小幅上升然后开始大幅下降;而苦草、金鱼藻和菹草则是先明显下降,在处理周期的中段有一个相对稳定的周期,然后再出现明显下降的趋势;伊乐藻的曲线则是从一开始便高于对照并一路上升,最后在处理周期的末端有所下降,但其种植水中浮游藻类的相对生长速率仍高于对照组。
3 结论与讨论
3.1 结 论
6组试样生长适应性及耐污能力排序为:黑藻>苦草>狐尾藻>金鱼藻>伊乐藻>菹草。6组试样去污能力能力排序为:黑藻>苦草>金鱼藻>狐尾藻>伊乐藻>菹草。6组试样抑藻效率排序为:苦草>黑藻>狐尾藻>金鱼藻>菹草>伊乐藻;6组试样抑藻效果的稳定性排序为:狐尾藻>黑藻>苦草>金鱼藻>菹草>伊乐藻。

图11 各处理中浮游藻类的相对生长速率曲线Fig.11 The RGR curve of phytoplankton under each treatment
综合以上结果发现:苦草、黑藻、狐尾藻和金鱼藻耐污与去污能力较强,对水体中浮游藻类的抑制效应也最为明显且稳定,在污水原位生态修复技术中具有良好的应用前景。
3.2 讨 论
目前,利用组合水生植物进行污水原位修复的技术受到普遍重视,而沉水植物的去污抑藻效应的应用研究却相对薄弱。因此本研究设计了自然条件下的低浓度暴露实验,重点关注沉水植物本身的耐污能力和生长状况外,还对NH3-N等主要水质污染指标的去除效率和藻类抑制功能进行了对比研究,具有较高的工程应用价值。
实验初期,各沉水植物被迫调节自身的脯氨酸和丙二醛含量以适应原水中较高浓度的污染物环境,因此在实验初期,6种沉水植物的脯氨酸和丙二醛含量均保持了较高的水平,表现出适应性抗逆反应。经过一个试验周期的适应,加之原水中污染物浓度在逐渐降低,狐尾藻、轮叶黑藻、金鱼藻、苦草和伊乐藻这5种植物的脯氨酸、丙二醛含量均有所下降,这表明试验后期上述5种植物已适应污水生长环境。
结合6种植物在富营养化条件下的生长情况表现发现:在一个试验周期内,狐尾藻和苦草生长状态良好,其脯氨酸和丙二醛的含量水平较之其他沉水植物相对较低且后期降幅较大,这说明狐尾藻和苦草耐污能力较强,适宜在污染较重、营养物质含量多的水环境中生长;黑藻和金鱼藻也表现出良好的生长状态,其脯氨酸和丙二醛的含量水平较之其他沉水植物较高且后期也出现大幅降低,这说明黑藻和金鱼藻能在污水环境下产生适应性抗逆反应并逐渐适应,表现出较好的生长状态;而伊乐藻和菹草生长几乎停滞,尤其是菹草,其脯氨酸、丙二醛含量在实验末期还保持升高态势,充分说明这两种沉水植物耐污染适应性能力弱,不适宜在污染较重的水环境中生长。
通过在相同浓度污水里沉水植物对水质净化能力的对比研究发现:在一个实验观测周期内,实验水体的溶解氧(DO)含量得到明显的增加,pH值维持在7.0~8.5之间。污水中COD、NH3-N、TN、TP、SS等常规污染指标均明显下降,且植物对各污染物去除效率较高的阶段均出现在实验初期,后期去除效率逐步放缓。这一趋势应该是由沉水植物生长状况造成的:初期,植物不适应富营养化水体环境,生长状态不佳,故对COD、NH3-N、TN、TP等的去除率不高;经过一定的适应期后,植物生理代谢活动正常,能直接从水体中吸收营养物质,或依靠根系的微环境中微生物的代谢使水体中的COD、NH3-N、TN和TP逐步降低,直至平衡。根据相同浓度生活污水条件下的综合比较发现:综合净化能力较好的沉水植物分别是黑藻、苦草、金鱼藻和狐尾藻,这与李泽等人[19]的实验结果相吻合。
在自然生长环境下,苦草、黑藻、狐尾藻和金鱼藻4种沉水植物种植水中的叶绿素a浓度逐步降低并显著低于对照组,说明供试沉水植物通过营养和光的竞争,加之释放的化感物质,有效抑制了周边浮游藻类的生长。从种植水中浮游藻类的RGR动态变化来看,除金鱼藻的实时速率变化波动较大外,狐尾藻、黑藻和苦草曲线表明随着种植时间的延长,植物向水中释放的化感物质浓度越高,抑藻效果越好。由于“低促高抑”现象的存在,菹草和伊乐藻向周围水体分泌的化感物质较少,致使其试样水体中浮游藻类的相对生长速率在某一时期出现上升。因此,在实际工程应用中,合理配置水生植物在水体中的密度或频度是保障良好抑藻效应的关键。至于同一种化感物质针对不同藻类是否起作用,亦或是每种藻类是否均有专一的化感物质,植物之间是否也存在强烈的化感效应,则有待通过气质联用技术[20-22]鉴定具体的化感物质和开展植物组合实验来进行深入研究。
[1]程庆霖,何 岩,黄民生,等.城市黑臭河道治理方法的研究进展[J].上海化工,2011,36(2):25-31.
[2]王淑梅,王宝贞,金文标,等.城市污染河流水质原位综合净化技术[J].城市环境与城市生态,2008,21(4):1-4.
[3]Ervin G N, Wetzel R G. An ecological perspective of allelochemical interference in land-water interface communities[J]. Plant and Soil, 2003,256:13-28.
[4]Horppila Jukka, Nurminen Leena. Effects of submerged macrophytes on sediment resuspension and internal phosphorus loading in Lake Hiidenvesi(southern Finland)[J].Water Research,2003, 37(18):4468- 4474.
[5]张之浩,李 威,吴晓芙. 6种沉水植物对富营养化水体化感抑藻效果研究[J].湘潭大学自然科学学报,2017,54(3):55-60.
[6]洪 喻,胡洪营. 水生植物化感抑藻作用研究与应用[J].科学通报,2009,54(3):287-293.
[7]Carmen Rojo, Matilde Segura, Francisco Cortés. Allelopathic effects of microcystin-LR on the germination, growth and metabolism of five charophyte species and a submerged angiosperm [J]. Aquatic Toxicology,2013,13(9):1-10.
[8]鲁志营,高云霓,刘碧云,等.水生植物化感抑藻作用机制研究进展[J].环境科学与技术,2013,36(7):64-69.
[9]Tran Thi Ngoc Bicha,Hisashi Kato-Noguchi. Allelopathic potential of two aquatic plants duckweed (Lemna minorL.)and water lettuce (Pistia stratiotesL.) on terrestrial plant species[J].Aquatic Botany, 2012(103):30-36.
[10]汤仲恩,种云霄,吴启堂,等.3种沉水植物对5种富营养化藻类生长的化感效应[J].华南农业大学学报,2007,28(4):42-46.
[11]王红强, 成水平, 张胜花,等. 伊乐藻生物碱的GC-MS 分析及其对铜绿微囊藻的化感作用[J].水生生物学报, 2010,34(2): 361-366.
[12]王立新, 张 玲, 张余霞,等. 黑藻(Hydrilla verticillata)养殖水对铜绿微囊藻(Microcystis eruginosa)抑制效应及其机制[J].植物生理与分子生物学学报, 2006,32(6): 672-678.
[13]浦寅芳, 孙颖颖, 阎斌伦,等. 3 种沉水植物对水华藻类生长的影响[J]. 水生态学杂志, 2009, 2(6): 46-50.
[14]胡凯茜,郑 元,黄新会,等.紫茎泽兰对桉树幼苗生长及生理生态指标的影响[J].中南林业科技大学学报,2016,36(6):51-55.
[15]田 琪,李利强,黄代中. 洞庭湖浮游植物群落结构与富营养化特征分析[J].当代水产,2012(7):72-74.
[16]胡 芳,王德良. 湘江长沙段水体藻类种群组成特征研究[J].环境科学与管理,2011,35(5):162-163.
[17]米美多,慕 宇,代晓华,等.花后高温胁迫下不同施氮量对春小麦抗氧化特性的影响[J].江苏农业科学,2017,45(1):52-56.
[18]汪 丽,王国祥,唐晓燕.荇菜(Nymphoides peltatum)对铜绿微囊藻(Microcystis aeruginosa)生长的抑制效应及其机制[J].生态与农村环境学报, 2010,26(3):257-263.
[19]李 泽,高小辉,贺 锋,等.苦草和黑藻对模拟西湖水体中CODMn及TN和NO3-N的去除力分析[J].植物资源与环境学报,2012,21(4):29-34.
[20]Sanna S, Giovana O, Edna G. Allelopathic effects of the Baltic cyanobacteria Nodularia spumigena, Aphanizomenon fl os-aquae and Anabaena lemmermannii on algal monocultures[J]. Journal of Experimental Marine Biology and Ecology,2004,308:85-101.
[21]Mulderij G, Mooij W M, Smolders A J,et al.Allelopathic inhibition of phytoplankton by exudates from Stratiotes aloides[J]. Aquatic Botany,2005,82:284-296.
[22]Jefferson L V, Pennacchio M. Allelopathic effects of foliage extracts from four Chenopodiaceae species on seed germination[J]. Journal of Arid Environments, 2003,55:275-285.
