2种类型多壁碳纳米管对蛋白核小球藻的毒理研究
2018-03-16罗潇宇任垠安高浩杰高恩光王应军
罗潇宇,任垠安,高浩杰,高恩光,王应军,*
1. 四川农业大学环境学院,成都 611130 2. 四川雅安经济开发区规划建设和安全生产环境保护局,雅安 612500
纳米技术已在许多领域得以应用。与此同时,纳米材料通过生产、水处理应用和其他商品使用等途径直接或间接进入到水环境中,可能会对一些水生生物造成危害。ZnO、CuO和TiO2等纳米材料对藻类的光合作用影响显著,能改变藻细胞内叶绿素含量或干扰光合作用过程中光电子转运[1]。多壁碳纳米管(multi-walled carbon nanotubes, MWCNTs)作为纳米技术产品之一,由于其出色的性能,诸如:优异的导电性、高抗拉强度、巨大的表面积以及半导体和吸附潜力,使得它在环境保护方面也有一定的应用[2-3]。Mueller等[4]预测世界范围内碳纳米管产量在每年350~500吨水平。随着需求的增加,碳纳米管大规模的商业化生产和应用引起了人们关于这些纳米材料对环境和人体潜在影响的担忧[5]。尽管纳米材料的环境浓度已经有模型研究预测,但关于纳米材料的实际环境浓度大部分还是未知的[4]。例如,碳纳米管的释放将导致纳克和毫克水平的环境浓度[4],碳纳米管在水生环境中的浓度级通常估计为ng·L-1[6]。虽然对实际环境浓度的了解相对较少,但研究者们对碳纳米管的潜在毒性和环境影响还是予以了一定关注。
研究表明单壁碳纳米管不仅可导致大鼠肺部组织损伤和肉芽肿的形成[7-8],还可引起小鼠肝脏组织蛋白质的氧化损伤和大鼠主动脉内皮细胞损伤[9-10]。还有研究指出在纯培养条件下,纳米材料具有抗菌性[11-14]。纳米二氧化铈在低浓度(≤80 mg·L-1)时可促进蛋白核小球藻的生长及光合色素及可溶性性蛋白质的合成,但在高浓度(>80 mg·L-1)时对蛋白核小球藻具有毒性效应[15]。碳纳米材料往往通过静电、氧化或细胞膜穿刺等作用产生效应,特别是通过产生活性氧或氮物质产生氧化作用,这均需要紧密接触才会破坏细胞膜[16]。在水体环境中,水底沉积物中高浓度水平的MWCNTs对无脊椎动物多样性无影响,在3个月的暴露时间里,无脊椎动物的数量增加。相比之下,经过15个月的暴露,检测结果表明2 mg·L-1的MWCNTs对沉积物中的群落结构有着显著影响[17]。未纯化和氧化处理的MWCNTs在实验室条件下对普通小球藻均有剂量效应关系:未纯化MWCNTs的IC50值为(5.5±1.8) mg·L-1,氧化MWCNTs的IC50值为(6.9±1.9) mg·L-1,且它们的毒性效应主要来自MWCNTs的团聚遮光效应[18]。研究者通过“超声悬浮”和“普通搅拌”2种方式对双壁碳纳米管进行实验处理,结果显示采用“超声悬浮”的双壁碳纳米管对假微型海链藻和骨藻具有更大的毒性,表明双壁碳纳米管在水环境中的生物毒性与它们的分散状态有关[19]。在光照条件下,单璧碳纳米管在纯水中可以产生活性氧自由基[20]。活性氧自由基可增加氧化压力,导致细胞膜质过氧化、破坏细胞结构或导致酶活性异常,最终导致细胞凋亡。因此,碳纳米管导致的氧化胁迫也可能是碳纳米管致毒机理的一部分。
藻类作为水体中的一种初级生产者,对水生生态系统的稳定具有重要作用。水环境中的许多水溶性污染物可通过食物链进入人体,对人体健康造成影响[21]。由于小球藻细胞小,结构简单,在环境中暴露得较为全面,所以学者们将小球藻应用于重金属的毒性研究,通过暴露实验,从小球藻某些生理指标来衡量重金属毒性[22]。
本文通过研究原始多壁碳纳米管(original multi-walled carbon nanotubes, P-MWCNTs)及羟基化多壁碳纳米管(hydroxylated multi-walled carbon nanotubes, MWCNTs-OH)对蛋白核小球藻(Chlorellapyrenoidosa)叶绿素a含量、比生长速率μ、可溶性蛋白质含量、总抗氧化能力值(total antioxidant capacity, T-AOC)和丙二醛(malondialdehyde, MDA)含量的影响,探究原始多壁碳纳米管及羟基化多壁碳纳米管对蛋白核小球藻毒性效应机制,为评估2种类型多壁碳纳米管对藻类的生物学效应及其环境风险积累提供一定的数据资料和科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
蛋白核小球藻(FACHB-5)购自中国科学院野生生物种质库——淡水藻种库。在超净台中,将藻种转接到灭菌之后的BG11培养基中,在25 ℃、光照度3 000~4 000 lux、光周期12 h Light/12 h Dark的光照培养箱(RXZ型智能人工气候箱,宁波,江南仪器厂)中,每天定时摇瓶3次培养。BG11培养基配方如Wu等[23]在其文献中所述。
P-MWCNTs的物化参数为:纳米管外径(OD)10~20 nm,内径(ID)5~10 nm,纳米管长度(length) 10~30 μm,比表面积(SSA)>150 m2·g-1,纯度>98wt%;MWCNTs-OH的物化参数为:OD 10~20 nm,ID 5~10 nm,length 10~30 μm,SSA>170 m2·g-1,纯度>98wt%。二者购自中科时代纳米成都有机化学有限公司。将定量的P-MWCNTs和MWCNTs-OH分散到BG11培养基中,配成4 mg·L-1的母液,再灭菌待用。由于P-MWCNTs和MWCNTs-OH均不溶于水,水系中分散性不佳,在水中静置会沉至容器底部,实验使用前置于超声波清洗机(KQ5200DE型数控超声波清洗机,200 W、40 kHz,昆山超声仪器有限公司)超声20 min,使得2种类型的MWCNTs分散液更为均匀。可溶性蛋白质、T-AOC和MDA试剂盒购自南京建成生物科技有限公司;其他试剂均为分析纯。
1.2 实验方法
1.2.1 MWCNTs表征
P-MWCNTs和MWCNTs-OH结构表征前在100 ℃烘箱中干燥24 h。热重分析(TGA)研究材料的热稳定性,扫描电镜(SEM)表征碳纳米管的微观形貌结构。
1.2.2 藻种的扩大培养
取处于对数增长期的蛋白核小球藻(Chlorellapyrenoidosa),在无菌条件下转接到BG11培养基中,于上述藻培养条件下活化7 d,再进一步扩大培养以满足实验需求。
1.2.3 暴露实验
本文参照OECD201藻类生长抑制实验方法,将蛋白核小球藻接种在灭菌后的三角锥形瓶中,其初始藻接种藻密度为1 000 000 cells·mL-1,再分别加入定量P-MWCNTs和MWCNTs-OH母液,使最终实验浓度为0、5、10、20、40、80 mg·L-1,在光照度3 000~4 000 lux、光周期12 h Light/12 h Dark的光照培养箱中暴露96 h。每组实验设3个平行。
1.2.4 比生长速率的测定
自实验接种之日起,每隔24 h取样,用血球计数板在显微镜下测定藻细胞密度N(cells·mL-1)。利用如下公式计算比生长速率μ。
式中:μ—为比生长速率(d-1);Nt—T时刻的藻细胞密度(cells·mL-1);N0—初始藻细胞密度(cells·mL-1);T—暴露时间(d)。
1.2.5 叶绿素a的测定
在实验室条件下,叶绿素a与生物量呈显著正相关关系[24]。从0 h到96 h每天定时取5 mL藻液,8 000 r·min-1离心10 min,弃上清液,加入5 mL 90%丙酮(V/V),摇匀,放入冰箱,4 ℃避光萃取24 h以提取蛋白核小球藻细胞中的叶绿素a;把萃取过后的叶绿素a提取液置于高速离心机中,10 000 r·min-1离心10 min取上清液,以90%丙酮作为参比,置于分光光度计中测定上清液在波长分别为630 nm、645 nm、663 nm和750 nm时的吸光度。叶绿a含量采用周永欣等[25]的方法计算:
C=11.64×A663-A750-2.16×A645-A750+0.10×A630-A750
式中:C—样品叶绿素含量(μg·mL-1);V1—提取液体积(mL);V2—藻液体积(mL);N—藻细胞密度(cells·mL-1)。
1.2.6 可溶性蛋白质、T-AOC和MDA含量的测定
在实验第96小时分别取每个锥形瓶中藻液40 mL,4 500 r·min-1离心10 min,弃上清液,用5 mL生理盐水悬浮洗涤2~3次以除去附着在蛋白核小球藻表面的培养基,再离心,之后就可得到藻细胞。然后把藻细胞转移至研钵中,加入2 mL预冷的生理盐水和少量的石英砂进行冰浴研磨,直到镜检无完整藻细胞为止,定容到10 mL,4 ℃下5 000 r·min-1离心10 min,上清液即为样本提取粗酶液。可溶性蛋白含量测定采用考马斯亮蓝法[26],T-AOC测定采用铁离子还原能力法(FRAP法)[27],MDA含量测定采用硫代巴比妥酸法(TBA法)[26]。
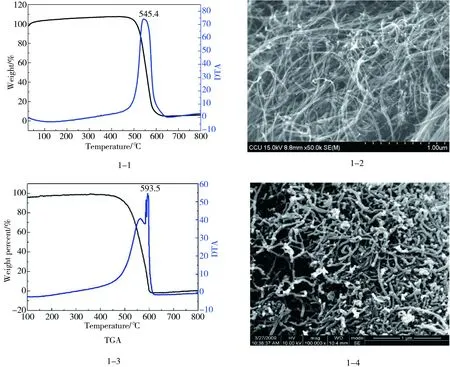
图1 多壁碳纳米管(MWCNTs)TGA和SEM表征图注:TGA为热重分析;DTA为差热分析法;SEM表示扫描电子显微镜。1-1和1-2为原始多壁碳纳米管(P-MWCNTs)的TGA和SEM的表征图; 1-3和1-4为羟基化多壁碳纳米管(MWCNTs-OH)的TGA和SEM的表征图。Fig. 1 The TGA curve and SEM image of multi-walled carbon nanotubes (MWCNTs)Note: TGA stands for thermogravimetric analysis; DTA stands for differential thermal analysis; SEM stands for scanning electron microscope. Figure 1-1 and figure 1-2 show the TGA curve and SEM image of original multi-walled carbon nanotubes (P-MWCNTs); figure 1-3 and figure 1-4 show the TGA curve and SEM image of hydroxylated multi-walled carbon nanotubes (MWCNTs-OH).
1.3 数据分析
采用SPSS 22.0对数据进行方差分析及t检验,P<0.05表示有显著性差异,用*表示。采用Origin进行图表绘制。
2 结果(Results)
2.1 MWCNTs表征
P-MWCNTs的TGA和SEM表征图分别如图1-1和图1-2所示,MWCNTs-OH的TGA和SEM表征图分别如图1-3和图1-4所示。对比表征图可知MWCNTs-OH被截断,管体破裂并且开口。样品表面光滑,分散性提高,一部分碳管直径变厚。P-MWCNTs和MWCNTs-OH的结构和性质稳定。
2.2 MWCNTs对蛋白核小球藻生长的影响
图2-1和图2-2分别显示了蛋白核小球藻在不同浓度P-MWCNTs和MWCNTs-OH暴露下其比生长速率变化情况。由图2-1可知,与对照组相比,P-MWCNTs浓度分别为5 mg·L-1和10 mg·L-1实验组的生长趋势一致,它们的比生长速率都是在72 h达到最大,96 h后,蛋白核小球藻的生长都会有所减缓。当P-MWCNTs浓度达到20 mg·L-1时,蛋白核小球藻的生长受到抑制,这种抑制现象也出现在更高P-MWCNTs浓度的实验组。最小比生长速率(-0.91 d-1)出现在暴露于80 mg·L-1P-MWCNTs 24 h后的实验组,这表明80 mg·L-1的P-MWCNTs能对蛋白核小球藻的生长产生明显的抑制作用。由图2-2可知,与对照组相比,MWCNTs-OH浓度分别为5 mg·L-1、10 mg·L-1和20 mg·L-1实验组的生长趋势一致,它们的比生长速率都是先增加再减小,实验96 h后比生长速率又增大,但小于48 h比生长速率。当MWCNTs-OH浓度分别达到40 mg·L-1和80 mg·L-1时,蛋白核小球藻的生长从24 h逐渐受到抑制,且随着实验时间的延长,蛋白核小球藻的比生长速率越来越小。最小比生长速率(-0.43 d-1)出现在暴露于80 mg·L-1MWCNTs-OH 96 h后的实验组,这表明80 mg·L-1的MWCNTs-OH亦能对蛋白核小球藻的生长产生明显的抑制作用,且这种抑制作用随着时间的延长而加强。

图2 不同浓度P-MWCNTs和MWCNTs-OH对蛋白核小球藻生长的影响注:*表示与对照组相比,P<0.05。Fig. 2 The effects of P-MWCNTs and MWCNTs-OH on the growth of Chlorella pyrenoidosaNote: compared with the control, *P<0.05.
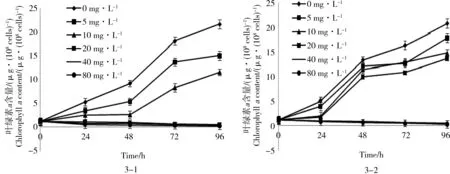
图3 P-MWCNTs和MWCNTs-OH对蛋白核小球藻叶绿素a含量的影响Fig. 3 The effects of P-MWCNTs and MWCNTs-OH on the content of chlorophyll a in Chlorella pyrenoidosa
2.3 MWCNTs对蛋白核小球藻叶绿素a含量的影响
图3-1和图3-2分别显示了蛋白核小球藻在不同浓度P-MWCNTs和MWCNTs-OH暴露下叶绿素a含量的变化情况。由图3-1可知,暴露在P-MWCNTs 24 h后,与对照组相比,P-MWCNTs的所有实验组蛋白核小球藻叶绿素a含量都低于对照组,P-MWCNTs浓度范围为0~10 mg·L-1实验组在实验48 h内叶绿素a含量均有所增长且较为平缓,48 h后,浓度范围0~10 mg·L-1实验组叶绿素a含量增长速率增大,而浓度范围为20~80 mg·L-1实验组的叶绿素a含量从实验一开始就维持在较低水平,与对照组差异显著(P<0.05),且组间差异不显著(P> 0.05)。总的来说,蛋白核小球藻叶绿素a含量呈随着P-MWCNTs浓度增加而降低的趋势,当P-MWCNTs浓度≥20 mg·L-1时,蛋白核小球藻叶绿素a含量一直减少。由图3-2可知,暴露在MWCNTs-OH 24 h后,与对照组相比,MWCNTs-OH的所有实验组蛋白核小球藻叶绿素a含量都低于对照组,浓度范围为0~10 mg·L-1实验组在实验24 h内叶绿素a含量均有所增长且较为平缓,24 h后,0~20 mg·L-1实验组叶绿素a含量增长速率增大,48 h后,0~20 mg·L-1实验组叶绿素a含量增长速率又减小,而MWCNTs-OH浓度范围为40~80 mg·L-1实验组的叶绿素a含量从实验一开始也维持在较低水平,与对照组差异显著(P<0.05),且组间差异亦不显著(P>0.05)。总的来说,蛋白核小球藻叶绿素a含量呈随着MWCNTs-OH浓度增加而降低的趋势,当MWCNTs-OH浓度≥40 mg·L-1时,蛋白核小球藻叶绿素a含量一直减少。
2.4 MWCNTs对蛋白核小球藻可溶性蛋白质含量的影响
图4显示了蛋白核小球藻分别在不同浓度P-MWCNTs和MWCNTs-OH胁迫96 h后可溶性蛋白质含量的变化情况。由图4可知,蛋白核小球藻可溶性蛋白质含量整体随MWCNTs浓度的增加呈先增加后减少的趋势。具体而言,当蛋白核小球藻暴露在10 mg·L-1和20 mg·L-1MWCNTs-OH实验条件下,藻细胞可溶性蛋白质含量相对于对照组有明显增加(P<0.05),而蛋白核小球藻暴露在5 mg·L-1、10 mg·L-1和20 mg·L-1P-MWCNTs实验条件下,藻细胞可溶性蛋白质含量相对于对照组没有发生显著改变(P>0.05)。当蛋白核小球藻分别暴露在浓度为40 mg·L-1和80 mg·L-1P-MWCNTs和MWCNTs-OH实验条件下,它们的可溶性蛋白质含量明显低于对照组(P<0.05)。
2.5 MWCNTs对蛋白核小球藻总抗氧化能力值的影响
图5显示了蛋白核小球藻分别在不同浓度P-MWCNTs和MWCNTs-OH暴露96 h后总抗氧化能力值(T-AOC)的变化情况。由图5可知,蛋白核小球藻的T-AOC在2种MWCNTs暴露条件下随着纳米材料暴露浓度的增加而减小。与对照组相比,20 mg·L-1以及更高浓度P-MWCNTs实验组蛋白核小球藻的T-AOC更小(P<0.05),而至于MWCNTs-OH实验组,40 mg·L-1以及更高浓度暴露下的蛋白核小球藻具有更小的T-AOC(P<0.05)。在相同浓度的MWCNTs暴露下,MWCNTs-OHs实验组的蛋白核小球藻具有比P-MWCNTs实验组蛋白核小球藻更大的T-AOC。当蛋白核小球藻分别暴露在浓度为5 mg·L-1和10 mg·L-1的2种MWCNTs的实验条件下,T-AOC变化不显著(P>0.05)。
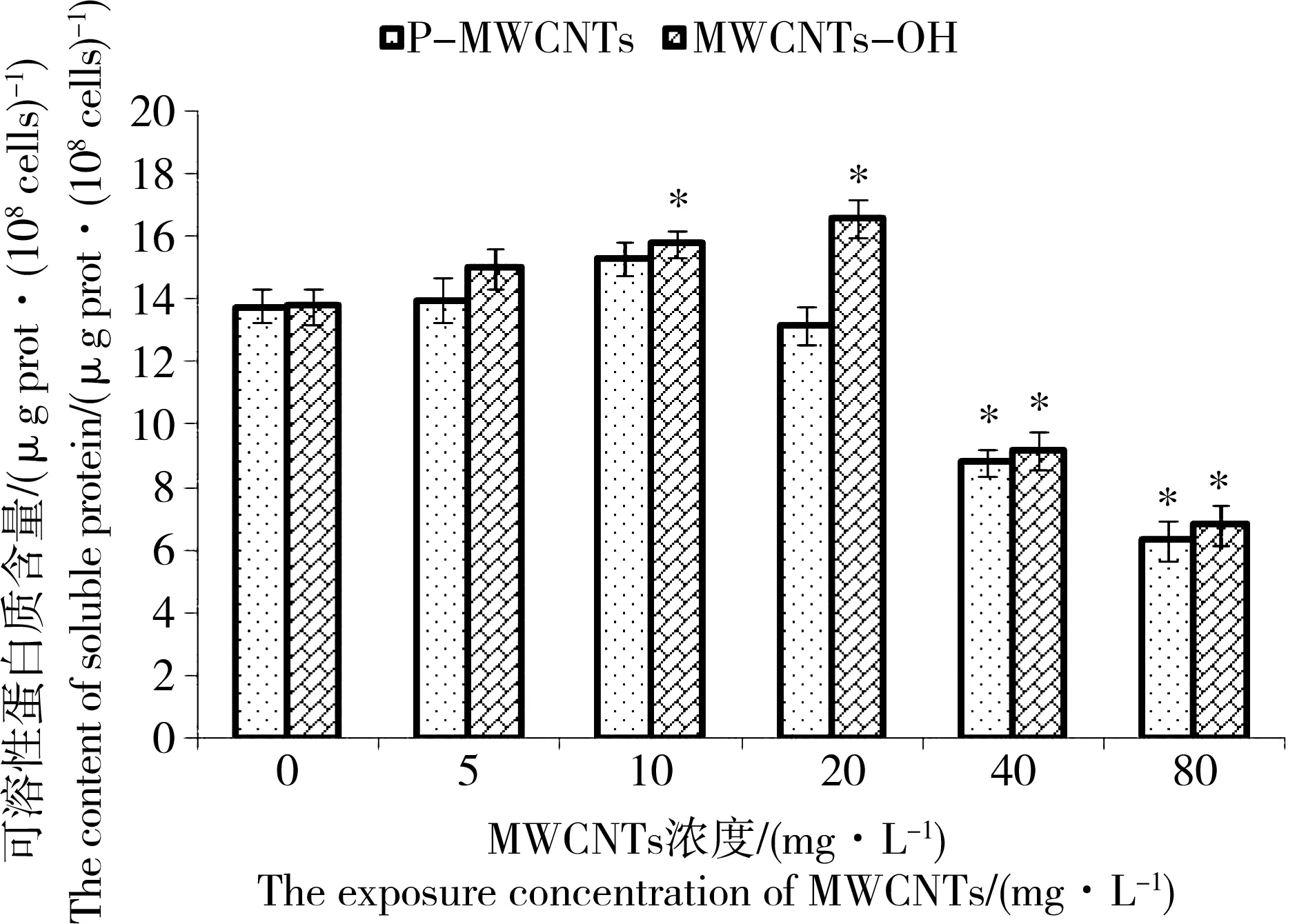
图4 P-MWCNTs和MWCNTs-OH对蛋白核小球藻可溶性蛋白质含量的影响注:*表示实验组与对照组差异显著(P<0.05)。Fig. 4 The effects of P-MWCNTs and MWCNTs-OH on the content of soluble protein in Chlorella pyrenoidosaNote: * indicated that the difference was significant (P< 0.05) between exposure groups and control group.
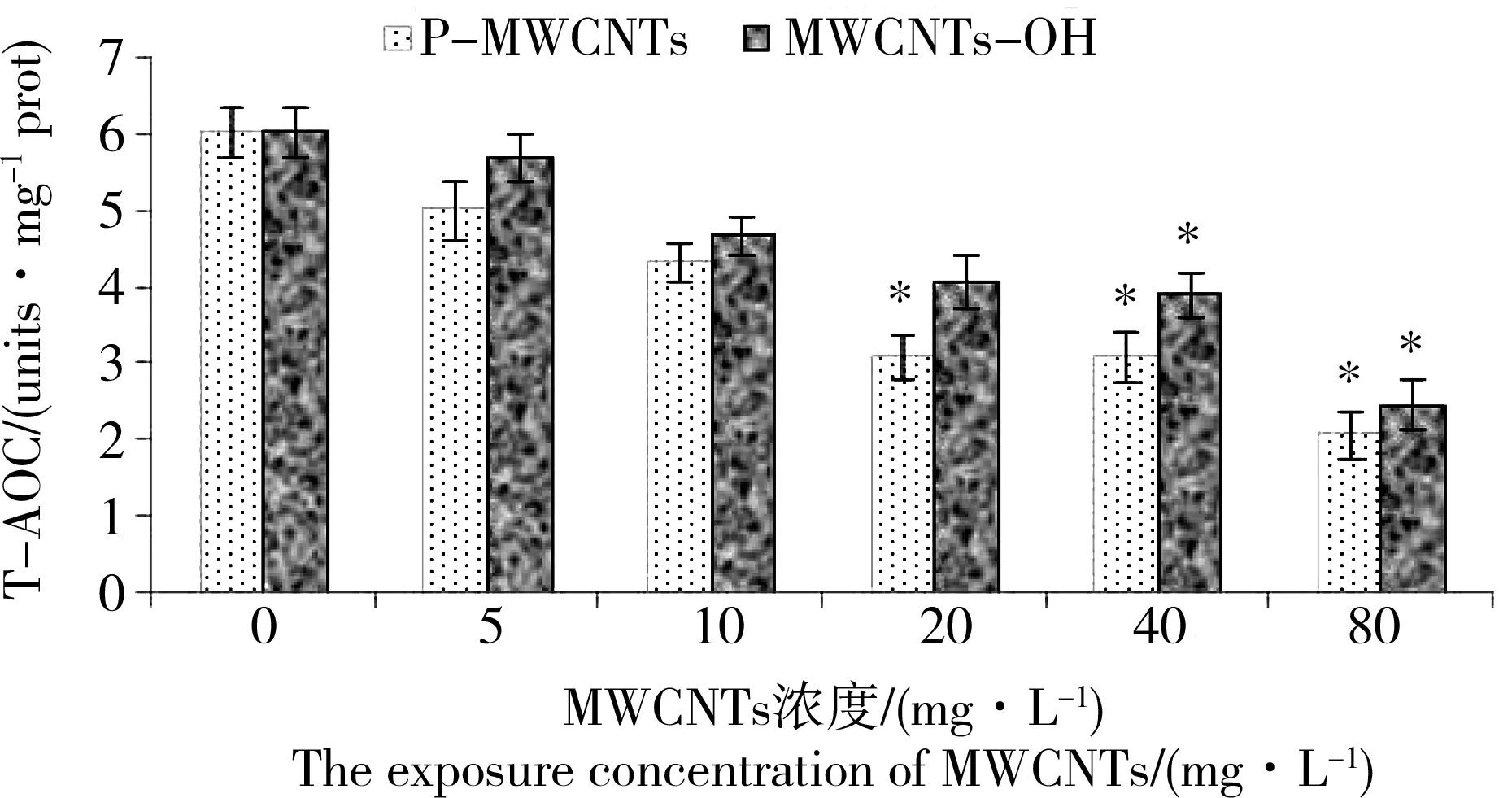
图5 P-MWCNTs和MWCNTs-OH对蛋白核小球藻总抗氧化能力值(T-AOC)的影响注:*表示实验组与对照组差异显著(P<0.05)。Fig. 5 The effects of P-MWCNTs and MWCNTs-OH on the total anti-oxidation capacity (T-AOC) value in Chlorella pyrenoidosaNote: * indicated that the difference was significant (P< 0.05) between exposure groups and control group.
2.6 MWCNTs对蛋白核小球藻MDA含量的影响
图6显示了蛋白核小球藻分别在不同浓度P-MWCNTs和MWCNTs-OH暴露96 h后MDA含量的变化情况。由图6可知,蛋白核小球藻细胞MDA含量整体呈随MWCNTs浓度增大而增加的趋势。与对照组相比,蛋白核小球藻暴露在20 mg·L-1以及更高浓度P-MWCNTs条件下,其MDA含量开始显著增加(P<0.05);而MWCNTs-OH实验组,40 mg·L-1以及更高浓度实验组的蛋白核小球藻MDA含量也开始显著增加(P<0.05)。5 mg·L-1和10 mg·L-1P-MWCNTs以及5 mg·L-1、10 mg·L-1和20 mg·L-1MWCNTs-OH实验组蛋白核小球藻的MDA含量与对照组相比没有发生明显变化(P>0.05)。

图6 P-MWCNTs和MWCNTs-OH对蛋白核小球藻 丙二醛(MDA)含量的影响注:*表示实验组与对照组差异显著(P<0.05)。Fig. 6 The effects of P-MWCNTs and MWCNTs-OH on the content of malonlydialdehyde (MDA) in Chlorella pyrenoidosaNote: * indicated that the difference was significant (P< 0.05) between exposure groups and control group.
3 讨论(Discussion)
尽管目前碳纳米管的实际环境浓度并不明确,但是研究者们已经着手碳纳米管的环境毒性效应研究[28-29]。本实验中,蛋白核小球藻暴露在10 mg·L-1及以下浓度P-MWCNTs的条件下,其比生长速率在24~72 h增大,在96 h比生长速率减小,可能是由于藻细胞活性在72 h处最大,在96 h后又变得稍弱。而在实验室条件下,当P-MWCNTs浓度达到20 mg·L-1时,蛋白核小球藻的比生长速率从24 h开始便为负数,说明抑制作用变得更强。随着时间的延长,这种抑制作用一直存在。至于这种抑制作用强弱的变化还有待进一步研究。当蛋白核小球藻暴露在浓度≤20 mg·L-1的MWCNTs-OH条件下,其比生长速率先增大、后减小、再增大。总体上,随着MWCNTs-OH浓度的增加,每个计算时刻的藻细胞比生长速率减小,这可能是因为MWCNTs-OH与藻细胞之间的共沉降作用不稳定导致的,此作用还有待进一步研究。类似的,在实验室条件下,当MWCNTs-OH浓度达到40 mg·L-1时,蛋白核小球藻的比生长速率从24 h开始便为负数,说明蛋白核小球藻的生长在40 mg·L-1及更高浓度的MWCNTs-OH暴露下,受到了越来越强的抑制,随着时间的延长,这种抑制作用同样是一直存在的,且在96 h的抑制作用最强。以上现象表明,2种MWCNTs对蛋白核小球藻的生长抑制作用存在着差异,这可能是因为在制备羟基化多碳纳米管时引入了新的官能团,改变了原始多壁碳纳米管的结构,引起了性质的差异,导致它们在环境行为的差异。
叶绿素a存在于所有绿色植物体内,是叶绿素重要组成成分之一,它能吸收和转换光能。同时,叶绿素a在实验室培养条件下与藻细胞生物量有着显著的正相关关系[24]。本实验中,叶绿素a含量可一定程度代表蛋白核小球藻生物量,而且能在一定程度上反映藻细胞在纳米材料暴露下光合作用的强弱。当P-MWCNTs浓度低于20 mg·L-1、MWCNTs-OH浓度低于40 mg·L-1时,藻细胞的叶绿素a含量变化明显。这可能是因为在实验初期由MWCNTs导致的遮蔽效应诱导藻细胞合成更多的叶绿素,以利于在低光强时,微藻光合作用接受光子,既而导致叶绿素a含量变化。随着实验时间的延长,MWCNTs在培养基中的分散趋于稳定后,剂量效应占主导地位,藻细胞中叶绿素酯还原酶的合成受到抑制,影响了氨基-γ-酮戊酸的合成,降低了叶绿素含量,继而抑制了蛋白核小球藻的生长[30]。
蛋白质是生物体的物质基础,亦是酶系统的物质基础,蛋白质对生物体的代谢活动起着至关重要作用[31]。蛋白核小球藻暴露在2种类型MWCNTs 96 h后,5 mg·L-1和10 mg·L-1P-MWCNTs实验组以及5 mg·L-1、10 mg·L-1和20 mg·L-1MWCNTs-OH实验组的藻蛋白质含量均有所增加。这可能是因为随着MWCNTs浓度的增加,藻细胞内活性氧(ROS)开始积累,为了应对这种环境胁迫并保持细胞内ROS产生和消除平衡,藻细胞的抗氧化系统介入,更多的抗氧化酶在胞内合成以抵制胁迫,以使细胞能缓和由胁迫导致的损害。而以上生理过程中所涉及的酶是细胞可溶性蛋白质的组成部分[30],所以胞内可溶性蛋白质含量轻微增加。而当蛋白核小球藻分别暴露在20 mg·L-1P-MWCNTs和40 mg·L-1MWCNTs-OH的实验条件下,P-MWCNTs和MWCNTs-OH对蛋白核小球藻产生了一定的毒性效应。主要是因为藻细胞的抗氧化系统已不能有效抵御由过高浓度MWCNTs浓度导致的胁迫。同时,在过高浓度的P-MWCNTs或MWCNTs-OH条件下,2种纳米材料穿过细胞膜进入细胞内的概率大大增加。此外,进入藻细胞内的MWCNTs会增加蛋白质水解酶的活性,加速蛋白质水解,导致了可溶性蛋白质含量减少[32]。
藻类的抗氧化防御系统与藻类细胞的机体健康状况之间有着紧密联系。防御系统分为酶系统和非酶系统,这2种系统协调作用,互相依赖。更强的抗氧化能力表明机体健康状态更好且具有更强的抗胁迫能力。反之,机体健康状态越恶劣且抗胁迫能力更弱。当P-MWCNTs浓度低于20 mg·L-1以及MWCNTs-OH浓度低于40 mg·L-1时,蛋白核小球藻细胞通过自己抗氧化系统介入调节,以抵御环境胁迫,藻细胞健康状态良好,因此T-AOC值维持在高水平。当P-MWCNTs浓度≥20 mg·L-1以及MWCNTs-OH浓度≥40 mg·L-1时,蛋白核小球藻细胞的抗氧化系统已不能有效抵御环境胁迫,细胞健康状况恶化,导致藻细胞活性降低并出现细胞凋亡现象,因此T-AOC值减小。
当蛋白核小球藻受到环境胁迫时,细胞内酶系统产生ROS,这些ROS能够攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化,并促进合成脂质过氧化物。丙二醛(MDA),一种脂质过氧化物,间接反映了ROS对藻类细胞的攻击严重程度[33]。当细胞的T-AOC变弱时,藻类细胞的抗氧化系统受到干扰,ROS产生和清除的平衡被破坏,导致藻类细胞的ROS积累加剧和膜脂过氧化损伤,MDA含量迅速增加。同时,MDA又会抑制和降低抗氧化酶的活性和含量。
