三氯乙烯和四氯乙烯的细胞毒性及氧化应激机制研究
2018-03-16逯南南许燕赵清华孙莉石近淼王明泉孙韶华贾瑞宝
逯南南,许燕,赵清华,孙莉,石近淼,王明泉,孙韶华,贾瑞宝
山东省城市供排水水质监测中心,济南 250021
氯乙烯类有机物广泛用于工业、医疗、日用品等领域,随着其生产和使用量的增长,已成为重要的环境污染物之一,在空气、水、土壤中均能检测到氯乙烯类污染物[1-5],详见表1。三氯乙烯(TCE)和四氯乙烯(PCE)是易挥发的不饱和脂肪组氯代烃,美国环保署(EPA)将三氯乙烯定性为人类致癌物,国际癌症研究中心(IARC)将三氯乙烯和四氯乙烯分别定义为I类和2A类致癌物[6-7]。鉴于TCE和PCE环境污染的普遍性、对人类的危害性及其治理的复杂性,其生物毒性研究已成为国内外学者广泛关注的问题。离体细胞测试技术由于其简便、快捷已被广泛应用于污染物的生物毒性评价中。TCE和PCE暴露被证实与职业性剥脱性皮炎、重症多形红斑、大疱性表皮坏死松解症和多形红斑等疾病有关[8-9],因此目前关于TCE和PCE的细胞毒性研究主要以皮肤角质细胞为主,其他体细胞的毒性研究相对较少。本研究以中国仓鼠卵巢细胞为受试细胞,利用离体细胞测试技术开展三氯乙烯和四氯乙烯胁迫下细胞毒性和氧化应激机制研究,为揭示其毒性作用提供理论依据,也为环境污染物安全性评价方法提供支撑。
1 材料与方法(Materials and methods)
1.1 材料
中国仓鼠卵巢细胞(Chinese Hamster Ovary, CHO)购自国家细胞资源共享平台,使用含10%胎牛血清的DMEM高糖培养基,5% CO2的培养箱中37 ℃条件下培养。
试验中所用乳酸脱氢酶测定试剂盒、超氧化物歧化酶测定试剂盒、过氧化氢酶测定试剂盒、总蛋白定量测试盒以及活性氧测试盒等购自南京建成生物工程研究所,其他试剂均为色谱纯及以上。
1.2 方法
1.2.1 细胞毒性测定
采样MTT法进行细胞毒性测定,调整细胞浓度为0.5~1×104个·mL-1,接种100L细胞悬液于96孔培养板上培养24 h后,加入三氯乙烯和四氯乙烯进行染毒,设置剂量组分别为50 mg·L-1、100 mg·L-1、200 mg·L-1、500 mg·L-1、1 000 mg·L-1、2 000 mg·L-1,每组设6个平行,同时设置空白对照孔(加入相同体积的培养基)和溶剂对照孔(加入相同体积的二甲基亚砜)。染毒24 h后弃掉原培养液,每孔加入新鲜培养100L及50L 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)溶液,继续培养4 h,弃培养液,加入150L 二甲基亚砜(DMSO)溶液,振荡15 min后,在酶标仪上测定570 nm下的吸光值(OD值)。细胞存活率按下列公式计算:细胞存活率=(实验组OD值对照组OD值)100%,用细胞存活率-染毒浓度作图法求出半数抑制浓度IC50。
1.2.2 酶活性的测定
细胞接种及培养方法同1.2.1。在IC50值以下设置浓度进行三氯乙烯和四氯乙烯进行染毒,剂量分别为20 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1,染毒试验24 h后测定细胞培养液中乳酸脱氢酶(LDH)活性和细胞内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性,测定过程按照试剂盒说明书进行。用含1% DMSO的培养液作溶剂对照组,以染毒组细胞培养液中的LDH含量与对照组的比值反映细胞毒性。每个浓度做6个重复孔。
1.2.3 活性氧的定性观察
2',7'-二氯荧光黄双乙酸盐(DCFH-DA)可以自由穿过细胞膜进入细胞,在细胞内可被酯酶水解而生成2',7'-二氯荧光素二乙酸酯(DCFH)。DCFH不能透过细胞膜,其在细胞内可被活性氧(ROS)氧化为有荧光的2',7'-二氯荧光素(DCF),故检测DCFH的荧光强度可代表细胞内ROS的水平。细胞培养及接种方法同1.2.1。在IC50值以下设置浓度进行三氯乙烯和四氯乙烯进行染毒,剂量分别为20 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1,染毒试验24 h后,加入DCFH-DA 37 ℃孵育细胞60 min,胰蛋白酶消化、离心收集细胞,磷酸缓冲盐溶液(PBS)洗涤2~3次并重悬细胞,荧光显微镜下观察。以活性氧供氢体(H2O2)为阳性对照。
2 结果与分析(Results and analysis)
2.1 三氯乙烯和四氯乙烯的细胞毒性
倒置显微镜下观察对照组细胞贴壁良好,细胞呈梭形或多角形,形态完整分布均匀;而高浓度TCE和PCE染毒24 h后细胞变形,贴壁率下降,密度明显减少,培养液中出现大量死亡细胞漂浮(图1);MTT实验结果显示TCE和PCE暴露能够抑制CHO细胞的生长,随着染毒浓度的增加,细胞存活率逐渐降低,存在明显的剂量-效应关系。与对照组相比,TCE 100 mg·L-1及以上和PCE 50 mg·L-1及以上试验组细胞存活率显著下降(P<0.05)。通过对数拟合计算得到两者对CHO细胞24 h的IC50分别为590 mg·L-1、281 mg·L-1(图2)。
2.2 三氯乙烯和四氯乙烯对细胞膜的损伤
与空白对照组相比,溶剂对照组细胞培养液中总LDH活性没有明显变化,说明使用DMSO作为助溶剂对TCE和PCE的细胞毒性作用没有显著影响。TCE和PCE暴露均导致体外培养的CHO细胞LDH释放水平增加,随着染毒浓度的增大,细胞培养液中LDH的活性不断增大,表明细胞膜受损程度越大。通过方差分析发现,与溶剂对照组相比,TCE染毒浓度50 mg·L-1及以上,PCE染毒浓度20 mg·L-1及以上试验组细胞培养液中LDH活性变化显著。

图1 TCE和PCE对CHO细胞形态的影响(100倍)Fig. 1 Effects of TCE and PCE on cells morphology (×100)

图2 TCE和PCE对CHO细胞存活率的影响Fig. 2 Effects of TCE and PCE on cell viability
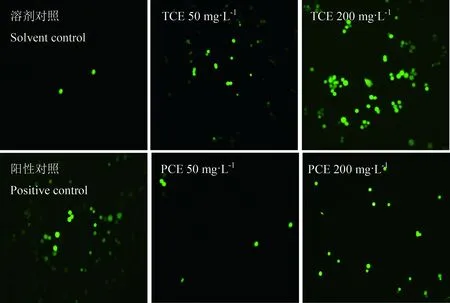
图3 TCE和PCE对CHO细胞内ROS产生的影响(100倍)Fig. 3 ROS production in CHO cells exposed to TCE and PCE (×100)
2.3 三氯乙烯和四氯乙烯对细胞的氧化损伤
对照组细胞内产生很少荧光,而经TCE和PCE染毒后的细胞,细胞内荧光强度明显增加,且荧光强度的产生与染毒物的剂量存在相关性,高剂量组的荧光强度明显高于低剂量组。同剂量组的TCE染毒组细胞内的荧光强度强于PCE染毒组,说明TCE诱导细胞产生ROS的能力更强(见图3),各实验组细胞密度的比较见图4。
细胞培养至24 h后,与空白对照组相比,溶剂对照组SOD、CAT活性无显著差异。TCE和PCE染毒组细胞内SOD酶活性均有下降趋势,且200 mg·L-1染毒组酶活性下降显著;20 mg·L-1、50 mg·L-1染毒组细胞CAT酶活性有升高趋势,且PCE 50 mg·L-1染毒组酶活性显著升高,说明较低的污染物浓度能够激活CAT的活性,随着染毒浓度的升高,CAT的活性逐渐下降,200 mg·L-1PCE染毒组CAT酶活性受到显著抑制(图5)。
3 讨论(Discussion)
TCE和PCE的用途广泛决定了它们的大量生产,由于生产、使用、储存或处置不当等一些原因,使其通过挥发、泄露、废水排放、农药使用及含氯有机物成品的燃烧等途径进入大气、土壤、地下水中[10-14],对人类健康和环境造成较大危害。近年来,国内外学者针对此类污染物的肝脏、中枢和末梢神经系统、肾脏、肺、心脏毒性等做了大量研究。其中离体细胞毒性检测技术因简便、快速而成为一种常用的毒性评价手段。关于氯乙烯类污染物对体外培养肺源细胞和皮肤胶质细胞等类型细胞的毒性已有相关报道,如王波等[15]采用MTT测试技术得到TCE对体外培养中国仓鼠肺细胞的IC50值为368 mg·L-1;沈彤等[16]和丁锐等[17]的研究显示TCE和PCE对体外培养人皮肤角质形成细胞中性红半数抑制浓度分别为4.53 mmol·L-1(595 mg·L-1)和2.16 mmol·L-1(358 mg·L-1)。本研究显示TCE和PCE对中国仓鼠卵巢细胞24 h的IC50值分别为590 mg·L-1、280 mg·L-1,与前期研究结果类似。

表2 各剂量组TCE和PCE染毒后细胞培养液中乳酸脱氢酶(LDH)与空白对照组的比值(%,x±s)Table 2 The ratios of lactate dehydrogenase (LDH) between TCE or PCE exposure groups and the control group (%, x±s)
注:* 与溶剂对照组比较,P<0.05。
Note: * represents a significant difference between exposed group and solvent control group,P<0.05.

图4 TCE和PCE对CHO细胞密度的影响(100倍)Fig. 4 Cell density of CHO exposed to TCE and PCE (×100)

图5 TCE和PCE对CHO细胞内SOD和CAT酶活性的影响Fig. 5 The effects of TCE and PCE on SOD and CAT activities in CHO cells
外源性化合物进入生物体内,经代谢活化可产生各种类型的活性氧自由基,对大多数细胞具有毒性作用。ROS是氧的某些代谢产物及其衍生物质,它们具有比氧活泼的化学性质,统称为活性氧,主要包括超氧阴离子、羟基自由基、过氧化氢、脂类过氧化物以及单线态氧等。正常条件下,自由基的产生与清除处于平衡状态,促氧化水平的升高或者抗氧化能力的减弱都会导致体内ROS含量的升高,使机体处于氧化应激状态,脂质过氧化作用增强,引起细胞膜结构、通透性改变、细胞免疫功能下降或者DNA链断裂等[18-19]。TCE和PCE暴露条件下,细胞内ROS含量明显上升,胞内能量代谢和抗氧化过程中一些关键酶的活性也受到影响。
LDH是细胞能量代谢过程中的关键性酶,如果细胞膜损伤破裂,LDH便会从胞浆中释放出来进入细胞培养液中,因此培养液LDH的活性可用于表征细胞膜的损伤程度。Lash等[20]使用0.2、0.5、1.0 mmol·L-1的PCE对体外培养的雄性大鼠肾脏皮质细胞进行染毒,发现作用3 h后各浓度组与溶剂对照组间LDH释放情况均有显著性差异。丁锐等[21]研究发现三氯乙烯可以引起体外培养的皮肤角质形成细胞膜损伤,接触三氯乙烯时间越长、浓度越高,细胞膜损伤越严重。本研究得到的结果与相关报道吻合。
抗氧化酶能清除在细胞内生成的活性氧,构成对活性氧的防御体系。SOD和CAT是生物体内抗氧化系统中关键性酶能将超氧阴离子自由基分解为过氧化氢和水,之后CAT将过氧化氢分解为完全无害的水。丁锐等[21]研究TCE和PCE对体外培养人皮肤角质形成细胞脂质过氧化的影响时发现,TCE和PCE染毒组细胞内ROS水平随TCE和PCE浓度增加呈上升趋势,而SOD酶活性呈下降趋势,与溶剂对照组相比较差异有显著性,且存在剂量效应关系。CAT酶活性在低浓度组呈激活态势,而随着污染物浓度的升高而活性受到抑制。Lowry等[22]和Chen等[23]研究也证实了TCE和PCE可导致机体发生氧化损伤作用。本研究发现TCE和PCE染毒组细胞内ROS水平显著上升,而SOD和CAT酶活性的下降使得自由基清除能力减弱,进一步加剧了活性氧的积累。ROS的不断积累引发细胞内氧化应激的发生。
