4-壬基酚对拟柱胞藻生长、抗氧化酶和光合作用的影响及机理
2018-03-16喻燚李巧玉董聪聪张红波向蓉施军琼吴忠兴
喻燚,李巧玉,董聪聪,张红波,向蓉,施军琼,吴忠兴
西南大学三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,重庆 400715
壬基酚(nonylphenol, NP)是非离子表面活性剂壬基酚聚氧乙烯醚(nonylphenol polyethoxylates, NPEOs)合成原料[1],同时也是其降解代谢产物。壬基酚是一种环境激素类似物[2],与1,7-β-雌二醇(雌激素的一种)具有相似的化学结构,因而具有雌激素的性质,能代替雌激素作用于雌激素的受体,从而抑制生物体内雌激素的作用,干扰生物体内正常代谢活动,因此被列入环境内分泌干扰物(EDCS)和33种优先污染物名录中[3]。2005年美国环保局(EPA)指出壬基酚在淡水中的浓度应低于6.6 μg·L-1,海水中浓度应低于1.7 μg·L-1 [4]。然而,近些年来,在我国水体如天津河流[5]、黄河[6]、长江[7]、胶州湾水体[8]、湄洲海湾水域[9]等均发现不同浓度的壬基酚,如嘉陵江和长江自然水样中壬基酚浓度为0.02~6.85 μg·L-1,而胶州湾附近墨水河壬基酚浓度达28.656 μg·L-1,其浓度远远高于EPA参考浓度。陈慰双[10]的研究表明大辽河流域部分站位、黄河兰州段水体部分站位、海河流域部分站位及香港米埔湿地壬基酚的污染水平已经对该地区生态系统造成威胁,并危害水生动植物的生长。因此,探讨壬基酚的生态毒性和风险评估显得尤为重要。然而,目前关于壬基酚的毒性研究主要集中在哺乳动物[11]、鱼类[12-13]及其他水生动物[14]的毒理研究上。研究表明壬基酚对小鼠的中枢神经系统有一定的损伤作用[15];对鲫(Carassiusauratus)肝细胞具有一定的毒性作用[16];还能引起端足类河蜾蠃蜚(Corophiumacherusicum)DNA的损伤,且损伤程度呈显著的剂量-效应关系[17]。
藻类是水生生态系统食物链的起点,也是最重要的初级生产者,其可将无机营养元素转移至更高级的有机生命体,担负着物质循环和能量流动的重要任务[18]。因此,开展壬基酚对微藻毒性效应的研究对壬基酚的生态风险评估具有重要意义。有研究表明壬基酚对三角褐指藻(Phaeodactylumtriconutum)的生长具有明显的毒性效应,并可以造成抗氧化酶系统和光合系统的损伤[19];壬基酚能使微小小环藻(Cyclotellacaspia)细胞生长速率减慢,叶绿素a含量下降,细胞畸形率增大[20]。虽有不少壬基酚对藻类的毒理学研究,但主要集中在硅藻和绿藻等真核藻类方面,而对水体浮游植物另一重要组成原核藻类—蓝藻的方面,特别是光合生理方面的研究相对较少。因此,为了探讨壬基酚对蓝藻的影响,本文以拟柱胞藻(Cylindrospermopsisraciborskii)为研究对象,本实验通过测定不同浓度下壬基酚对拟柱胞藻生长、光合系统Ⅱ相关参数及抗氧化酶的影响,旨在探究壬基酚对拟柱胞藻毒性效应,为揭示壬基酚对浮游植物的致毒方式和机理以及生态风险评价提供一定的理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
拟柱胞藻(C.raciborskiiFACHB-1096)由中国科学院水生生物研究所淡水藻种库提供。将藻扩大培养至指数生长期,离心去上清后转接到250 mL锥形瓶150 mL MA培养基中,接种OD为0.15。实验采用丙酮(化学纯,中国国药有限公司)作为助溶剂,配制丙酮的6个体积浓度系列:0、1‰、3‰、5‰、7‰和10‰,48 h培养后用浮游植物计数框显微计数,测定藻细胞的密度,计算得到丙酮对拟柱胞藻的不可见效应剂量(no observed effect level, NOEL)为5‰。参考野外水体浓度和相关文献,并结合预实验结果,设定4-壬基酚(优级纯,中国国药有限公司)终浓度为0.00、0.05、0.10、0.50、1.00和2.00 mg·L-1。培养条件为光照强度30μE·(m2·S)-1,温度25 ℃,光暗比12 h:12 h。每个浓度设置3个重复,以不添加4-壬基酚(0.00 mg·L-1)为对照组。每天定时摇动3次,使藻细胞充分与培养液接触。取样测量0 h、24 h、48 h、72 h、96 h的藻液OD值,并测量暴露96 h后藻细胞的叶绿素a含量。根据实验数据,通过线性回归分析计算NP对拟柱胞藻的96 h-EC50。
1.2 叶绿素a的测定
取不同浓度处理96 h的藻液各5 mL,离心后去上清,加入90%的丙酮进行提取,测定663 nm、645 nm下的OD值,用公式Chl a (mg·L-1)=(12.72×OD663-2.7×OD645)×Vt/V计算叶绿素的浓度,其中Vt为提取后定容的体积,V为提取所用的藻液体积[21]。
1.3 快速光曲线(RLCs)和最大光化学效率
用浮游植物荧光分析仪(PHYTO-PAM, Waltz公司,德国)测定藻细胞的最大光化学效率及电子传递速率,测定方法参见Maxwell等[22]的方法。快速光曲线数据采用以下等式的非线性曲线拟合过程拟合[23]:
rETR=rETRmax[1-e-(α·PAR/rETRmax)]e-(β·PAR/rETRmax)
rETRmax是最大相对潜在电子传递速率,α是RLC的初始斜率,PAR是光照度,β是在PSII下降的点上RLC的斜率,半饱和光强IK=rETRmax/α[24]。
1.4 PSⅡ快速叶绿素荧光动力学曲线(OJIP)的测定
藻体胁迫培养96 h后,每个处理各取2 mL藻液置黑暗中暗适应20 min后,测定快速叶绿素荧光诱导动力学曲线(OJIP)。快速叶绿素荧光诱导动力学曲线采用植物效率分析仪(PEA, 英国汉莎科技有限公司,英国)测定,测定光强为3 000μmol·m-2·s-1,最大激发波长650 nm,记录了从10μs到2 s叶绿素荧光的变化过程,从而准确记录O-J-I-P等相。快速叶绿素荧光动力学曲线由O点到P点的所有荧光需进行标准化,以对数形式进行表示。通过OJIP曲线的变化,获得了以下参数:单位受光面积有活性反应中心的数量(RC/CS0),t=0时最大光化学效率(ΦP0),t=0时捕获的激子将电子传递到电子传递链中超过醌分子(QA)的其他电子受体的概率(ψ0),t=0时用于电子传递的量子产额(ΦE0),单位反应中心吸收的光能(ABS/RC),t=0时单位反应中心耗散掉的能量(DI0/RC),t=0时单位反应中心捕获的用于还原QA的能量(TR0/RC),t=0时单位反应中心捕获的用于电子传递的能量(ET0/RC),从0到tFmax时间段QA-/QA的平均氧化还原态(Sm/t(Fm))[25]。
1.5 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的测定
酶液提取采用细胞冻融法,分别吸取不同浓度处理96 h的藻液各50 mL,离心去除上清液,加入定量磷酸盐缓冲液(PBS) pH=7.5,置于-80 ℃冷冻,经反复冻融后,离心提取酶液。蛋白质的测定参照考马斯亮蓝法[26]、SOD和CAT活性的测定分别参照Wu等[27]和Choo等[28]的方法。
1.6 数据分析
实验数据处理使用SPSS 16.0进行单因素方差分析(One-way ANOVA)及LSD法(P<0.05)检验处理组与对照组之间的差异,“*”、“**”、“***”表示P<0.05、P<0.01、P<0.001,差异显著。
2 结果(Results)
2.1 不同浓度4-壬基酚处理下拟柱胞藻叶绿素a含量的变化
不同浓度壬基酚处理96 h后,结果(图1)显示,与对照组叶绿素含量相比,0.05、0.10 mg·L-1处理组叶绿素a含量显著增加(P<0.001),分别增加了21.32%、27.27%。然而,在0.50、1.00、2.00 mg·L-1壬基酚中培养96 h后,各处理的叶绿素a显著低于对照组(P<0.001),分别减少了77.96%、88.77%、94.18%。当浓度>1 mg·L-1时培养瓶底部出现大量无色或白色的藻细胞沉淀物。根据回归曲线,4-壬基酚对拟柱胞藻的96 h半数效应浓度(96 h-EC50)为0.457 mg·L-1。
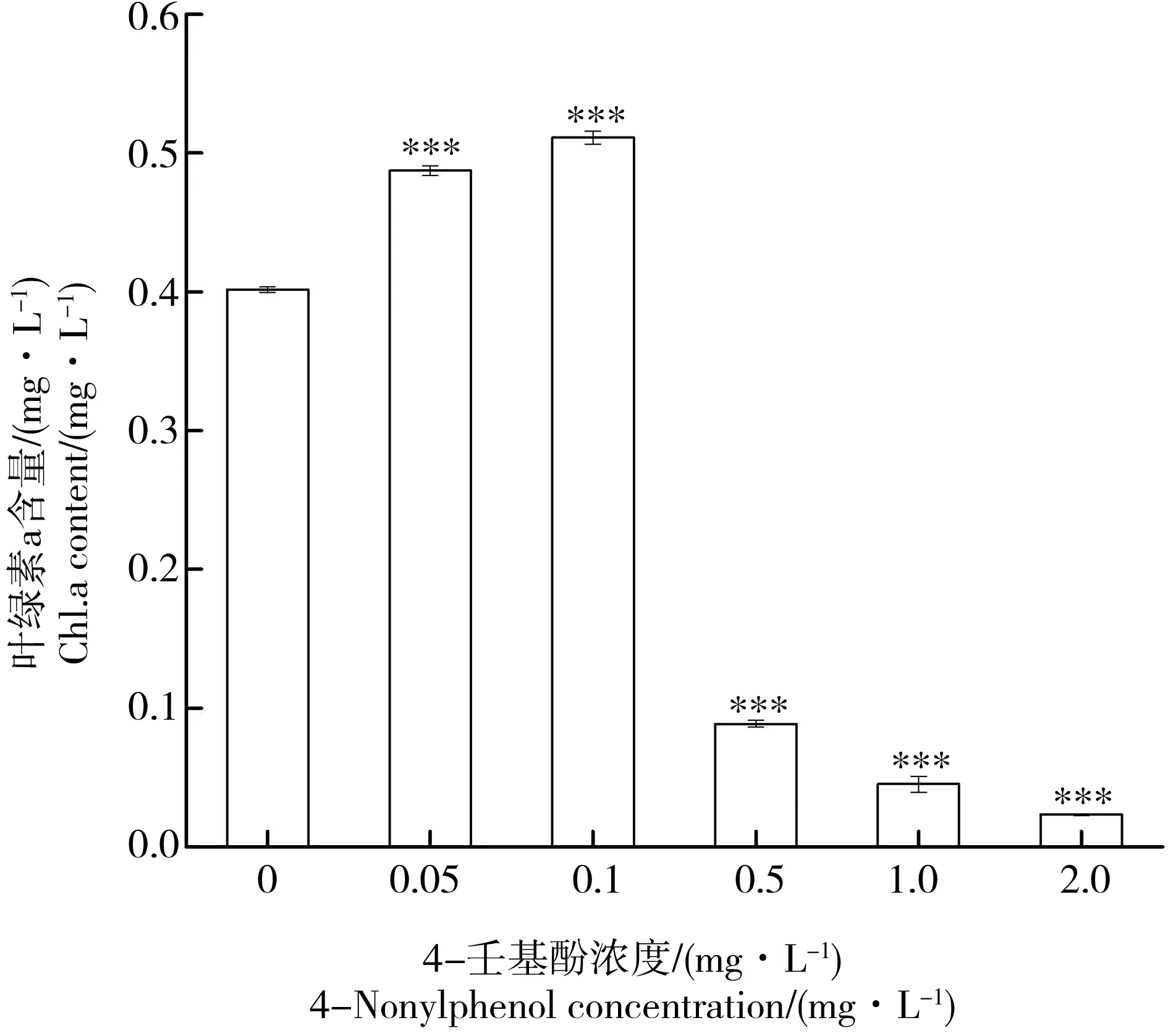
图1 不同浓度4-壬基酚处理后拟柱胞藻的叶绿素含量注:与对照组比较,“***”表示P<0.001,差异显著,下同。Fig. 1 Effect of different concentrations of 4-nonylphenol on chlorophyll a content in C. raciborskiiNote: compared with the control,“***”represents significant difference at P<0.001. The same below.

图2 不同浓度4-壬基酚对拟柱胞藻Fv/Fm的影响Fig. 2 The maximum photochemicial effeciency (Fv/Fm) for the responses of C. raciborskii to different concentrations of 4-nonylphenol
2.2 最大光化学效率(Fv/Fm)的变化
如图2所示,在不同浓度4-壬基酚处理96 h后,与对照组相比,0.05 mg·L-1和0.10 mg·L-1处理组的Fv/Fm无显著差异,而在0.50 mg·L-1、1.00 mg·L-1和2.00 mg·L-1处理后,Fv/Fm分别下降了50.99%、88.08%和100%,具有显著的差异(P<0.001)。
2.3 快速光响应曲线(RLC)
4-壬基酚处理96 h后,当壬基酚浓度大于0.50 mg·L-1时,与对照组相比,RLC发生显著降低;当4-壬基酚浓度为2 mg·L-1时,检测不出荧光值(图3)。与对照组相比,0.05 mg·L-1处理组α值无明显变化,当浓度大于0.10 mg·L-1时,随着浓度增加,α明显下降(P<0.01),0.50、1.00、2.00 mg·L-1处理组α值分别减少了46.58%、77.17%和100%;当浓度大于0.1 mg·L-1时,处理组的rETRmax发生了明显变化(P<0.01),其中0.1 mg·L-1处理组的rETRmax增加了5.36%,0.50 mg·L-1、1.00 mg·L-1、2.00 mg·L-1处理组rETRmax分别减少了78.43%、94.31%、100%;所有处理组的IK值均发生了明显变化(P<0.01),其中0.05 mg·L-1、0.1 mg·L-1处理组的IK值分别增加了11.8%、17.19%,0.50、1.00、2.00 mg·L-1处理组IK值分别减少了61.16%、76.23%、100% (表1)。
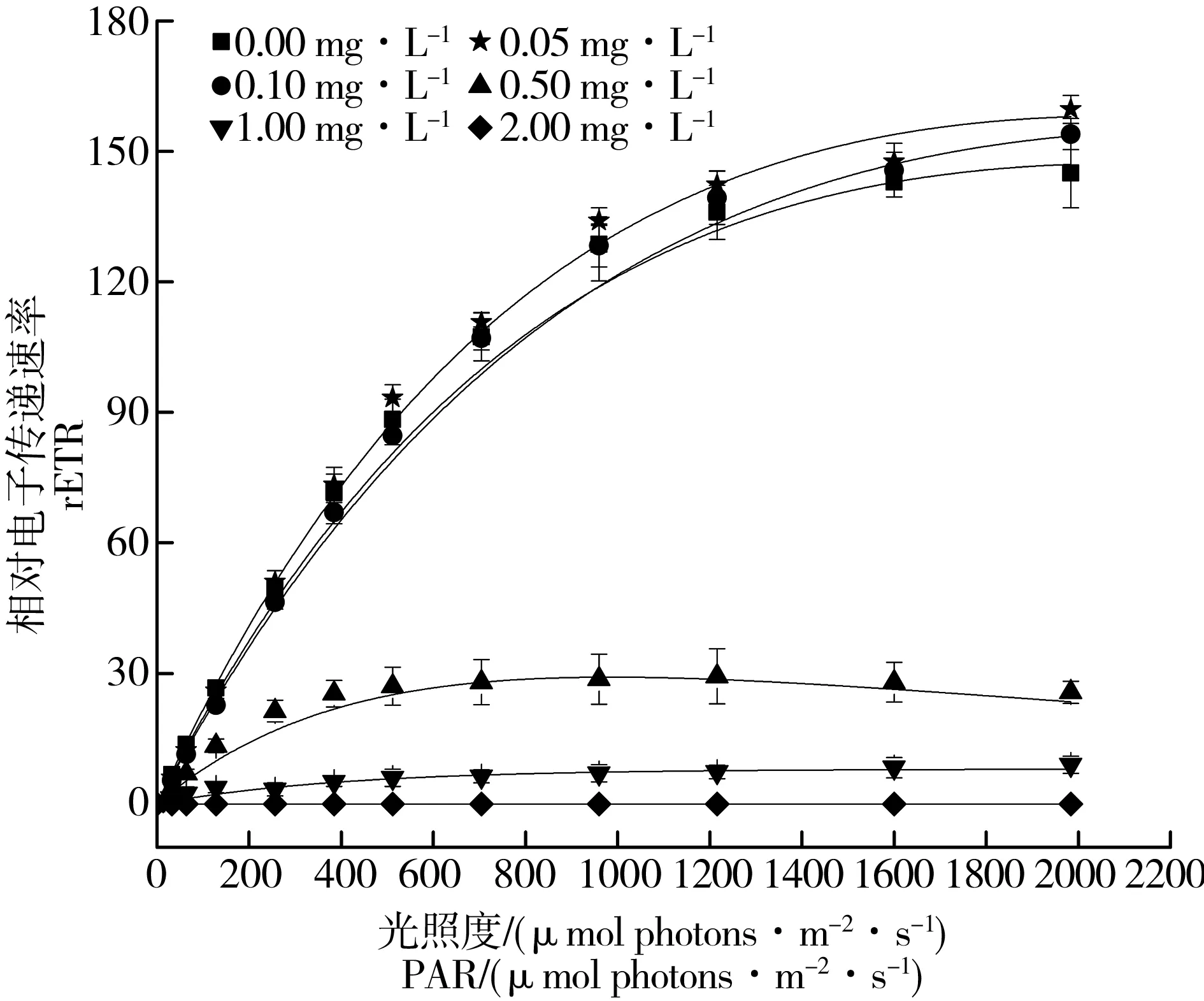
图3 不同浓度4-壬基酚对拟柱胞藻快速光曲线的影响Fig. 3 Rapid light curves of C. raciborskii under the influence of different concentrations of 4-nonylphenol following 48-h treatmentNote: rETR stands for electron transport rates; PAR stands for photosynthetic active radiation.

表1 拟柱胞藻经4-壬基酚处理后的光合参数变化Table 1 Changes in the photosynthetic parameters of C. raciborskii following treatment with 4-nonylphenol
注:每个值是3个重复的平均值±标准误;**表示P<0.01,与对照组比较,下同。α表示斜率;rETRmax表示最大电子传递速率;IK表示饱和光强。

图4 不同浓度4-壬基酚对拟柱胞藻叶绿素荧光参数(JIP-test)的影响注:RC/Cs0、ABS/RC、DI0/RC、TR0/RC、ET0/RC分别表示单位受光面积有活性反应中心的数量、单位反应中心吸收的光能、 单位反应中心耗散掉的能量、单位反应中心捕获的用于还原QA的能量、单位反应中心捕获的用于电子传递的能量; ΦP0、ψ0、ΦE0、Sm/t(Fm)分别表示最大光化学效率、捕获的激子将电子传递到电子传递链中超过QA的其他电子受体的概率、用于电子传递 的量子产额、从0到tFmax时间间隔QA-/QA平均氧化还原状态。*、**表示P<0.05、P<0.01,与对照组比较,下同。Fig. 4 Changes in the JIP test parameters and expressed as a percentage of the control when C. raciborskii were exposed for 96 h to various concentrations of 4-nonylphenolNote: RC/Cs0, ABS/RC, DI0/RC, TR0/RC, ET0/RC stand for density of reaction centers (RC), absorption flux per RC, dissipated energy flux per RC, trapped energy flux per RC, electron transport flux per RC, respectively; ΦP0, ψ0, ΦE0, Sm/t(Fm) stand for maximum quantum yield of primary photochemistry, probability that a trapped exciton moves an electron into the electron transport chain beyond QA-, quantum yield of electron transport, the average redox state of QA-/QA in the time span from 0 to tFmax, respectively. *, ** indicate P<0.05, P<0.01, compared with the control; the same below.
2.4 PSII叶绿素荧光参数的变化
不同浓度4-壬基酚处理后,拟柱胞藻叶绿素荧光参数反应活性中心所捕获的光能(ABS/RC)、反应活性中心耗散掉的能量(DI0/RC)、反应活性中心(RC)所捕获的激发能用于还原QA的能量(使QA减少从而还原成QA-,TR0/RC)、反应活性中心的捕获的光能用于电子传递的能量(QA--QB--PQ,ET0/RC)、荧光参数单位受光面积的反应活性中心数量(RC/Cs0)、最大光化学效率(ΦP0)、光照2 ms时有活性的反应中心开放程度(ψ0)、反应中心吸收的光能用于电子传递的量子产额(ΦE0)及从0到tFmax时间段QA-/QA的平均氧化还原态Sm/t(Fm)的变化情况如图4所示。与对照相比,当4-壬基酚浓度小于0.10 mg·L-1,拟柱胞藻各参数未表现出明显的差异(P>0.05)。当浓度高于0.50 mg·L-1,拟柱胞藻ABS/RC、DI0/RC和TR0/RC均显著增加(P<0.05),而RC/Cs0、ET0/RC、ΦP0、ΦE0、ψ0和Sm/t(Fm)均显著下降(P<0.05)。当4-壬基酚浓度为1.0 mg·L-1时,ABS/RC、DI0/RC和TR0/RC分别增加到对照组的235.23%、321.05%和118.10%,而RC/Cs0、ET0/RC、ΦP0、ΦE0、ψ0和Sm/t(Fm)则分别比对照下降了96.19%、83.72%、93.02%、86.04%、48.95%和63.30%。
2.5 抗氧化酶活性的变化
在不同浓度4-壬基酚处理96 h后,与对照组相比,0.05和0.10 mg·L-1处理组SOD和CAT活性无明显变化。然而,当浓度大于0.50 mg·L-1时,随着浓度增加,SOD、CAT的活性明显增加(P<0.01),0.50、1.00和2.00 mg·L-1组SOD的活性分别是对照组的3.65、13.78和15.65倍,CAT的活性分别是对照组的2.02、3.14和3.49倍。
3 讨论(Discussions)
叶绿素是光合作用的重要组成部分,叶绿素含量与光合速率、营养状况等密切相关,测定叶绿素的含量是表征植物生长与光合作用状况重要标志[29]。本次研究得到,低浓度4-壬基酚处理下(<0.1 mg·L-1),在高浓度(>0.5 mg·L-1)处理下,叶绿素的合成受到明显抑制(图1)。这与Liu等[30]对Cyclotellacaspia和Gao等[31]对Chlorellavulgaris和Selenastrumcapricornutum的结果相似。当浓度>1 mg·L-1时培养瓶底部出现大量无色或白色的藻细胞沉淀物,表明藻细胞叶绿素产生脱镁的效应,导致细胞中叶绿素失活,其大量产生说明藻类全部死亡。这表明与真核藻类相似,高浓度处理会使得拟柱胞藻藻细胞的叶绿体结构受到破坏,叶绿素的合成受阻,从而导致叶绿素含量降低,生长受抑制。4-壬基酚处理96 h,拟柱胞藻的半致死浓度(EC50)为0.457 mg·L-1,与球形棕囊藻96 h-EC50相似(0.42 mg·L-1)[32]。然而,低于三角褐指藻、蛋白核小球藻的96 h-EC50,分别为0.84 mg·L-1 [19]和3.13 mg·L-1[31]。然而,低浓度处理96 h后,拟柱胞藻的叶绿素含量增加(图1),表明低浓度的壬基酚促进拟柱胞藻的叶绿素的合成,这与Liu等[30]、Gao等[31]和管超等[32]对真核藻类的研究结果不同,表明在低浓度壬基酚暴露下,拟柱胞藻可能产生了毒物兴奋效应。目前,已报到水体中的壬基酚检测浓度均为低剂量[6-9],蓝藻的4-壬基酚毒物兴奋效应可能导致水体蓝藻的竞争优势。
光合作用为植物提供物质与能量,是植物生长发育的重要保障[33-34]。当植物体遭受一定条件的胁迫,其叶绿体的膜结构遭到破坏,叶绿素含量将随叶绿体膜结构的解体而降低,进而降低植物的光合能力[35]。Fv/Fm表示PSII最大光量子产量,当遭受外界胁迫时,该参数明显下降[36]。Gao等[31]对C.vulgaris和S.capricornutum、Zhou等[37]对Scenedesmusobliquus研究也得到了高浓度处理下Fv/Fm受到明显抑制。本研究发现当浓度高于0.5 mg·L-1,拟柱胞藻的Fv/Fm随浓度增加而减少(图2),表明拟柱胞藻的光合作用受到抑制作用,其原因可能是叶绿素的合成受阻,导致了光量子的产量受到抑制。rETRmax表示光合效率的大小,被用来描述PSII的最大光化学效率和开放氧化反应中心的比例[38]。本次研究得到,在壬基酚浓度>0.5 mg·L-1时,拟柱胞藻的rETRmax随浓度增加而减小(表1),这和Fv/Fm的结果一致,表明拟柱胞藻的光合作用受到了抑制。α是快速光曲线的初始斜率,表示藻的捕光能力[39],本研究发现当浓度高于0.5 mg·L-1,拟柱胞藻的α随浓度增加而减少(表1),表明拟柱胞藻在高浓度壬基酚的胁迫下捕光能力减弱。IK的大小表示植物耐受强光的能力[39],本研究发现当浓度高于0.5 mg·L-1,拟柱胞藻的IK随浓度增加而减少(表2),表明在高浓度壬基酚的胁迫下,拟柱胞藻耐受强光的能力减弱。当壬基酚浓度高于2 mg·L-1时,拟柱胞藻叶绿素荧光不能检测,也支持了管超等[32]对棕囊藻研究的结论。然而,与前人对真核藻类的研究不同,低浓度下,拟柱胞藻的rETRmax和IK增大,表明4-壬基酚对拟柱胞藻产生了毒性兴奋效应,进一步支持了叶绿素的结果。
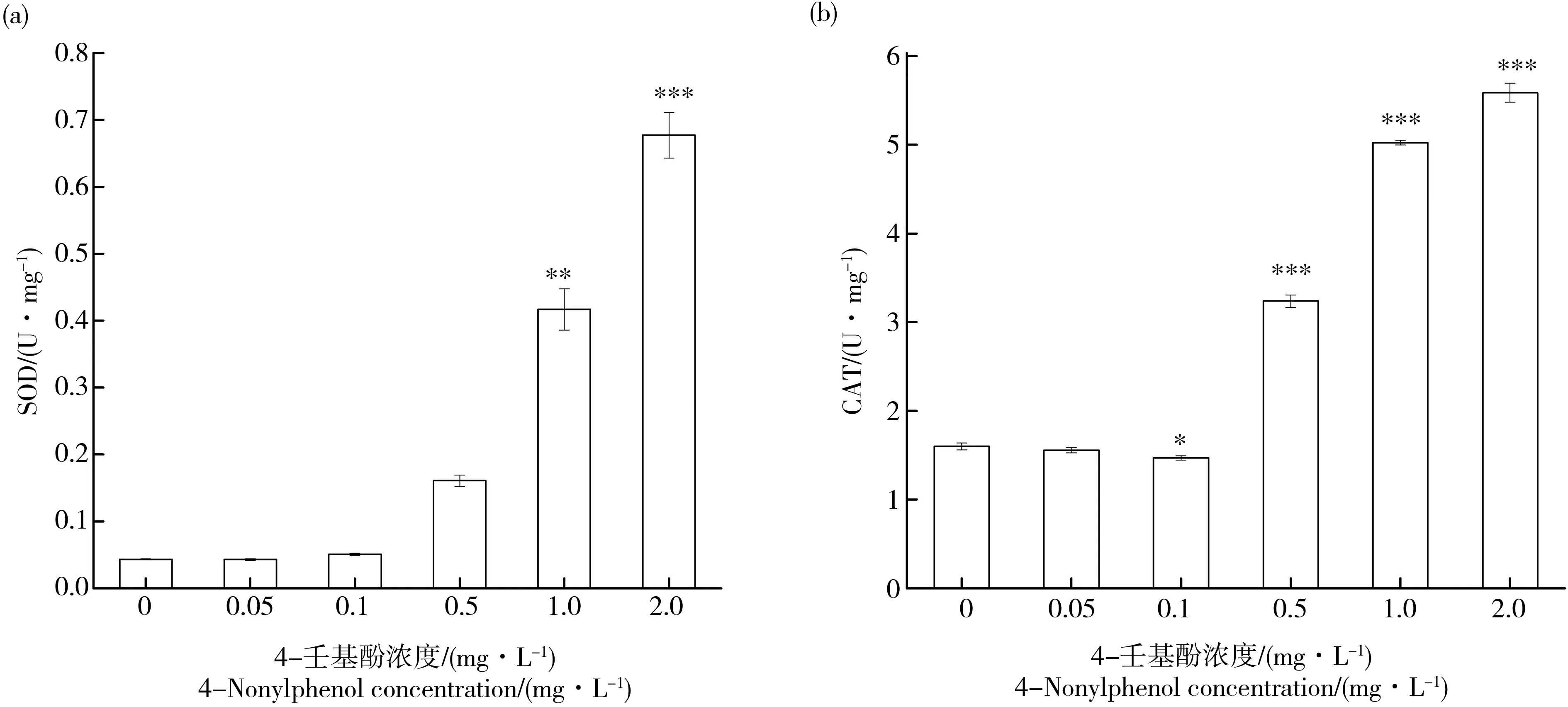
图5 不同浓度4-壬基酚处理后拟柱胞藻抗氧化酶活性注:(a)超氧化物酶(SOD),(b)过氧化氢酶(CAT)。Fig. 5 Effect of different concentrations of 4-nonylphenol on the antioxidase activity of C. raciborskiiNote: (a) superoxide dismutase (SOD); (b) catalase (CAT).
由于叶绿素荧光曲线提供了大量关于PSII反应中心原初光化学反应的信息,因此叶绿素荧光参数被认为是分析环境胁迫条件光合系统II(PSII)行为的敏感指标参数[40]。本研究发现在高浓度4-壬基酚处理下,拟柱胞藻的光合机构的比活性,即活跃的单位反应中心(RC)的各种量子效率(ABS/RC、DI0/RC、TR0/RC)均显著增加(图4A),表明了高浓度4-壬基酚处理增加了拟柱胞藻反应活性中心所捕获的光能,然而,这些捕获的能量主要被反应活性中心耗散掉,导致了QA-的大量积累[25]。同时,高浓度4-壬基酚处理也导致了拟柱胞藻单位面积上的反应中心的数量(RC/Cs0)、反应中心的最大光化学效率(ΦP0)、反应中心用来推动电子传递到电子传递链中超过QA的其他电子受体的激子比率(ψ0)、反应中心用来推动电子传递到电子传递链中超过QA的其他电子受体的概率(ΦE0)及QA-/QA的平均氧化还原态(Sm/t(Fm))均显著降低(图4),进一步表明了高浓度4-壬基酚破坏了拟柱胞藻的光合反应中心,导致了PSII供体侧的电子供体和受体侧电子受体受到了毒害作用,反应活性中心捕获的能量更多地用于QA还原为QA-,减少了用于电子传递的能量,进而抑制了QA-到QB的电子传递,QA-大量积累,增加质体醌(PQ)库的库容量,从而抑制了光合作用[40],该结果与拟柱胞藻的rETRmax随浓度增加而减小的结论相一致。
植物在逆境胁迫下,会产生过量的氧自由基,抗氧化酶防御系统是植物保护自身免受氧自由基毒害的防御系统,其中SOD和CAT是2种重要的抗氧化损伤保护酶[40],SOD将氧自由基转变为H2O2和O2,CAT进一步将H2O2转变为H2O和O2,植物通过这2种酶的相互协作,消除或减少氧自由基和过氧化氢的毒性[41-42]。本研究发现高浓度壬基酚处理后,拟柱胞藻的SOD和CAT活性均显著增加,支持了Liu等[30]和Gao等[31]的研究发现,表明高浓度壬基酚刺激藻细胞体内产生的大量氧自由基,植物为了生长必须清除这些氧自由基,因而合成大量SOD和CAT,使得SOD和CAT活性增加。然而,低浓度处理组中,拟柱胞藻的SOD和CAT与对照没有显著性差异(图5),表明低浓度对拟柱胞藻未产生毒害。
综上所述,与真核藻类一样,高浓度4-壬基酚处理下,拟柱胞藻的叶绿素合成受阻,光合色素减少,光合反应中心结构受损,QA-大量积累,光合效率下降,抑制藻细胞的光合作用,导致了拟柱胞藻生长受到阻碍。同时,高浓度处理导致藻细胞内产生大量氧自由基,为了清除氧自由基,细胞内抗氧化酶活性急剧增加。然而,与真核藻类不同,低浓度壬基酚处理下,拟柱胞藻则可能表现出毒物兴奋效应。因此,研究壬基酚对蓝藻的影响不仅需注意高浓度产生的急性毒理效应,也应该关注低浓度下产生的效应问题。
