三(1,3-二氯-2-丙基)磷酸酯诱发肝脏损害及病理改变研究
2018-03-16李学彦王思敏周启星邵晓东张永国胡献刚
李学彦,王思敏,周启星,*,邵晓东,张永国,胡献刚
1. 沈阳军区总医院消化科,沈阳110016 2. 南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室/天津市城市生态环境修复与污染防治重点实验室,天津 300350
有机磷阻燃剂(OPFRs)已在商业上得到广泛使用,主要应用于增塑剂配方、液压油、润滑剂、粘合剂和聚氨酯泡沫塑料、橡胶和纺织涂层等。有机磷阻燃剂主要分为不含卤素的有机磷阻燃剂和含卤素的有机磷阻燃剂,含卤素的有机磷阻燃剂主要包括三(氯丙基)磷酸酯、三(2-氯乙基)磷酸酯和三(1,3-二氯-2-丙基)磷酸酯(TDCPP)等[1]。由于有机磷阻燃剂是通过非化学键添加到产品中,因此很容易释放到环境中,已经在室内空气[2]、房屋灰尘[3]、饮用水、沉积物和生物组织中检测到了有机磷阻燃剂[4]。TDCPP与有机磷农药有相似的结构,已有研究证明TDCPP能够对神经系统产生不良影响[5-6];近期研究也表明,TDCPP会干扰动物内分泌系统[7-8];一些研究还认为,暴露于TDCPP的禽类胚胎中含有异生代谢产物和免疫应答的肝相关基因的表达会发生改变[9];斑马鱼暴露于TDCPP的实验发现TDCPP能够显著改变肝脏炎症反应相关基因的表达[10]。但是,目前对TDCPP影响哺乳类动物肝脏毒性方面的研究还相对缺乏,并且由于环境中存在的有机磷阻燃剂不断被检出,其带来的生态风险和健康危害越来越受到人们的关注。
本研究主要观察典型有机磷阻燃剂TDCPP对大鼠肝脏的毒性效应及其程度,并探讨其发生机理,为有机磷阻燃剂的污染防治和相关疾病的有效治疗提供基础数据和科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料与仪器
SPF级SD大鼠购买自北京维通利华实验动物技术有限公司;TDCPP(>95%, Tokyo Chemical Industry, 日本);丙二醛(MDA)、超氧化物歧化酶(SOD)、乙酰胆碱酯酶(AChE)试剂盒购自南京建成生物工程研究所;特级初榨橄榄油购自西班牙阿布利尔。
瑞士Tecan多功能酶标仪平台Spark 10M;美国MD2880全自动生化分析仪;日本日立H-7650透射电镜;离心机(德国Eppendorf-5430);切片机(德国莱卡RM2015)。
1.2 实验方法
1.2.1 药物配制
TDCPP溶于橄榄油中配制药物,依据TDCPP对大鼠的半致死剂量,染毒组的暴露剂量分别为TDCPP半致死剂量的1/16、1/8和1/4,即125 mg·kg-1·d-1, 250 mg·kg-1·d-1和500 mg·kg-1·d-1,通过灌胃的方式给药,每日给药一次。
1.2.2 实验动物及分组
6~8周SPF级雄性SD大鼠60只,实验动物饲养于中国医学科学院放射医学研究所,每天12 h/12 h灯光白昼交替照射,室内温度控制22~24 ℃,湿度40%~60%。实验动物自由饮水及进食。
60只雄性大鼠随机分为5组,每组12只:空白组(Control),不做任何处理;溶剂对照组(Solvent),每天以相同体积的橄榄油灌胃;低剂量组,灌胃剂量为125 mg·kg-1·d-1;中剂量组,灌胃剂量为250 mg·kg-1·d-1;高剂量组,灌胃剂量为500 mg·kg-1·d-1。每周准确称取大鼠体重。并于第4、8周采用眼眶内眦方法取血。第8周末在各组中随机抽取3只大鼠,禁食12 h,以0.3 mL·(100 g)-1剂量注射10%水合氯醛麻醉,腹主动脉取血法收集血液,分离血清,取出肝脏,用生理盐水冲洗干净,一部分固定在甲醛中,一部分冻存在-80 ℃冰箱待检。
1.2.3 肝功能检测
在大鼠染毒期间的第4周和第8周,从不同组中分别随机选取6只大鼠,采用眼眶内眦法取血1~2 mL,静置30 min,4 ℃、2 500 r·min-1离心15 min,取血清置于离心管中。用全自动生化分析仪检测血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆固醇(CHO)和甘油三酯(TG)。
1.2.4 乙酰胆碱酯酶和氧化指标检测
乙酰胆碱酯酶(AChE)、丙二醛(MDA)和超氧化物歧化酶(SOD)使用南京建成试剂盒测定。
1.2.5 肝脏HE染色病理切片
切取适量肝脏组织后,迅速放入10%的福尔马林中固定48 h。用石蜡包埋肝组织,切片机切片,切片厚度控制在4~6m,用苏木精-伊红染色。
1.2.6 透射电镜观察肝脏超微结构变化
切取适量肝脏组织后,用2.5%的戊二醛溶液4 ℃固定过夜。用0.1 mol·L-1、pH 7.0的磷酸缓冲液漂洗样品;用1%的锇酸溶液固定样品1~2 h;再次漂洗;脱水处理;包埋剂包埋;切片机切片,获得70~90 nm的切片;切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5~10 min;在透射电镜中观察肝脏超微结构。
1.3 统计学分析
采用SPSS21.0和ORIGIN进行数据分析,单因素方差分析进行显著性分析,当P<0.05时,认为具有统计学意义,在统计学上具有显著性。
2 结果与分析(Results and analysis)
2.1 TDCPP对大鼠体重的影响
实验结果表明,在8周的给药期间,TDCPP灌胃能够引起大鼠体重降低,且随着灌胃剂量的增加,大鼠体重下降越明显,在8周的给药期间TDCPP染毒组的大鼠均表现为体重骤减,皮毛缺少光泽等不良状态,其中高剂量染毒组大鼠死亡一只。每周体重变化见图1,体重在灌胃一周后开始发生差异,与空白对照组和溶剂对照组相比较,TDCPP处理组大鼠的体重有下降的趋势,且具有显著性(*P<0.05),其中高剂量灌胃组的体重下降最为明显(**P<0.01)。
2.2 血清肝功指标
谷丙转氨酶(ALT)和谷草转氨酶(AST)在肝脏代谢中发挥重要作用,催化丙氨酸和天冬氨酸中的α-氨基转化为酮戊二酸中的α-酮基,分别生成丙酮酸和丁酮二酸[11]。ALT和AST活性水平常常作为肝毒性作用的实验室生物标志物,反映肝脏损伤。因此,为了评估TDCPP诱导的肝毒性,本实验在第4、8周末,每组随机选取6只大鼠检测血清中ALT和AST水平(图2a、2b),同时检测血清中胆固醇和甘油三酯水平以反映血清中脂质含量(图2c、2d)。

图1 三(1,3-二氯-2-丙基)磷酸酯(TDCPP)暴露8周后不同处理组的体重注:*TDCPP处理组与空白对照组和溶剂对照组比较P<0.05, **TDCPP处理组与空白对照组和溶剂对照组比较P<0.01。Fig. 1 The body weight of rats at different groups after tris(1,3-dichloro-2-propyl) phosphate (TDCPP) exposure for 8 weeksNote: Compared with blank control and solvent control,*P<0.05, **P<0.01.
结果显示,与空白对照组和溶剂对照组相比较,TDCPP染毒组大鼠血清ALT含量在第4周时出现下降趋势,且具有显著性(*P<0.05),第8周时出现持续下降的趋势(*P<0.05);TDCPP染毒组大鼠血清AST含量在第4周时与对照组相比较无显著差异,在第8周时,AST显著性降低(*P<0.05),其中中剂量灌胃组下降最为明显(**P<0.01);染毒组血清胆固醇含量在第4周时并无明显变化,第8周染毒组的胆固醇含量降低,且具有显著性(*P<0.05);染毒组血清甘油三酯的含量在第4周时与对照组相比较没有显著变化,在第8周时显著性降低(*P<0.05),其中,高剂量染毒组的甘油三酯含量降低最为明显(**P<0.01)。同时,实验数据表明,第4周和第8周大鼠血清中谷丙转氨酶、谷草转氨酶、胆固醇和甘油三酯的检测结果在各给药组之间无显著性差别(P>0.05)。
2.3 血清乙酰胆碱酯酶(AChE)活性与丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性
乙酰胆碱酯酶(AChE)与细胞的发育和成熟有关,参与细胞的迁移并影响炎症及免疫反应[12]。作为一种灵敏的生物标志物,AChE能够对环境中污染物的毒性做出快速应答,因此该方法被广泛应用于农药等毒物的监测中。本实验在第8周末,每组随机选取6只大鼠检测血清中AChE水平(图3a);同时,为了检测TDCPP所引起的氧化损伤,本实验还检测了第8周大鼠血清中丙二醛(MDA)水平和超氧化物歧化酶(SOD)活性(图3b和3c)。

图2 TDCPP暴露4周和8周后对大鼠血清中谷丙转氨酶、谷草转氨酶、胆固醇和总甘油三酯的影响注:*TDCPP处理组与空白对照组和溶剂对照组比较P<0.05,**TDCPP处理组与空白对照组和溶剂对照组比较P<0.01。Fig. 2 The changes of the activities of alanine aminotransferase (ALT) and aspartate aminotransferase (AST), and the contents of cholesterol (CHO) and triglyceride (TG) in serum of the rats after TDCPP exposure for 4 and 8 weeksNote: Compared with blank control and solvent control,*P<0.05, **P<0.01.
结果显示,TDCPP染毒组与空白对照组和溶剂对照组相比较,染毒组AChE的活力显著性下降(*P<0.05,**P<0.01),且具有剂量依赖性。图3a显示高剂量给药组与中剂量给药组相比较、高剂量给药组与低剂量给药组相比较AChE活性均显著性下降(#P<0.05),表明随着染毒剂量的升高,肝细胞受到损害越严重,导致AChE活性显著性下降。图3b和3c显示,与对照组相比较,染毒组的MDA水平显著性升高,SOD活性显著性降低(*P<0.05,**P<0.01),其中,MDA含量组间比较结果显示,TDCPP所引起血清中MDA含量的升高具有剂量依赖性,即随着TDCPP染毒剂量的升高,血清中MDA含量升高现象越显著,高剂量给药组与低剂量给药组相比较MDA含量显著性升高(#P<0.05),表明TDCPP能够对大鼠造成严重的氧化损伤。
2.4 肝脏组织HE染色石蜡切片和超微结构观察
光镜下观察不同组别大鼠肝细胞的一般形态,如图4所示,空白对照组(图4A)与溶剂对照组(图4B)的肝组织结构完整,细胞索排列整齐,以中央静脉为中心向四周呈放射状排列,细胞分界清,核圆而清晰,位于细胞中央;低剂量染毒组中部分细胞核出现固缩坏死现象,可见少量的淋巴、中性粒细胞浸润(图4C);中剂量染毒组(图4D)发现肝小叶轮廓清晰,肝窦轻度扩张和肝细胞弥漫性浊肿;高剂量染毒组(图4E)肝脏组织严重损伤,肝正常组织结构不清,细胞索排列不整齐,肝小叶轮廓不清,肝窦轻度缩窄;肝管上皮肿胀,可见坏死、脱落。透射电镜观察肝脏组织切片超微结构(图5A~E),结果显示,空白对照组(图5A)和溶剂对照组(图5B)肝细胞结构正常,细胞核和细胞器未出现损伤,低剂量染毒组肝细胞线粒体嵴融合(图5C);中剂量染毒组肝细胞核固缩变形,线粒体嵴出现融合现象(图5D);高剂量染毒组肝细胞核固缩变形,线粒体空泡化现象严重,并在肝细胞中发现了自噬结构的形成(图5E)。
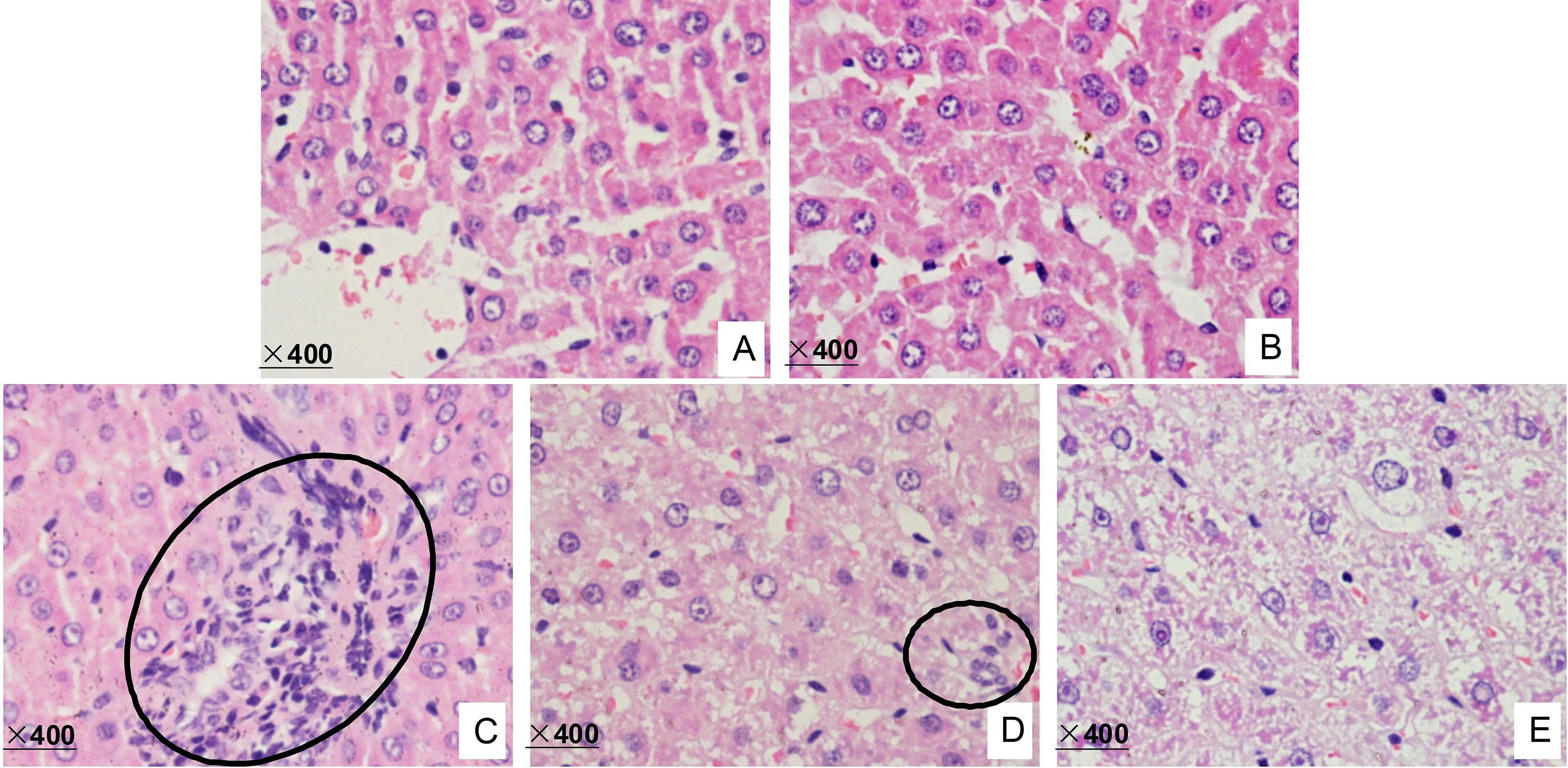
图4 不同处理组肝脏组织苏木素、伊红染色图(×400)注:A,空白对照;B,溶剂对照;C,125 mg·kg-1·d-1;D,250 mg·kg-1·d-1;E,500 mg·kg-1·d-1。炎症细胞在图中用○标注。Fig. 4 The illustration of the hematoxylin and eosin (HE) staining of liver tissues at different groups (HE×400)Note: A, Control; B, Solvent; C, 125 mg·kg-1·d-1 treatment; D, 250 mg·kg-1·d-1 treatment; and E, 500 mg·kg-1·d-1 treatment. Inflammatory cells were denoted by ○.
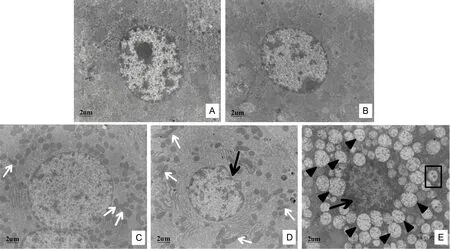
图5 TDCPP暴露引起大鼠肝脏组织超微结构损伤注:A,空白对照;B,溶剂对照;C,125 mg·kg-1·d-1;D,250 mg·kg-1·d-1;E,500 mg·kg-1·d-1。图中损伤线粒体嵴融合用白色箭头标注,细胞核固缩变形用黑色箭头标注,线粒体空泡化用▲标注,自噬结构用□标注。Fig. 5 The evidence of TDCPP-induced damage of hepatic ultrastructureNote: A, Control; B, Solvent; C, 125 mg·kg-1·d-1 treatment; D, 250 mg·kg-1·d-1 treatment; E, 500 mg·kg-1·d-1 treatment. The ridge fusion of damaged mitochondrial was denoted by white arrows; the contraction deformation of cell nucleus was denoted by black arrows; mitochondrial vacuolation was denoted by ▲; autophagosome was denoted by □.
由肝脏组织病理学检测结果可知TDCPP可导致肝细胞呈现出不同程度的坏死,且随着染毒剂量的增加,肝细胞的坏死程度越高。
3 讨论(Discussion)
近年来,有机磷阻燃剂(OPFRs)作为阻燃剂和增塑剂广泛应用于商业产品生产中,世界范围内对OPFRs的需求量和生产量也在逐年增加。有机磷阻燃剂对于人类生活来说是必不可少的,但越来越多的OPFRs也随之进入到环境中,如大气、土壤和水体。一方面,空气颗粒物、室内灰尘、办公设备、食物和饮用水中均含有微量的有机磷阻燃剂,这些有机磷阻燃剂可以通过不同的方式参与到人类的生产和生活过程当中,从而对人体健康产生潜在危害;另一方面,OPFRs也会进入到生态系统中,进而对生态系统产生一定的不良影响[13]。
诸多研究表明,有机磷阻燃剂在不同浓度下对生物有着不同程度的影响,如引起鱼类氧化应激、脂质过氧化、抑制胆碱酯酶活性等[14-16],引起啮齿类动物代谢紊乱[17],影响禽类动物甲状腺内分泌系统[18-19]。有研究表明,部分有机磷酸酯具有致癌性,因而使人们对其毒性的问题也日益关注。
肝脏作为机体内最重要的解毒器官,可以将有毒物质通过一系列代谢酶的作用,转化为低毒或无毒产物,排出体外,转氨酶在该过程中起着重要作用。本研究观察到TDCPP可引起大鼠血清中的ALT和AST活性下降,在第4周时观察到已有下降趋势,在第8周时,染毒组的ALT和AST活性显著性降低,与空白对照组和溶剂对照组相比较差异显著(P<0.05)。目前的研究表明,TDCPP能够引起大鼠血清中转氨酶代谢紊乱,产生毒性反应。进一步实验结果表明,TDCPP能够引起大鼠血清乙酰胆碱酯酶的活性降低,染毒组血清中乙酰胆碱酯酶的活力与空白对照组和溶剂对照组相比较显著性降低(P<0.05),且具有剂量依赖性,表明肝脏合成功能受损。
外源性化合物可以通过产生大量活性氧而造成对机体的损害,而机体内的抗氧化酶组成了防御过氧化系统,可清除活性氧、控制脂质过氧化水平,保护机体免受氧化损伤[20]。在本实验中,TDCPP染毒8周后,大鼠血清中抗氧化酶SOD活性受到显著性抑制,其中,高剂量染毒组最为显著(P<0.01)。MDA是不饱和脂肪酸脂质过氧化产物,作为抗氧化能力的重要指标,其含量可以间接反映机体细胞的膜系统的氧化损伤程度[21]。本研究发现随着TDCPP染毒剂量的增加,大鼠血清中MDA的含量也显著性增加(P<0.05)。实验结果表明,TDCPP诱导大鼠体内产生大量的活性氧,造成氧化损伤。组织病理检查的结果也表明,TDCPP可引起大鼠肝细胞损伤,主要表现为核固缩、线粒体损伤和炎症细胞浸润等现象。
综上所述,本实验结果显示,TDCPP暴露8周后可损伤大鼠的肝脏功能,主要表现为TDCPP对大鼠肝脏的转氨酶活性、血脂代谢和合成功能等造成了较为严重的破坏,同时对大鼠机体造成了严重的氧化损伤,且从4周和8周生化指标对比来看,大鼠肝脏中毒程度在进一步恶化。TDCPP的肝脏毒性损伤可能与其破坏肝脏转氨酶功能,引起机体抗氧化系统损伤,导致机体脂质过氧化反应增加有关。本研究补充了TDCPP在哺乳类动物肝脏毒性方面的数据,另外,本实验会进一步检测TDCPP对大鼠肝脏的损害程度,研究TDCPP是否能够诱发肝脏相关的潜在疾病并揭示其引起肝脏损伤的机理[22]。
