彗星实验技术及其应用
2018-03-16李岗吴声敢蔡磊明
李岗,吴声敢,2,3,4,蔡磊明,2,3,4,*
1. 浙江省农业科学院 农产品质量标准研究所,杭州 310021 2. 浙江省农业科学院 农业部农药检测重点实验室,杭州 310021 3. 浙江省农业科学院 浙江省农药残留检测与控制研究重点实验室,杭州 310021 4. 浙江省农业科学院 浙江省植物有害生物防控省部共建国家重点实验室培育基地,杭州 310021
1 发明与发展(Devised and developing comet assay)
彗星实验(comet assay)也叫单细胞凝胶电泳实验(single cell gel electrophoresis, SCGE),是瑞典科学家O. Ostling和K.J. Johanson于1984年发明,刊登在期刊《生物化学与生物物理研究通讯》上,当初叫“微电泳技术(microelectrophoresis)”。实验中,把鼠淋巴细胞L5178Y-S和中国仓鼠的成纤维细胞C1-1悬浮,进行物理辐照后,包埋在琼脂糖胶中,在中性缓冲液中裂解细胞,接着在5 V·cm-1电场中电泳5 min,再用吖啶橙染色,最后用荧光显微镜镜检。发现DNA向阳极迁移,辐照后的细胞更明显,还发现受辐照细胞能在1 h内修复超过50%的损伤[1]。
1988年彗星实验迎来第一次重大改进。Singh进一步发明了低水平损伤DNA的定量检测技术,把人白细胞暴露于X射线和H2O2后,琼脂糖胶包埋,接着裂解和电泳都改为碱性条件下进行,因为中性细胞裂解液和中性电泳液不能检测单链断裂类型的DNA损伤。改进后发现,H2O2处理的DNA迁移模式比X射线的要整齐和同质(homogeneous)。不同类型的细胞对DNA损伤的修复能力有很大差异。Singh改进后的彗星实验技术适用检测单个细胞DNA损伤和修复,所需细胞少,1 000个就足够,细胞不需要放射性标记,因此,此法适用于任何有核细胞。还能检测同一种群的细胞对DNA损伤物的不同反应[2],此后,1990改名为彗星实验[3]。
1993年彗星实验又一次改进。1993年以前,彗星实验只能检测DNA是否有断裂损伤,不能分辨非断裂损伤,不能确定DNA损伤类型。改进后的彗星实验,可以确定氧化型非断裂损伤。即解旋后用核酸内切酶Ⅲ(thymine glycol DNA glycosylase-Endo III, endonuclease III)处理DNA,可识别氧化损伤的嘧啶[4-6]。同样,用甲酰氨嘧啶DNA糖基化酶fpg (formamidopyrimidine DNA glycosylase, fpg)处理后,可识别氧化损伤的嘌呤[7],如8-氧鸟嘌呤,这些酶可造成氧化损伤部位的DNA断裂,增加慧尾的含量。因此,可用酶切慧星实验检测非断裂型DNA氧化损伤,如用Ro19-8022和可见光(主要产生8-氧鸟嘌呤)暴露肺癌细胞系A549,在细胞裂解后,用fpg处理类核体30 min或45 min,可显著增加慧尾的浓度[8-9]。fpg修饰的彗星实验检测大鼠的不同组织细胞暴露于甲基磺酸甲酯(methyl methanesulfonate, MMS)后,产生高水平的氧化的或烷基化的碱基或fpg伤口[10]。抗氧化剂对氧化损伤DNA的影响实验表明,非吸烟健康人连续12周暴露在不同的类胡萝卜素单体下,其淋巴细胞的内源性氧化损伤并没有受到显著影响,未见高水平的DNA断裂损伤[11],混合维生素C、维生素E和ß胡萝卜素干预非吸烟人和吸烟人,可显著降低二者淋巴细胞的内源性DNA氧化损伤[12],而吸烟人的高水平的氧化碱基在20 d后消失了,发现抗氧化剂的种类和剂型对氧化损伤的DNA修复有潜在的影响,如维生素C的缓释剂型和快释剂型对DNA损伤修复的效果不同,男性吸烟者只摄入缓释型维生素C可以显著减少fpg或核酸内切酶Ⅲ识别的损伤位点[13]。改进后的酶切彗星实验还能提供基因的遗传多态性相关的遗传背景与环境因子信息,如着色性干皮病(xeroderma pigmentosum group D, XPD)基因的编码区312-751,纯合野生型基因型的彗尾密度比癌症病人低2倍,暗示维持正常的DNA修复活性能抑制癌症的发生和发展[14]。
彗星实验常和微核实验同时进行,从不同角度探索毒物的损伤效应。彗星实验主要测定原始的DNA断裂损伤,而微核实验测定的是DNA不可修复的损伤,这些损伤是非修复的或不正确修复的损伤。2种实验的结果常呈正相关。例如,非洲爪蟾幼蛙暴露在甲基磺酸乙酯(ethyl methanesulfonate, EMS)后造成其红细胞DNA损伤和微核率增加[15]。彗星实验还和其他指标如活性氧(ROS)结合,探索毒性机制,如乙草胺通过诱导ROS造成花背蟾蜍(Strauchbuforaddei)的DNA损伤,同时发现N-乙酰半胱氨酸(N-acetyl-l-cysteine, NAC)和褪黑素(melatonin, MEL)可减轻乙草胺造成的DNA损伤[16]。
自从Singh提出碱性彗星实验后,在遗传毒性检测中得到快速发展。1999年,欧洲国家成立了一个彗星实验专家组,一致推荐Singh的碱性彗星实验作为检测化学品遗传毒性的标准方法,该法经优化后,可用于检测单链断裂的DNA损伤、碱性不稳定位点、DNA-DNA或DNA-蛋白质交联损伤和单链断裂的不完全切除修复位点。其特点是:可检测低水平的DNA损伤,只需少量细胞,灵活经济,简便快速,例如检测DNA损伤的修复能力。DNA损伤的修复类型有(1)切除修复。包括切除碱基缺失位点、8氧鸟嘌呤、单链断裂缺口、大体积的加合物和环丁烷嘧啶二聚体等,切除修复路径主要受翻译后修饰调控[17]。(2)重组修复。修复的是双链断裂的缺口和链间交联。(3)错配修复。修复的是碱基的错配、插入或缺失[18-19]。细胞应对DNA损伤,通过激活复杂的信号通路来决定细胞的命运,或者促进细胞死亡,或修复损伤而存活[20]。尽管细胞存在这些修复机制,但是DNA的损伤依然保持在较高的水平,至少在健康的人体中是这种情况。DNA的修复能力可看作是突变或癌症的有价值的标志物,因为差的修复能力与高风险的癌症相关,例如,头颈鳞状癌细胞的DNA修复能力就很差[21]。DNA的修复潜能经常用DNA芯片或RT-PCR方法,测定修复通路基因的转录水平,但是它的酶活性不仅依赖转录或翻译水平,还要依赖表型分析的结果[22]。检测修复过程动态的最简单的方法是进行彗星实验,暴露于DNA损伤物后,在不同的时间点取样测定,进行挑战实验(challenge assay)。例如,用水溶性的ß胡萝卜素或番茄红素培养的淋巴细胞,暴露在博来霉素(bleomycin)或H2O2下,结果表明ß胡萝卜素能保护DNA链,防止其断裂,但是不能阻止其碱基的氧化损伤[23]。而ß隐黄素(β-cryptoxanthin)能保护HeLa细胞和Caco-2细胞免受H2O2诱导的DNA损伤,呈现明显的DNA修复效应。因此,标准的彗星实验可用来测定细胞对DNA损伤的修复能力。
2000年,欧洲食品安全局主张采用系列实验来评估化学品的遗传毒性,即首先对化学品进行细菌回复突变实验(后采用OECD TG471准则[24])和体外微核实验(后采用OECD 487[25]),只要有一个实验结果呈阳性,再进行3个体内实验,包括哺乳动物红细胞微核实验(即OECD TG474准则[26])、彗星实验(即OECD TG489准则[27])和转基因啮齿动物细胞基因突变实验(即OECD TG488准则[28])。
2014年,经济合作与发展组织(OECD)专门发布哺乳动物体内彗星实验准则即OECD TG489[27],内容包括实验原理、局限性、对照信息、方法的详细描述和彗星图象定量打分(推荐采用的自动和半自动软件)。其中重要的是对细胞彗星图象进行定义,分成3类,可打分的(scorable),非打分的(non-scorable)和刺猬形(hedgehog)。可打分的彗星细胞定义为慧核和慧尾清晰且不与其他细胞重叠的细胞。彗星评价采用慧尾DNA的百分数或慧尾强度(tail intensity, TI),表示DNA的断裂量,再结合校正曲线和已知条件即每个Gy可诱导每109Dalton DNA中0.3个断裂,可计算实际DNA的断裂频率,校正曲线是gamma射线或X-ray的剂量(0~10 Gy)为自变量与慧尾DNA的百分数为因变量之间建立的线性关系[29-30]。刺猬形细胞DNA也叫鬼魂细胞(ghost cell)或云状细胞,认为它是一种严重损伤的细胞(慧核小或不存在,大的弥散状尾巴)。通过图像分析得到的TI不可靠,对刺猬细胞应该单独评价,它的形成机制还不清楚。大鼠肝细胞彗星实验表明,它可能是破碎细胞时的机械损伤或试剂诱导的细胞毒性[31]。刺猬形彗星也不能认为是凋亡细胞或细胞毒性。这样的慧星常表示连续的DNA损伤,应该对其进行全面评估[32]。
2 技术要点(Methodical critical steps)
彗星实验经过不断改进,其共同基本步骤包括制备悬浮细胞、凝胶包埋、细胞裂解、解旋、电泳、中和、染色和图象分析。体外彗星实验,先获得悬浮细胞后暴露处理。体内彗星实验,制备悬浮细胞前实验个体进行暴露处理。其中实验成败的关键步骤应包括:
2.1 制备悬浮细胞
获得悬浮细胞因物种而异。人、鼠、鱼等常从其循环系统中获取细胞,如血细胞或淋巴细胞。
蚯蚓的小细胞常用于彗星实验,小细胞来自蚯蚓的体腔液,是体腔液中含量最丰富的细胞,类似于脊椎动物的白细胞。蚯蚓体腔细胞的收集方法,包括提取液法、穿刺法、电击法和超声波法等[27,33]。其中提取液法最常用,其包含:5 mmol·L-1Na2-EDTA(乙二胺四乙酸)或EGTA(乙二醇二乙醚二胺四乙酸)、50.4 mmol·L-1或10 mg·mL-1愈创木酚甘油醚、95%生理盐水(即0.85 g NaCl溶于每100 mL H2O)或磷酸盐缓冲液(PBS)和5%乙醇或甲醇,pH 7.3~7.5。其中EDTA或EGTA和生理盐水或PBS的作用是维持活细胞正常活性。愈创木酚甘油醚的作用在于溶解细胞粘液,释放细胞。乙醇或甲醇的作用刺激蚯蚓释放体腔液。
植物彗星实验最大困难是获得悬浮细胞或类核,常用根和叶进行[34-35],实验方案因组织或物种而异[36],通常的碱性溶液提取方法不能从植物细胞中释放完整的DNA,用机械破碎或化学处理的方法可对DNA造成新的损伤,叶片中的高浓度色素如叶绿素和代谢物对分离DNA可能造成新的损伤,所以,弃用叶片细胞而选用根尖细胞,但是高频率分裂的细胞对实验又产生影响。尽管植物细胞彗星实验比较困难,但是也有成功的例子,例如Cr(VI)对豌豆(Pisumsativum)DNA损伤实验[37],Cd-Zn对烟草的影响[38]。
目前认为悬浮细胞中的活细胞应不少于70%~75%,才能得到可靠的结果[39],通常用苔盼蓝染色法检测活细胞百分数。
2.2 凝胶包埋
常用低熔点琼脂糖凝胶包埋细胞,在三层胶法中,还用正常熔点凝胶固定低熔点胶,防止在后继的浸泡步骤中胶从载胶板上脱落。所以,低熔点胶的浓度至关重要。不同人外周淋巴细胞和淋巴母细胞系TK-6的结果表明,胶浓度在0.6%~0.8%比较合适,太低,胶不稳定,太高,损害慧尾。胶浓度与慧尾长度呈明显的线性关系。损伤细胞对胶浓度更敏感。胶不能反复熔化,应该分装保存[40]。OECD建议低熔点琼脂糖凝胶为0.5%~1%,不建议低于0.45%(OECD 489)[27]。
2.3 细胞裂解
对包埋在低熔点胶中的完整细胞进行裂解,常用细胞裂解液的通用配方是:10 mmol·L-1Tris-HCl,100 mmol·L-1Na2EDTA,2.5 mol·L-1NaCl,10% 二甲基亚砜(DMSO),1% Triton X-100,pH 10,裂解条件是4 ℃、至少60 min。其中Tris-HCl是缓冲体系,维持稳定的pH值。Na2EDTA是变性剂和稳定剂。DMSO是DNA保护剂,防止自由基对DNA的损伤。Triton X-100是表面活性剂,破坏细胞,类似的有SDS(十二烷基硫酸钠,一种强变性剂和蛋白溶解剂)和肌氨酸钠(sodium carcosinate),也有在裂解液中加入蛋白酶K和氯化钙,如提高对口哨蛙(Eleutherodactylusjohnstonei)细胞的裂解能力[41-42]。

表1 OECD 489推荐的彗星实验阳性对照及其靶组织Table 1 Positive control substances and its target tissues in comet assay recommended by OECD 489
注: OECD 489为经济合作与发展组织在2014年9月26日发布的化学品试验导则:哺乳动物体内碱性彗星试验。
Note: OECD 489 has been published by OECD on 26th September 2014. It is a guideline for the testing of chemicals:invivomammalian alkaline comet assay.

2.4 碱性解旋
解旋液和电泳液是同一种溶液,OECD 489建议配方和条件是:1 mmol·L-1Na2EDTA,300 mmol·L-1NaOH,pH≥13,4 ℃至少解旋20 min,电泳条件是4 ℃,0.7 V·cm-1,20~40 min。DNA迁移与电泳时间呈线性相关。对人外周淋巴细胞和淋巴母细胞系TK-6,以电压1.15 V·cm-1,电泳20 min为佳,低于0.49 V·cm-1,慧尾不能展开,大于1.48 V·cm-1,慧尾从慧核上断离,人为增加损伤程度[40],需要记住的常识是,同样的电泳迁移距离时,单位电压与时间的乘积是个常数。
2.5 细胞密度
彗星的数量或密度影响图像分析与评价,因此细胞或彗星不能重叠,以免影响彗星计分。为便于统计分析,需要对至少50个细胞进行图象分析。而有效实验能给出定性判断的最少细胞数为30个。
2.6 阳性对照
彗星实验必须设置阴性对照和阳性对照,保证实验设计的合理性,实验结果的可靠性和有效性。OECD 489推荐的哺乳动物常用阳性对照,包括甲基磺酸乙酯(EMS)等,见表1。
这些阳性对照,可能也适用于非哺乳动物,如海鳟(Salmotrutta)和北极嘉鱼(Salvelinusalpinus)的精细胞暴露在甲基磺酸甲酯(MMS)中,可造成DNA损伤,并且后代的骨胳发育异常,表明这种损伤具有遗传性[43]。三刺鱼(Gasterosteusaculeatus)精子在体外受精前,体外暴露在MMS中,可造成后代的胚胎发育异常[44]。另外,4-硝基喹啉N-氧化物(4-Nitroquinoline N-oxide)是模式遗传效应毒物,会造成斑马鱼DNA损伤和产卵量下降[45-46]。
成功的彗星实验要考虑3个方面因素,一是细胞的类型如淋巴细胞、生殖细胞或细菌细胞、二是诱导物类型如X射线、伽马射线、乙醇、乙醛、疾病、生活类型因素。三是方法学因素如电泳槽、载胶板、分析参数等。
3 典型应用(Main application field)
用“comet assay”作关键词在2016年的PubMed和Web of Science中搜索,可得近万篇期刊文章。涉及的主要应用领域包括:毒理学30%,遗传学15%,环境生态科学11%和应用微生物技术9%。彗星实验还有专门的交流网站http://www.cometassay.com/。
3.1 两栖动物彗星实验
绿蛙(Lithobatesclamitans)和非洲爪蟾(Xenopuslaevis)等的成体或幼体的红细胞常用于体内彗星实验,见表2。
测定的毒物效应包括,除草剂[42]、杀虫剂[47]、MMS[15]、EMS[15]、苯并芘[15]、硫化染料[48]、金属[49]、石油化工产物[50]、持久性有机污染物(persistent organic pollutants, POPs)[51]、抗生素[41]、二甲基亚砜(dimethyl sulfoxide, DMSO)[41]、污染的湖水[52]、煤矿[53]、垃圾场[54]、污泥[55]、污水[56-57]、城市固体废物的焚烧物[58]和电磁场的影响[59]等。
两栖动物彗星实验方案,差别较大。1997年之后的实验,细胞裂解液中才开始含有洗涤剂(表面活性剂)如Triton X-100、DMSO、SDS、肌氨酸钠、蛋白酶K和氯化钙等,来提高对细胞的裂解能力。细胞裂解时间25 min至7 d。细胞裂解温度是4 ℃,而2005年之前是室温。低熔点琼脂糖浓度通常为0.5%,范围通常是0.4%~1.0%,浓度越高,慧尾越少[60]。解旋变性通常是pH>13条件下5~40 min,时间越长,慧尾越多[60]。电泳电压是18~27 V,电流是300 mA,也有用V·cm-1表示的。这些实验方案的差异,限制了实验结果的可比性。
3.2 鱼类彗星实验
最早的鱼类彗星实验是用加拿大五大湖的棕鲴鱼(brown bullhead,Ameiurusnebulosus)和普通鲤鱼(common carp,Cyprinuscarpio)对湖中沉积物的暴露实验,提取它们的红细胞进行singh于1988年提出的碱性彗星实验[61]。鱼的血细胞是最常用的彗星实验材料,因为易得,易分离,而且所有鱼的血液细胞都是有核细胞。而其他组织细胞如肝、肾、腮[62-64]、精细胞[65]也经常用于彗星实验[65]。鱼的酶切彗星实验首次运用是在2003年[66],涉及的细胞有:血细胞、肝细胞、腮细胞[67]和细胞系[68]等。
截止2017年,已经有90多种鱼用于彗星实验,实验类型有体内实验(invivo)[69]、体外实验(invitro)[68]、离体实验(exvivo)[44]和原位实验(insite)[70]。涉及的毒物包括POPs[71]、金属[64]、农药[72]、药物[73]、内分泌干扰物如四溴双酚-A[74]、纳米颗粒[75]、生物毒素[76]、核辐射[77]和紫外线[78]等。
鱼类像两栖类一样,也没有标准的彗星实验方案,见表3。但是,鱼的室内实验和野生鱼的生物监测实验中,要求使用标准的采样方案[79]。
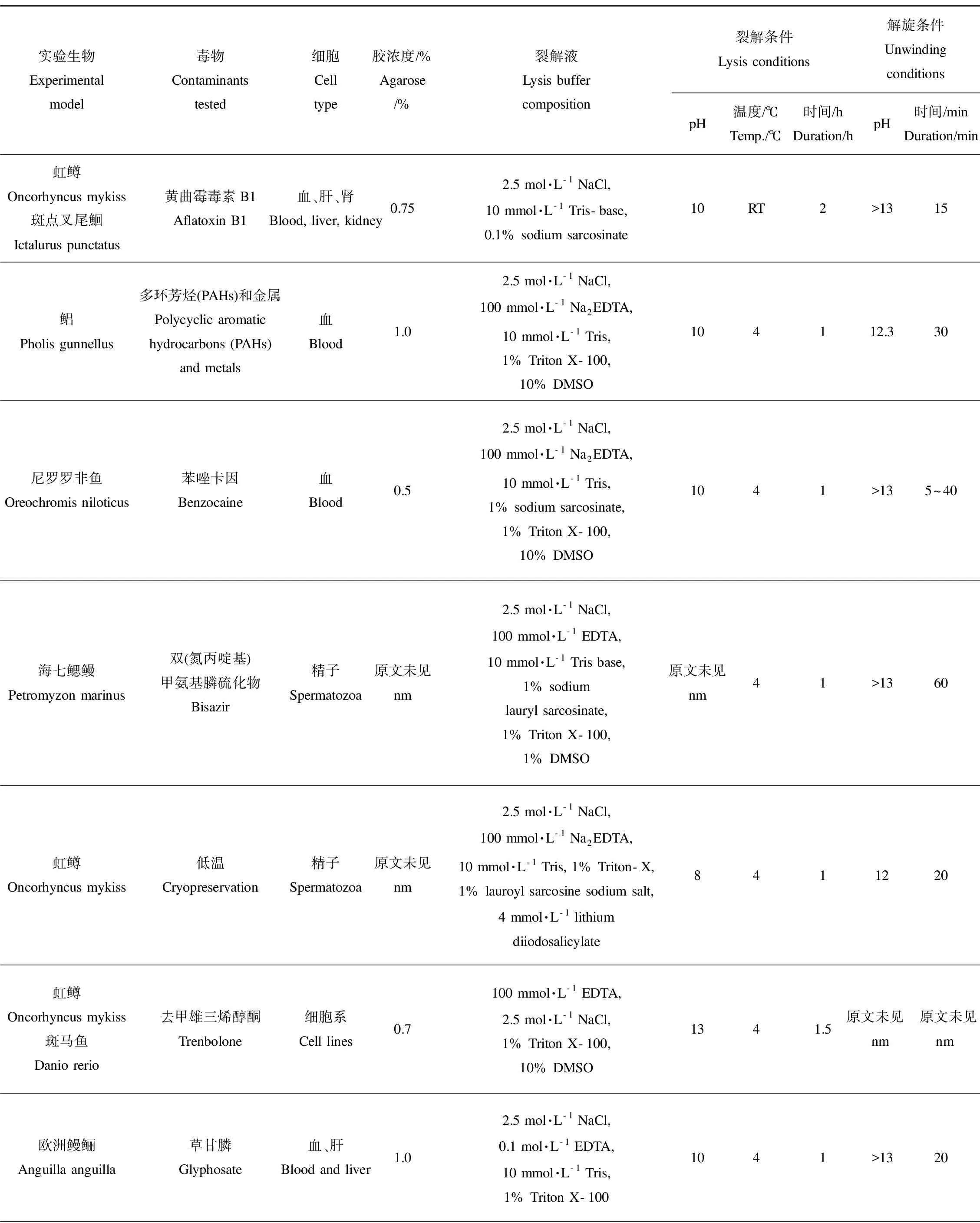
表3 常见鱼类彗星实验条件Table 3 Summary of comet assay parameters on fish
注:nm表示原文未提到。
Note: nm stands for not mentioned.
注:CeO2-NP表示CeO2纳米颗粒。
Note: CeO2-NP stands for CeO2Nano particles; DNAse stands for deoxyribonuclease; BCPAP stands for a papillary thyroid cancer-derived cell line.
3.3 蚯蚓彗星实验
蚯蚓的小细胞常用于彗星实验,小细胞来自蚯蚓的体腔液,是体腔液中含量最丰富的细胞,类似于脊椎动物的白细胞。蚯蚓体腔细胞的收集方法,包括提取液法、穿刺法、电击法和超声波法等[33]。
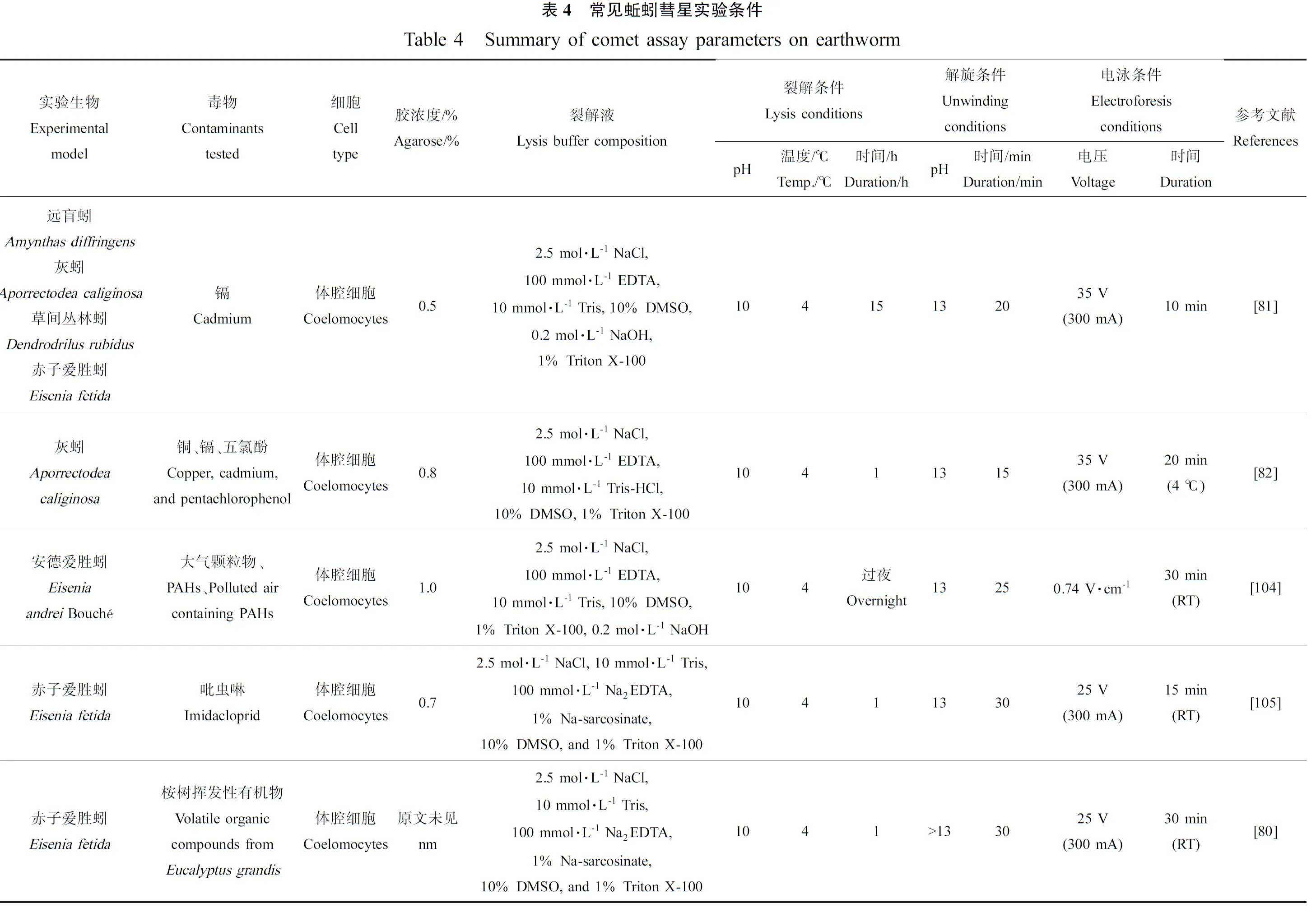
有多种蚯蚓用于彗星实验,如Eiseniafetida[80]、Amynthasdiffringens[81]、Aporrectodeacaliginosa[82]、Dendrodrilusrubidus[81]、Lumbricusterrestris[83]和Microchaetusbenhami[81]等,其中E.fetida是最常用的品种,为OECD和美国环境保护局(EPA)推荐,E.fetida和A.caliginosa对污染物有相同的敏感性[82],而D.rubidus对重金属Cd最敏感,其次是E.fetida[81],例见表4。
3.4 哺乳动物精细胞彗星实验
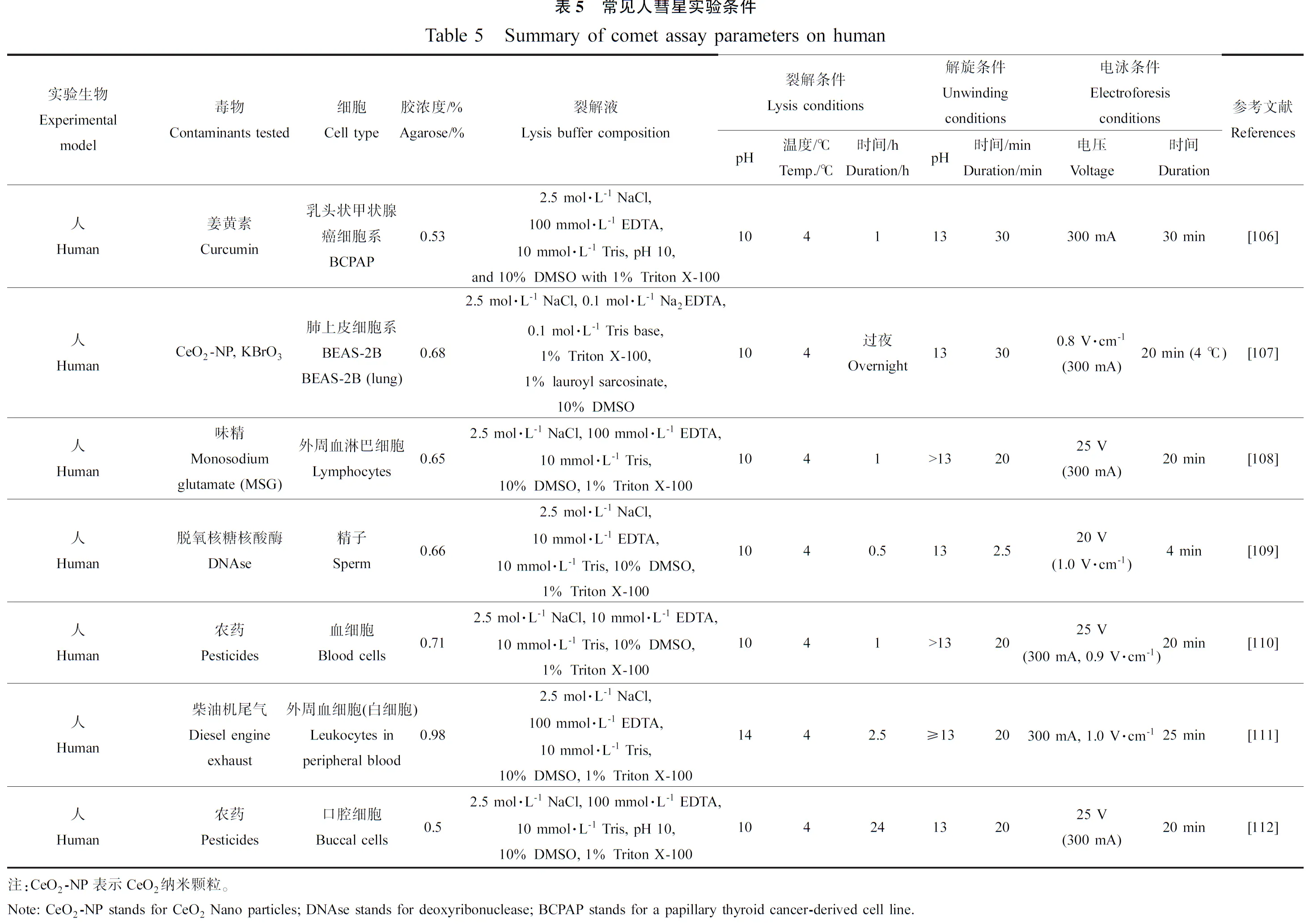
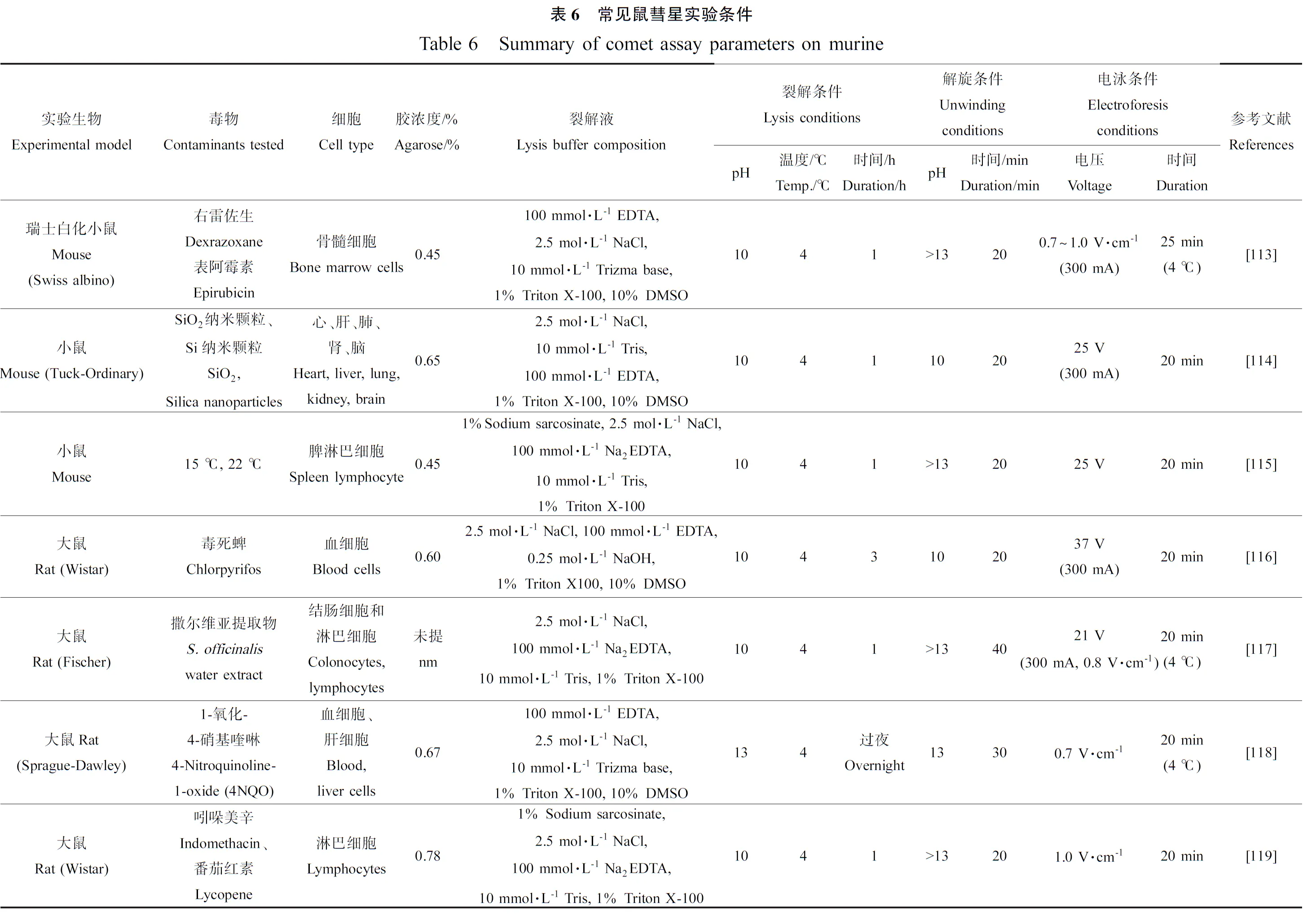
哺乳动物的彗星实验,人和鼠最常见,涉及的细胞主要是血细胞和淋巴细胞,其他还有心、肝、肺、肾、脑、骨髓等细胞,例见表5和表6。
常用改进的彗星实验检测精子的DNA损伤与不孕的关系[84],叫做二维垂直慧尾彗星实验TT-comet (two-dimensional perpendicular tail comet assay, TT-comet),适合区分单链断裂和双链断裂的精细胞[85]。精细胞和体细胞对相同毒物的反应差别很大,因为体细胞的异染色质是组蛋白而精细胞的则是精蛋白[86]。因此,去除对照的DNA结合蛋白的裂解条件具有物种的特异性,不同物种的精细胞DNA的结构不同,因而,不同物种的TT-comet条件各不相同,需要摸索。一般,去除蛋白的精细胞DNA先进行中性电泳,产生双链断裂的慧尾,然后转胶90度,进行碱性电泳,产生单链断裂的或碱不稳定的慧尾。
4 存在的问题与注意点(Questions and defects)
(1)大部分已经发表的文献,彗星实验设计缺少阳性对照,降低了实验的正确性和合理性。可参考OECD 489推荐的彗星实验阳性对照(见表1)。另外,文献中提供的彗星实验图片较少,只有统计图表,这样说服力不强,降低了文章的可靠性,在引用时需要注意。还需要了解的是,2016年以前的彗星实验,以低通量为主,一次实验的处理数和重复数设置都不是太多。
(2)彗星实验方案不统一,每种生物基本没有标准的实验方案,限制了结果的可比性。不同物种,不同细胞类型使用同一种实验,可能导致实验失败,例如,在蚯蚓体腔细胞的彗星实验中,细胞裂解液中的Triton-100浓度采用通常值1%,就不合适(未发表),很难得到完美的实验图象。
(3)DNA链的断裂损伤类型因组织和细胞类型而异[87]。因此,不能用血细胞DNA损伤类型和程度来推断其他细胞DNA的损伤。如,用彗星实验比较细鳞鯻(Theraponjarbua)的腮细胞、肾细胞和血细胞对氯化汞损伤的敏感性,结果表明腮细胞最敏感、肾细胞次之、血细胞最不敏感[88]。同样,不能用不同类型的细胞进行修复能力的相互推断[60],如剑尾鱼(Xiphophorusspecies)脑部细胞对核苷酸切除修复能力大于腮部和肝部细胞[89]。
(4)注意细胞周期对彗星实验结果的影响。细胞处于不同周期如S期或M期,进行彗星实验,都能进行损伤测定[90-91],在碱性条件下S期的DNA迁移速度比中性条件下快,因为在碱性条件下S期的DNA呈复制叉状,类似单链断裂DNA,而在中性条件下呈复制泡状[92]。
(5)运用彗星实验结果评价毒物的DNA毒性时,还必须考虑非毒物相关因子,包括生物的和非生物因子对彗星实验的影响。例如,水中缺氧或氧过饱和时,都能增加鲤鱼(Cyprinuscarpio)的DNA损伤,幅度约为正常氧浓度的20%[93]。激流中生活的白鲑(Leuciscuscephalus)DNA损伤会增加,暗示生活在污染激流中的鱼面临更为严重的DNA损伤风险[67]。实验生物的年龄、性别等对彗星实验结果也有影响,如成年法国比目鱼(Limandalimanda)面对同样的毒物,雄性DNA损伤比雌性高,幼鱼则相反,成年鱼比幼鱼高[94]。此外,需要评估组织取样时使用的麻醉剂对DNA可能造成损伤。但是,苯唑卡因(benzocaine)对罗非鱼(Niletilapia)的彗星实验结果无影响[95]。
