珠子参皂苷脂质体凝胶剂的制备及皮肤毒性实验研究
2018-03-16张继红王海燕李小妹石孟琼李小琴张永峰陈茂华刘宏军
张继红 王海燕 李小妹 石孟琼 李小琴 张永峰 陈茂华 刘宏军 罗 涛 邹 坤
(1. 三峡大学 中医临床医学院/三峡大学 脾胃病研究所,湖北 宜昌 443002; 2. 三峡大学 生物与制药学院,湖北 宜昌 443002; 3. 三峡大学 医学院,湖北 宜昌 443002)
作为新型胶体给药系统的脂质体,由于其良好的生物相容性,靶向性和膜通透性的可控性,有助于药物迅速穿透皮肤,聚集在作用部位,形成药物储库而维持较为恒定的有效血药浓度,发挥缓释及降低不良反应的作用[1].凝胶剂具有较好的延展性和生物粘附性,外用可直接从给药部位吸收,避免了肝脏的首过效应.近年来,将两者结合制备成脂质体凝胶在外伤、皮肤疾病和护肤美容治疗等方面得到了广泛的应用.
五加科人参属植物珠子参(Panacismajorisrhizoma)为土家民间习用草药.其味苦、甘,微寒,归肝、肺、胃经,具有散瘀止血,活血定痛,解毒消肿等功效,主治咯血、吐血、衄血、尿血、便血,崩漏、产后出血过多、瘀血腹痛、经闭,跌打瘀肿、外伤出血、疮疡肿毒等[2-4].对其化学成分研究表明,珠子参皂苷为其重要的活性成分之一.近年来,先后从珠子参中分离出其皂苷成分,并证实其具有散瘀活血、消肿定痛和清热解毒之功,对急慢性软组织损伤和创伤性炎症具有非常显著的疗效[5].在制成医院制剂应用过程中发现,珠子参皂苷极性较大,虽然在水中溶解性较好,但是由于与皮肤相容性低,如果将其直接制成传统的制剂外用很难较快穿透皮肤,发挥其疗效.基于此,本文旨在制备一种含有珠子参皂苷的脂质体凝胶,以提高珠子参皂苷在皮肤中的滞留量和吸收效果;通过对珠子参皂苷脂质体凝胶的急性毒性、皮刺激性和过敏性实验研究,评价其皮肤用药的安全性.
1 材料与方法
1.1 试验药物
珠子参皂苷的制备方法见文献[5],实验制得珠子参皂苷的淡棕色粉末,经HPLC检测含量为92.65%.
1.2 动物
体质量为2.0~2.5 kg的健康新西兰大白兔40只,雌雄各半,购自三峡大学实验动物中心,合格证号为SCXK(鄂)2011-0012;体质量280~300 g的健康成年豚鼠30只,雌雄各半,购自三峡大学实验动物中心,合格证号为SCXK(鄂)2011-0012.动物饲养环境:温度23℃±3℃,相对湿度55%±15%,光照昼夜交替的房间内,自由饮水和摄食.
1.3 试剂
卵磷脂(日本丘比株式会社,批号:EK10028);胆固醇(上海化学试剂公司,批号:D12260234);卡波姆-940(上海人民制药厂,批号:BJ14417);硫化钠(天力化学试剂公司,批号:20150824);甲醛(天力化学试剂公司,批号:20150916);2,4-二硝基氯苯(上海化学试剂厂,批号:20150719);其他试剂为国产分析纯.
1.4 仪器
XSE104电子分析天平、pH计(梅特勒-托利多国际股份有限公司);超声清洗机(济宁金百特电子有限责任公司);旋转蒸发仪(日本EYELA);恒温箱(南京实验仪器厂);XPE10001L电子秤(梅特勒-托利多国际股份有限公司);5810台式高速离心机(德国eppendorf公司);ZRS-4智能溶出仪(天津大学无线电厂);组织切片机(德国Leica公司);显微图像采集及分析系统(德国Leica公司).
1.5 方法
1.5.1 珠子参皂苷脂质体的制备
称取卵磷脂0.4 g、胆固醇0.4 g和珠子参皂苷2.0 g溶于80 mL氯仿中,缓慢加入磷酸盐缓冲液20 mL,冰浴条件下探头超声6次,每次5 min,得到均匀乳剂,然后转入圆底烧瓶中,用旋转蒸发仪回收氯仿,再加入60 mL磷酸盐缓冲液,置于超声仪中超声45 min,用0.45 μm微孔滤膜过滤,即得.
1.5.2 珠子参皂苷脂质体凝胶的制备
分别取甘油5.0 g、卡波姆-940 4.0 g,加入适量蒸馏水中,待充分溶胀后加入制备好的珠子参皂苷脂质体80 mL,滴加2 mol/L的NaOH溶液适量调节pH在6~7之间,加蒸馏水定容至200 mL,搅拌均匀即得,其珠子参皂苷含量为1.0%.
1.5.3 珠子参皂苷脂质体包封率分析[6]
取脂质体2 mL置于10 mL离心管中,用纯化水定容至6 mL,15 000 rpm/min离心90 min,分离上清液和沉淀物,然后用异丙醇破坏脂质体并定容至10 mL,在310 nm波长处测定它们的吸光度,计算上清液和沉淀物中珠子参皂苷的量,然后计算珠子参皂苷脂质体的包封率[包封率(%)=(沉淀中珠子参皂苷的量)/(上清液中珠子参皂苷的量+沉淀中珠子参皂苷的量)×100%].
1.5.4 珠子参皂苷脂质体凝胶体外释放度测定[7]
将称量好的1.0 g珠子参皂苷脂质体凝胶和珠子参皂苷凝胶分别置入透析袋中,密封好后,浸没在500 mL,pH为6.5的磷酸盐缓冲液透析介质中,在37℃的循环水浴中,转速为50 rpm/min,于0.25、0.5、1.0、2.0、4.0、6.0、8.0、10.0、12.0和24.0 h时间点取样1.0 mL.每次取样后,补加等量磷酸盐缓冲液透析介质.取样液测定吸光度(吸收波长为310 nm),分别计算珠子参皂苷的释放量;用同样的方法测定珠子参皂苷凝胶的释放量.
1.5.5 珠子参皂苷脂质体凝胶初步稳定性实验[8]
1)温度实验.准确称量3批珠子参皂苷脂质体凝胶剂样品27份,分别密封于5.0 mL棕色玻璃瓶中,然后置于20、40、60℃恒温干燥器中保存,分别于第0、5、10天取出,观察其外观,随后依照“1.5.3”的方法测定其包封率.
2)光照实验.准确称量3批珠子参皂苷脂质体凝胶剂样品9份,分别密封于5.0 mL无色玻璃瓶中,然后置于照度为4 000 LX的条件光照,分别于第0、5、10 d取出,观察其外观,随后依照“1.5.3”的方法测定其包封率.
3)湿度影响试验.准确称量3批珠子参皂苷脂质体凝胶剂样品18份,分别密封于5.0 mL无色玻璃瓶中,然后分别置于相对湿度(RH)分别为75%和92.5%,恒温25℃条件下保存,分别于第0、5、10 d取出,观察其外观,随后依照“1.5.3”的方法测定其包封率.
4)pH值测定.准确称量3批珠子参皂苷脂质体凝胶剂样品9份,分别密封于5.0 mL无色玻璃瓶中,然后恒温25℃条件下保存,分别于第0、5、10 d取出,置于烧杯中,加纯化水均匀搅拌后,用pH计测定其pH值.
1.5.6 皮肤急性毒性实验[9-11]
将新西兰大白兔随机分为完整皮肤组和破损皮肤组两大组,完整皮肤组分为:基质对照组、珠子参皂苷脂质体凝胶剂低剂量组(为临床用药药量60倍)、珠子参皂苷脂质体凝胶剂高剂量组(为临床用药药量120倍);破损皮肤组分为:基质对照组、珠子参皂苷脂质体凝胶剂低剂量组(为临床用药药量60倍)、珠子参皂苷脂质体凝胶剂高剂量组(为临床用药药量120倍).每组4只,雌雄各半,共计24只.完整皮肤组先用剃毛剪剪去背部脊柱两侧对称的毛发后,用8%硫化钠溶液脱去未剃净毛发,脱毛面积为160 cm2(相当兔体表面积的10%);破损皮肤组在脱毛后,先用75%酒精消毒,然后用400号的纱布纸将脱毛部位摩擦造成局部擦伤,以渗血为度.给药组将珠子参皂苷脂质体凝胶(6 g或12 g)分别均匀涂抹于正常皮肤和破损皮肤的低、高剂量组,然后用医用灭菌纱布固定,12 h后再涂布1次,实验动物分笼单独饲养;完整皮肤和破损皮肤基质对照组则涂抹不含珠子参皂苷的脂质体凝胶,其余处理方法同给药组.给药24 h后取下包扎纱布,用消毒棉签擦去皮肤上的凝胶,然后用灭菌温水清洗皮肤.每天观察和记录兔的一般状况,具体包括体质量、涂药皮肤红肿程度、毛发、眼睛及活动情况.若遇兔死亡,则及时尸检和进行肉眼观察,并进行病理形态学分析.给药后的第8 d,分别取涂药部位的皮肤,用4%多聚甲醛固定后,包埋切片,经HE染色后进行皮肤组织形态学分析.
1.5.7 皮肤刺激性实验
1)单次给药皮肤刺激性实验.选取8只雌雄各半的健康新西兰大白兔,按体质量随机分为基质对照组和珠子参皂苷脂质体凝胶剂组,每组4只.实验前,两组兔剃毛方法同1.5.6所述(左侧皮肤脱毛后,先用75%酒精消毒).剃毛后的次日,两组兔的左右两侧的破损和正常皮肤分别涂抹不含珠子参皂苷的脂质体凝胶和含珠子参皂苷的脂质体凝胶(为临床用药药量120倍),然后用医用灭菌纱布固定,6 h后,用灭菌温水清洗皮肤分别于停药后1、24、48和72 h肉眼观察涂抹部位的红斑、水肿等情况,并按文献介绍的方法[9-12]进行皮肤刺激反应评分和刺激强度评价.
2)多次给药皮肤刺激性实验.选取8只雌雄各半的健康新西兰大白兔,分组及制作破损皮肤方法同“单次给药皮肤刺激性实验”,剃毛后的次日,两组兔的左右两侧的破损和正常皮肤分别涂抹不含珠子参皂苷的脂质体凝胶和含珠子参皂苷的脂质体凝胶(为临床用药药量120倍),然后用医用灭菌纱布固定,每天1次,连续用药7 d,末次给药24 h后,用灭菌温水清洗皮肤分别于停药后1、24、48、72 h肉眼观察涂抹部位的红斑、水肿等情况,并按文献介绍的方法[9-12]进行皮肤刺激反应评分和刺激强度评价.
1.5.8 皮肤过敏性实验
选取健康的成年豚鼠30只,体质量为280~300 g,雌雄各半,按体质量和性别完全随机分为不含珠子参皂苷的脂质体凝胶对照组、珠子参皂苷的脂质体凝胶组和2,4-二硝基氯苯组.实验前剃毛剪剪背部脊柱两侧对称的毛发后,用8%硫化钠溶液脱去未剃净毛发,脱毛面积为9 cm2,剔除因剃毛引起皮肤受损的豚鼠.①致敏接触:剃毛24 h后3组实验豚鼠分别涂抹相应的药物,脂质体凝胶组和珠子参皂苷的脂质体凝胶组涂抹的量为0.2 g/只,2,4-二硝基氯苯组为1% 2,4-二硝基氯苯0.2 mL/只,然后依次用油纸和纱布覆盖,无刺激胶布固定,处理完后的豚鼠分笼单独饲养,6h后用灭菌温水洗皮肤上涂抹的药物.第7 d和第14 d用同样的方法分别重复1次.②激发接触:于末次致敏接触后14 d,3组实验豚鼠的左侧剃毛皮肤分别涂抹0.1% 2,4-二硝基氯苯0.2 mL/只,6 h后用灭菌温水洗去2,4-二硝基氯苯,观察洗后0、24、48、72 h皮肤的过敏反应情况,计算豚鼠过敏反应平均分值和过敏反应发生率[过敏反应平均分值(分)=(红斑形成总分+水肿形成总分)/动物例数;过敏反应发生率:过敏反应发生率(%)=出现红斑和水肿的动物例数/受试动物总数×100%][9-12].
1.6 数据统计分析
2 结 果
2.1 珠子参皂苷脂质体包封率
通过检测珠子参皂苷脂质体的平均包封率为:75.8±2.5,符合脂质体制剂的要求(见表1).
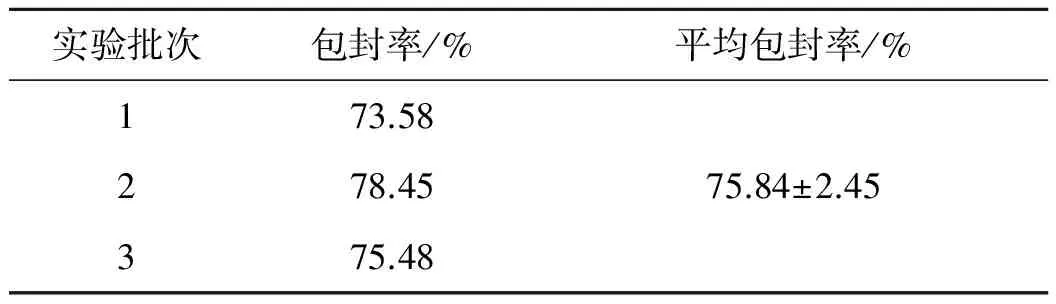
表1 珠子参皂苷脂质体包封率
2.2 珠子参皂苷脂质体凝胶体外释放度评价
将表2数据进行拟合,其渗透动力学复合Higuchi方程,珠子参皂苷凝胶的渗透方程为y=205.29x1/2+72.54(r=0.981 3),渗透速率为205.29 μg/mL·h1/2;珠子参脂质体凝胶的渗透方程为y=1347.00x1/2+43.95(r=0.997 8),渗透速率为1 347.00 μg/mL·h1/2.通过以上分析:珠子参脂质体凝胶在单位时间内的释药量和24 h总释药量均明显高于珠子参凝胶.实验结果表明珠子参皂苷脂质体凝胶的透皮吸收效果优于其凝胶剂.
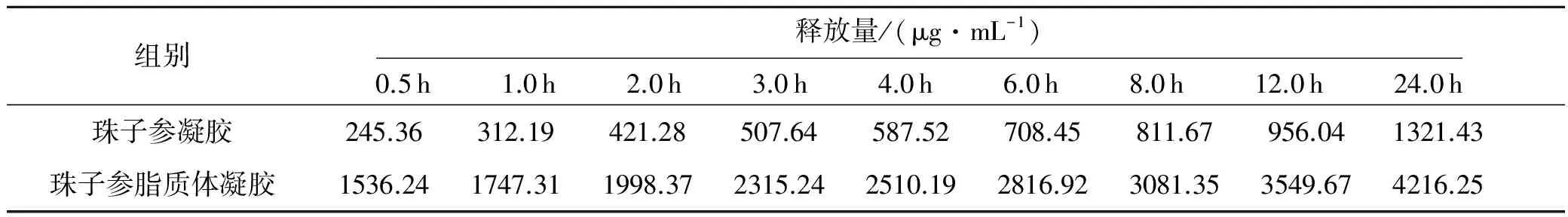
表2 珠子参皂苷凝胶和脂质体凝胶体外释放量比较
2.3 珠子参皂苷脂质体凝胶初步稳定性分析
由表3温度试验结果可知,珠子参皂苷脂质体凝胶在20、40℃时其淡黄色外观性状没有变化,包封率和pH值变化较小;而在60℃时珠子参皂苷脂质体凝胶剂在5 d时颜色加深,并随着时间的延长进一步加深和变得浑浊,其包封率降低出现较明显下降.
表3 珠子参皂苷脂质体凝胶初步稳定性检测
通过光照试验结果发现:珠子参皂苷脂质体凝胶在光照条件下,其淡黄色外观性状出现明显加深,而且随着时间的延长进一步加深和变得浑浊.湿度影响试验结果表明,该因素对其影响不大.通过次研究,说明该制剂贮存时应室温和避光保存.
2.4 珠子参皂苷脂质体凝胶对兔皮肤急性毒性的影响
2.4.1 一般状况观察
由表4可知,无论脂质体凝胶中是否含有珠子参皂苷对兔完整皮肤和破损皮肤,豚鼠的皮毛光泽度、进食情况、大小便、活动情况及精神状况等均未见明显的不良影响.通过比较涂药前后及涂药后3 d、7 d的体质量变化,发现脂质体凝胶对照组与对应的珠子参皂苷脂质体凝胶剂组体质量差异无统计学意义(P<0.05).实验期间未见兔出现急性毒性反应和兔死亡现象.

表4 珠子参皂苷脂质体凝胶剂对兔体质量和皮肤的影响
与脂质体凝胶对照组比较,*P<0.05,**P<0.01(下同)
2.4.2 珠子参皂苷脂质体凝胶对兔皮肤形态学的影响
通过肉眼观察发现珠子参皂苷脂质体凝胶对兔完整皮肤无皮肤红、肿、渗液等不良情况出现,兔的破损皮肤在涂抹珠子参皂苷脂质体凝胶后渗出物减少,随后开始结痂,4 d后痂脱落;脂质体凝胶对照组兔完整皮肤未见异常,破损皮肤在涂抹脂质体凝胶后前3天未见明显变化,从第4天开始慢慢结痂(见表4).
研究证实:珠子参皂苷脂质体凝胶对兔正常皮肤无副作用,对兔破损皮肤能迅速促进皮肤伤口愈合.显微镜观察发现:脂质体凝胶对照组兔的完整皮肤复层上皮细胞完整,毛囊组织和皮下组织结构正常;破损皮肤表皮虽可见新生修复组织,但仍然可见机械性损伤旧痕;复层上皮、毛囊组织和皮下组织形态结构正常.珠子参皂苷脂质体凝胶低、高剂量组的兔完整皮肤复层上皮细胞、毛囊组织结构完整,皮下组织中无白细胞浸润、组织充血和坏死等情况出现;破损皮肤表皮虽可见新生修复组织,但仍然可见机械性损伤旧痕;复层上皮、毛囊组织和皮下组织形态结构正常.皮下组织中无白细胞浸润、组织充血和坏死等情况出现(如图1所示).
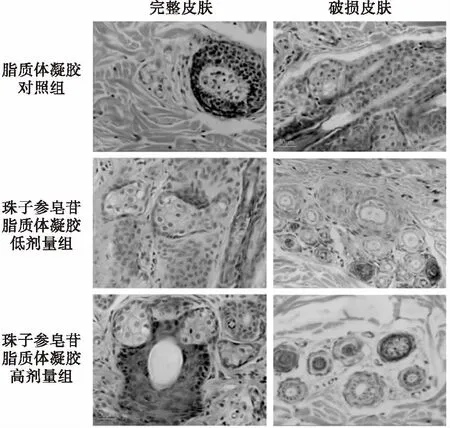
图1 珠子参皂苷脂质体凝胶对兔皮肤组织形态学的影响(HE染色)
2.5 珠子参皂苷脂质体凝胶对兔皮肤刺激性的影响
2.5.1 兔皮肤单次涂药对其刺激性影响
由表5可见,兔完整皮肤和破损皮肤单次涂抹脂质体凝胶和珠子参皂苷脂质体凝胶均未出现红斑、水肿等不良反应.实验结果表明,珠子参皂苷脂质体凝胶无明显的皮肤刺激性.
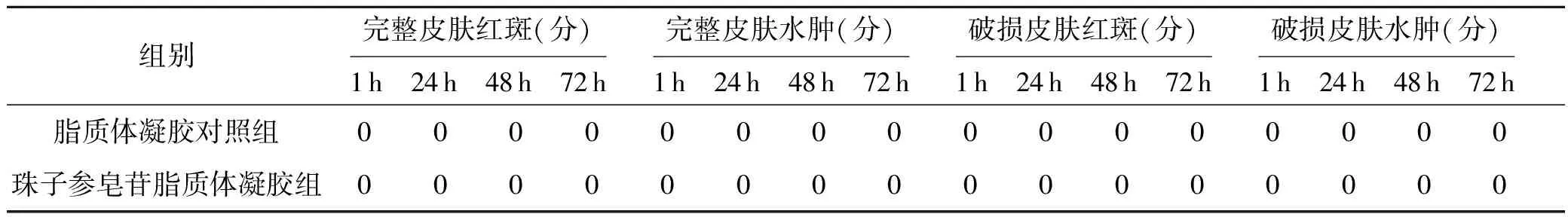
表5 珠子参皂苷脂质体凝胶单次给药对兔皮肤刺激性的影响(n=4)
2.5.2 兔皮肤多次涂药对其刺激性影响
由表6可见,兔完整皮肤和破损皮肤多次涂抹脂质体凝胶和珠子参皂苷脂质体凝胶均未现红斑和水肿.7 d后两组实验动物伤口均脱痂愈合,皮肤恢复正常.实验结果表明,珠子参皂苷脂质体凝胶无明显的皮肤刺激性.

表6 珠子参皂苷脂质体凝胶多次给药对兔皮肤刺激性的影响(n=4)
2.6 珠子参皂苷脂质体凝胶对豚鼠皮肤过敏性的影响
由表7可知,2,4-二硝基氯苯组豚鼠剃毛后的完整皮肤和破损皮肤在涂抹2,4-二硝基氯苯0 h有7只出现了非常明显的红斑和/或水肿,有3只出现哮喘、2只出现站立不稳的情况;在24 h后9只出现了非常明显的红斑和/或水肿,有5只出现哮喘、3只出现站立不稳的情况;48 h后10只均出现了非常明显的红斑和/或水肿,有4只出现哮喘、2只出现站立不稳的情况,72 h后仍有7只的红斑和/或水肿未消退,有2只出现哮喘、1只出现站立不稳的情况.脂质体凝胶对照组和珠子参皂苷脂质体凝胶组豚鼠剃毛后的完整皮肤和破损皮肤在涂药后均未见红斑、水肿现象,也无哮喘、站立不稳或休克等全身过敏现象.

表7 珠子参皂苷脂质体凝胶对豚鼠皮肤过敏性的影响(n=10)
3 讨 论
珠子参皂苷为珠子参的重要活性成分,具有散瘀活血、消肿定痛和清热解毒之功,对急慢性软组织损伤和创伤性炎症具有非常显著的疗效.在将其制成传统的软膏剂、凝胶剂、乳剂等医院制剂的过程中发现其存在吸收不稳定、局部药物的生物利用度低等缺点,极大地限制了它的临床使用.作为新型胶体给药系统的脂质体,由于其成分和构成人体的细胞膜相似,使得其与人体具有良好的生物相容性,有助于药物迅速穿透皮肤,聚集在作用部位,形成药物储库而维持较为恒定的有效血药浓度,在将其制成的医院制剂的应用过程中证实了这一点.然而在将珠子参皂苷制成医院制剂应用过程中发现,它虽然在水中溶解性较好,但是由于与皮肤相容性低.在将其制成传统的软膏剂、霜剂、凝胶剂应用时,发现其吸收不稳定、局部药物的生物利用度低.基于此,采用超声-薄膜分散法制备珠子参皂苷脂质体,以卡波姆-940为基质制备脂质体凝胶,实验结果显示制成的珠子参皂苷脂质体凝胶渗透速率显著高于珠子参皂苷凝胶的渗透速率;初步稳定性试验表明光和热对脂质体凝胶的稳定性影响较大,在60℃高温和光照条件下,珠子参皂苷脂质体凝胶的外观形状和包封率明显下降.因此,珠子参皂苷脂质体凝胶应低温和避光保存;由于珠子参皂苷脂质体凝胶本身为含水制剂,故湿度对稳定性影响不明显.
在实验中,为了保证其临床应用的安全,进行了珠子参皂苷脂质体凝胶剂的皮肤毒性试验(急性皮肤毒性、皮肤刺激性和过敏性试验).研究表明珠子参皂苷脂质体凝胶在涂抹临床药量120倍的剂量时对兔完整和破损皮肤均未见明显的不良反应,在临床药量60倍的剂量时对兔完整和破损皮肤均未产生刺激作用,对实验豚鼠完整和破损的皮肤也未产生过敏反应.实验结果表明珠子参皂苷脂质体凝胶经皮给药治疗急慢性软组织损伤和创伤性炎症是安全的.本研究为珠子参皂苷脂质体凝胶的开发提供了依据,为扩大其临床应用提供了新思路.
[1] 王 鹏,杨秀丽,杨 波,等.紫杉醇脂质体凝胶剂的制备及其镇痛抗炎作用[J].中国现代应用药学,2015,32(3):281-285.
[2] 中华人民共和国药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:271-272.
[3] Zou K, Liu Z X, Zhu S, et al. Research of ginsenosides in kou zi qi using HPLC-MS-MS[J]. Yao Xue Xue Bao, 2004, 39 (5): 385-388.
[4] Chan H H, Sun H D, Reddy M V B, et al. Potent α-glucosidase inhibitors from the roots of Panax japonicus C. A. Meyer var. major[J]. Phytochemistry, 2010, 71(11-12):1360-1364.
[5] Zhang J H, Shi M Q, He H B, et al. Hepatoprotective effects of saponins from Rhizoma Panacis Majoris on hepatic fibrosis induced by carbon tetrachloride in rats[J]. Applied Mechanics and Materials Vols, 2014, 568-570:1915-1920.
[6] 王学清,齐宪荣,刘明辉.盐酸丁卡因脂质体凝胶剂的制备与释放度的测定[J].中国现代应用药学杂志,2003,20(1):37-40.
[7] 张爱军,封 新,马小亚,等.辣椒素脂质体凝胶剂的制备与释放度的测定[J].西北药学杂志,2011,26(4):279-280.
[8] 冯淑华,林 强,周 晶,等.白鲜皮脂质体凝胶剂的研制与质量评价[J].中成药,2007,29(12):1774-1777.
[9] 中华人民共和国卫生部药政局.中药新药研究指南(药学、药理学、毒理学)[M].北京:人民卫生出版社,1994:209-212,206-210.
[10] 中华人民共和国卫生部药政局.新药(西药)临床前研究指导原则汇编(药学、药理学、毒理学)[M].北京:人民卫生出版社,1993:204-208.
[11] 杨 进,罗友成,邹 坤,等.苎麻叶凝胶急性毒性、皮肤刺激性及过敏性实验研究[J].国际沙棘研究与开发,2012,10(2):42-47.
[12] 陈 奇.中药药理研究方法学[M].北京:人民卫生出版社,2006:159-161.
