微小RNA-1180转染对肾癌细胞生长的影响
2018-03-15郭永连李国灏余家俊
王 勇,郭永连,陈 琳,李国灏,余家俊,程 薇
(1.华中科技大学同济医学院附属武汉市中心医院泌尿外科,武汉 430014;2.华中科技大学同济医学院附属梨园医院,武汉 430077 )
肾细胞癌简称肾癌,2015年美国癌症协会的调查显示,肾癌新发病例61 560例,死亡病例14 080例[1]。肾癌对化疗和放疗均不敏感,首选治疗方案依然是手术切除。然而仍有很多肾癌患者的预后并不理想[2],寻找一种有效的靶基因治疗一直是肾癌研究的热点。肿瘤细胞周期调控的异常导致其增殖能力增强,与肿瘤的发生、发展密切相关。p2l是目前已知的具有最广泛细胞周期依赖性激酶抑制活性的蛋白,广泛参与细胞增殖、分化、衰老、凋亡等多种细胞功能的变化[3]。研究表明肾癌组织中p21蛋白的表达明显下调,且p21蛋白表达水平与患者的预后密切相关[4]。微小RNA(miR-1180)是新近发现的具有激活p21蛋白表达的小分子非编码RNA[5]。本研究旨在研究miR-1180能否激活肾癌细胞中p21基因的表达,并观察其对肾癌细胞生长的抑制作用。
1 材料与方法
1.1材料 胎牛血清、DMEM和RPMI1640培养基购于美国Gibco公司;人肾癌细胞系786-O和ACHN购于中国科学院生物化学与细胞生物学研究所;Lipofectamine 2000、SuperScript reverse transcriptase和超敏增强化学发光法(ECL)试剂盒购于美国Invitrogen公司; dsControl[6](一组已知的缺少人类基因重要同源性的dsRNA,反义链:5′-UCU ACU GUC ACU CAG UAG U-3′)和miR-1180 mimics(5′-GGA CCC ACC CGG CCG GGA AUA-3′)购于广州锐博生物科技有限公司,miR-1180与p21基因启动子序列特异性结合(图1); StepOne PlusTM Real-Time PCR System购于美国ABI公司;荧光定量PCR试剂盒购于日本TaKaRa公司;PCR引物由上海生工生物工程有限公司合成;一抗β-actin、p21、CDK4、CDK6和CyclinD1购于美国Cell Signaling Technology公司;辣根过氧化物酶(HRP)标记的羊抗兔/鼠二抗购于美国Affinity公司。BCA protein assay kit购于美国Pierce公司;MTS试剂盒购于美国Sigma公司。

图1 miR-1180序列及其特异性结合的人p21基因启动子转录起始点上游序列
1.2方法
1.2.1细胞培养和转染 在37 ℃、5% CO2饱和湿度培养箱中使用含10%胎牛血清的DMEM培养基培养人肾癌细胞系ACHN,使用含10%胎牛血清的RPMI 1640培养786-O。转染前12 h取对数生长期的肾癌细胞接种于新的6孔细胞培养板,待肾癌细胞融合度为40%~60%进行转染,使用Lipofectamine 2000作为转染试剂。6 h后观察细胞状态并更换培养基。
1.2.3总RNA的提取和qRT-PCR检测p21 mRNA的表达 转染后72 h收集细胞,提取总RNA。使用SuperScript reverse transcriptasex反转录RNA为cDNA。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,合成的cDNA使用荧光定量(qRt)PCR试剂盒及相应引物通过PCR仪进行扩增检测,结果采用2-ΔΔCt方法分析。GAPDH引物序列:上游 5′-TCC CAT CAC CAT CTT CCA-3′,下游5′-CAT CAC GCC ACA GTT TCC-3′。p2l引物:上游5′ -GCC CAG TGG ACA GCG AGC AG-3′;下游5′ -GCC GGC GTT TGG AGT GGT AGA-3′ 。
1.2.4总蛋白的提取和Western blot分析 转染72 h后收集肾癌细胞用于p21蛋白表达的分析。用PBS洗3次,加入含蛋白酶抑制剂的细胞裂解液,4 ℃裂解30 min,高速离心20 min,提取总蛋白。使用BCA protein assay kit进行蛋白浓度测定。将每个样本提取的蛋白上样30 μg蛋白至SDS-PAGE胶进行电泳, 使用NC膜转膜后用含5%牛血清清蛋白的TBST溶液室温封闭1 h后,分别与一抗β-actin(1∶2 000稀释)、p21(1∶1 000稀释)、CDK4(1∶3 000稀释)、CDK6(1∶2 000稀释)和CyclinD1(1∶1 000稀释)在4 ℃下孵育过夜。 24 h后使用羊抗兔/鼠二抗(1∶3 000稀释)室温下孵育1 h,ECL试剂曝光显影,观察免疫反应的条带。
1.2.5流式细胞术分析细胞周期分布 转染72 h后消化收集细胞,PBS溶液洗2次;70%乙醇固定,置4 ℃冰箱过夜;24 h后PBS溶液洗2次;使用100 μLRNAse在 37 ℃水浴箱孵育;30 min后加入100 μL PI 混匀,置于4 ℃冰箱避光孵育30 min;使用流式细胞仪分析记录激发波长在488 nm处的红色荧光。
1.2.6多靶扫描法(MTS)细胞分析转染后肾癌细胞活力 每组设4个复孔,每孔内接种3 000个细胞,在96孔板边缘每孔内加入200 μL PBS溶液减少蒸发,转染后于第1、2、3、4、5天分别利用MTS试剂盒分析细胞活力。在每个时间点,从培养箱内取出待检测的96孔细胞培养板,弃上清液;避光加入约110 μL MTS稀释液(100 μL 细胞培养基和10 μL MTS试剂混匀),放回37 ℃、5% CO2饱和湿度培养箱孵育1~2 h;分析前清除气泡,酶标仪分析每孔在490 nm波长的吸光度(A)值,存储数据。检测完毕后将96孔细胞培养板放回培养箱。
1.2.7集落培养实验分析转染后细胞增殖能力 转染后24 h,胰酶消化收集细胞,按1 000个/孔接种于6孔细胞培养板,持续培养10余天;弃上清液,PBS溶液洗2次;加入1 mL甲醇固定15~20 min;弃去甲醇,使用0.1%结晶紫溶液固定约30 min;流水缓慢洗去残余结晶紫染液,室温晾干、拍照、存储。

2 结 果
2.1qRT-PCR检测转染后细胞p21 mRNA的表达 转染miR-1180后,786-O和ACHN细胞中p21 mRNA的表达较dsControl组分别上调2.54倍(P<0.01)和2.49倍(P<0.01)(图2)。
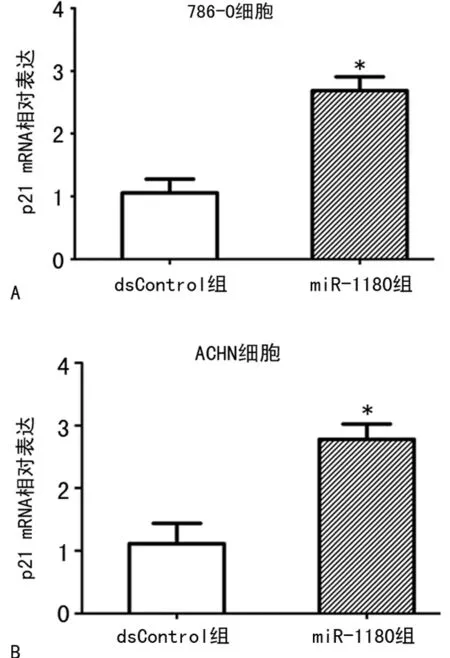
A:786-O细胞;B:ACHN细胞;*:P<0.01,与dsControl组比较
图2 qRT-PCR分析检测p21 mRNA相对表达量
2.2Westen blot检测 Western blot结果显示,miR-1180组较dsControl组p21蛋白表达明显升高,CDK4、CDK6和CyclinD1蛋白显著下调(图3)。
2.3流式细胞仪分析转染后肾癌细胞周期分布 相比dsControl组,转染miR-1180后786-O和ACHN细胞G0/G1期细胞比例显著增加,S期和G2/M期细胞比例显著减少,提示细胞周期被阻滞在G0/G1期(图5)。

图3 Western blot图

A:786-O细胞;B:ACHN细胞;*:P<0.05,**P<0.01,与dsControl组比较
图4 Western blot检测蛋白相对表达量

A:786-O细胞;B:ACHN细胞;*:P<0.05,**:P<0.01,与dsControl组比较
图5流式细胞术检测细胞周期
A:786-O细胞;B:ACHN细胞;*P<0.05,**P<0.01,与dsControl组比较
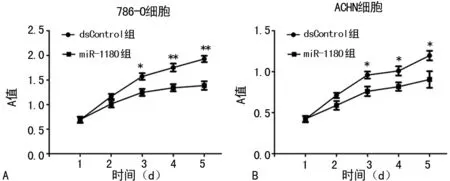
图6 MTS实验检测转染后肾癌细胞活力

A:786-O细胞;B:ACHN细胞;*:P<0.05,**:P<0.01,与dsControl组比较
图7细胞集落培养实验检测细胞增殖能力
2.4MTS法检测肾癌细胞活力 相比dsControl组,转染miR-1180后肾癌细胞活力明显下降(P<0.05)。见图6。
2.5集落培养实验检测转染后肾癌细胞增殖能力 相比dsControl组,miR-1180组形成的集落数显著减少(P<0.05)。见图7。
3 讨 论
miRNAs是一类长度约为22个核苷酸的非编码单链小分子RNA,广泛参与细胞生长、分化、衰老和凋亡等多种细胞功能的改变,研究发现miRNA在多种肿瘤组织内存在异常表达,提示miRNA与肿瘤的发生、发展密切相关[7-8]。以往研究认为,miRNA在转录后水平通过与靶基因mRNA的3′端非编区相结合,特异性地抑制mRNA的翻译或者直接导致其降解,从而抑制相应基因的表达[9]。近年研究发现,miRNA亦能在转录水平通过作用于基因的启动子,从而显著上调基因的表达,这种现象称为RNA激活现象,具有RNA激活作用的小分子RNA称为小激活RNA(saRNA)[4,10]。近年来RNA激活现象在肾癌中的研究较少,因而通过激活抑癌基因表达干扰肾癌细胞的生长成为研究的重点。
p2l蛋白广泛参与多种细胞功能的调节,如细胞增殖、分化、凋亡等,具有最广泛细胞周期蛋白依赖性激酶抑制活性,可通过抑制肿瘤细胞周期的进展抑制肿瘤细胞的生长[3]。细胞周期蛋白依赖激酶(CDK)和细胞周期蛋白(Cyclin)是调控细胞周期进展的核心蛋白。CDK4和CDK6可分别与Cyclin D1结合形成Cyclin D1-CDK4和Cyclin D1-CDK6复合物,作用于细胞周期的G1/S期,导致细胞从G1期进入S期,促进细胞周期的进展[11-12]。细胞周期蛋白依赖性激酶p21可以抑制Cyclin D-CDK复合物的形成或活性,从而抑制细胞进入DNA合成期即S期,引起细胞周期的停滞[13]。miR-1180是新近发现的一种可明显激活p21蛋白表达的小分子RNA[5],但未在肾癌细胞中进行过验证。本实验中,通过转染miR-1180至肾癌细胞系,发现肾癌细胞中p21 mRNA和相应蛋白的水平均明显升高,提示miR-1180具有激活肾癌细胞p21基因表达作用;肾癌细胞的细胞周期受到明显地抑制,肾癌细胞的活力和增殖能力明显降低,表明miR-1180可以显著抑制肾癌细胞的生长[14]。有研究表明,saRNA的激活作用与saRNA的浓度密切相关[15]。本实验的不足之处在于未能证明miR-1180在肾癌细胞中的激活效应与miR-1180转染浓度之间的关系。笔者下一步将通过设置不同miR-1180转染浓度,验证不同浓度下RNA激活效应的不同,从而找出最佳的miR-1180转染浓度。另外,通过动物实验进一步验证miR-1180在体内的p21基因激活效应。
综上所述,miR-1180可明显激活肾癌细胞中抑癌蛋白p21的表达,并显著抑制肾癌细胞的生长,有望作为新的肾癌靶基因治疗位点。
[1]SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2]ESCUDIER B,PORTA C,SCHMIDINGER M,et al.Renal cell carcinoma:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2014,25(Suppl 3):i49-i56.
[3]WARFEL N A,EL-DEIRY W S.p21WAF1 and tumourigenesis:20 years after[J].Curr Opin Oncol,2013,25(1):52-58.
[4]WANG C,TANG K,LI Z,et al.Targeted p21(WAF1/CIP1) activation by miR-1236 inhibits cell proliferation and correlates with favorable survival in renal cell carcinoma[J].Urol Oncol,2016,34(2):23-59.
[5]WANG C,CHEN Z,GE Q,et al.Up-regulation of p21(WAF1/CIP1) by miRNAs and its implications in bladder cancer cells[J].FEBS Lett,2014,588(24):4654-4664.
[6]MIYAZAKI M,SAKAGUCHI M,AKIYAMA I,et al.Involvement of interferon regulatory factor 1 and S100C/A11 in growth inhibition by transforming growth factor beta 1 in human hepatocellular carcinoma cells[J].Cancer Res,2004,64(12):4155-4161.
[7]HE X X,CHANG Y,MENG F Y,et al.MicroRNA-375 targets AEG-1 in hepatocellular carcinoma and suppresses liver cancer cell growth in vitro and in vivo[J].Oncogene,2012,31(28):3357-3369.
[8]PIZZINI S,BISOGNIN A,MANDRUZZATO S,et al.Impact of microRNAs on regulatory networks and pathways in human colorectal carcinogenesis and development of metastasis[J].BMC Genomics,2013,14(1):589.
[9]Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[10]PLACE R F,LI L C,POOKOT D,et al.MicroRNA-373 induces expression of genes with complementary promoter sequences[J].Proc Natl Acad Sci U S A,2008,105(5):1608-1613.
[11]SPRING L,BARDIA A,MODI S.Targeting the cyclin D-cyclin-dependent kinase (CDK) 4/6-retinoblastoma pathway with selective CDK 4/6 inhibitors in hormone receptor-positive breast cancer:rationale,current status,and future directions[J].Discov Med,2016,21(113):65-74.
[12]THE I,RUIJTENBERG S,BOUCHET B P,et al.Rb and FZR1/Cdh1 determine CDK4/6-cyclin D requirement in C.elegans and human cancer cells[J].Nat Commun,2015,6:5906.
[13]ZHANG Q,SHIM K,WRIGHT K,et al.Atypical role of sprouty in p21 dependent inhibition of cell proliferation in colorectal cancer[J].Mol Carcinog,2016,55(9):1355-1368.
[14]WARFEL N A,EL-DEIRY W S.p21WAF1 and tumourigenesis:20 years after[J].Curr Opin Oncol,2013,25(1):52-58.
[15]WANG X,WANG J,HUANG V,et al.Induction of NANOG expression by targeting promoter sequence with small activating RNA antagonizes retinoic acid-induced differentiation[J].Biochem J,2012,443(3):821-828.
