血清FOLR1蛋白检测对上皮性卵巢癌的诊断效能
2018-03-15鱼志琪李红雨刘端臧星卉孙玮李玉光
鱼志琪,李红雨,刘端,臧星卉,孙玮,李玉光
(郑州大学第三附属医院,郑州 450052)
卵巢癌的高死亡率与早期诊断困难有关[1~3],早期卵巢癌无明显自觉症状,并且缺乏有效的早期诊断手段[4,5],故发现时多已为晚期。寻找有价值的早期诊断卵巢癌的血液或组织生物标志物一直是临床研究的热点,但至今尚无突破。叶酸受体1(FOLR1)蛋白是一个糖基化磷脂酰肌醇(GPI)偶联的糖蛋白,由FOLR1基因编码,分子量为38~40 kD,对叶酸及其衍生物具有高度亲和力[6]。研究显示在特定上皮来源的恶性肿瘤中FOLR1呈高表达,但在正常组织中FOLR1的表达很低[6, 7]。并且FOLR1可以从细胞表面脱落至血液中[8, 9]。血清FOLR1水平可能在卵巢癌中的诊断、病情判断、治疗效果监测和预后评估方面有临床价值[10~12],但相应研究缺乏。本研究观察了上皮性卵巢癌患者血清FOLR1水平变化,探讨其与患者临床病理参数的关系,将其作为诊断标志物诊断上皮性卵巢癌的效果与CA125进行了比较。现报告如下。
1 资料与方法
1.1 临床资料 选择2014年10月~2017年3月收治的怀疑卵巢恶性肿瘤的104例患者,均无其他肿瘤病史,术前均未接受放、化疗。所有患者均接受手术治疗,留取术中切除的组织并送病理检查。根据术后病理结果分为上皮性卵巢癌组44例、交界性卵巢肿瘤组22例和良性卵巢肿瘤组38例。上皮性卵巢癌组FIGO分期Ⅰ~Ⅱ期18例、Ⅲ~Ⅳ期26例,组织分化程度高分化23例、中分化9例、低分化12例,病理类型为浆液性囊腺癌36例、黏液性囊腺癌4例、透明细胞癌4例,有淋巴结转移17例、无淋巴结转移27例,腹水细胞学检查结果阳性22例、阴性22例。交界性卵巢肿瘤组浆液性囊腺瘤16例,黏液性囊腺瘤6例。良性卵巢肿瘤组浆液性囊腺瘤7例,黏液性囊腺瘤20例,卵巢子宫内膜异位囊肿5例,卵巢成熟型囊性畸胎瘤6例。
1.2 血清FOLR1蛋白检测 留取所有患者术前晨起空腹静脉血5 mL,室温静置30 min,4 ℃下2 000 g离心20 min,取上清分装至EP管中,-80 ℃冻存。采用ELISA法检测血清FOLR1蛋白,试剂盒购自武汉博士德生物有限公司,严格按说明书操作。于450 nm波长处测量吸光度值(OD450),根据标准曲线计算血清FOLR1蛋白水平。
1.3 血清CA125检测 采用微粒子化学发光法检测血清CA125水平,试剂盒购自SIEMENS公司,使用SIEMENS ADVIA CentaurXP全自动化学发光免疫分析仪测量。
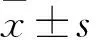
2 结果
2.1 3组患者血清FOLR1、CA125水平比较 3组患者血清FOLR1、CA125水平见表1。上皮性卵巢癌组患者血清FOLR1、CA125水平均高于交界性卵巢肿瘤组、良性卵巢肿瘤组(P均<0.05),交界性卵巢肿瘤组患者血清FOLR1、CA125水平与良性卵巢肿瘤组相比(P>0.05)。

表1 3组血清FOLR1、CA125水平比较
注:与交界性卵巢肿瘤组相比,*P<0.05;与良性卵巢肿瘤组相比,#P<0.05。
2.2 上皮性卵巢癌组血清FOLR1水平与患者临床病理参数的关系 上皮性卵巢癌组FIGO分期Ⅰ~Ⅱ期、Ⅲ~Ⅳ期者血清FOLR1水平分别为(278.94±372.59)、(725.10±629.62) pg/mL,二者血清FOLR1水平相比,P<0.05;组织分化程度高、中、低分化者血清FOLR1水平分别为(211.26±129.10)、(525.32±511.02)、(1190.56±630.00) pg/mL,三者血清FOLR1水平相比,P<0.05;病理类型为浆液性囊腺癌、非浆液性囊腺癌者血清FOLR1水平分别为(755.11±582.86)、(211.20±115.04) pg/mL,二者血清FOLR1水平相比,P<0.05;有、无淋巴结转移者血清FOLR1水平分别为(973.63±696.26 )pg/mL、(271.18±238.89 )pg/mL,二者血清FOLR1水平相比,P<0.05;腹水细胞学检查结果阳性、阴性者血清FOLR1水平分别为(879.36±659.16) pg/mL、(206.80±120.03 )pg/mL,二者血清FOLR1水平相比,P<0.05。
2.3 血清FOLR1、CA 125水平诊断上皮性卵巢癌的效能比较 血清FOLR1诊断上皮性卵巢癌的ROC曲线下面积为0.81(95 %CI:0.72~0.88),截断值为215 pg/mL,以截断值为界诊断上皮性卵巢癌的灵敏度为61.4%、特异度为98.0%、约登指数0.51、阳性预测值为81.8%、阴性预测值为76.1%,诊断准确度77.9%;血清CA125诊断上皮性卵巢癌的ROC曲线下面积为0.72(95 %CI:0.72~0.88),截断值为73 U/mL,以截断值为界诊断上皮性卵巢癌的灵敏度为59.1%、特异度为80.0%、约登指数0.39、阳性预测值为66.7%、阴性预测值为72.3%,诊断准确度70.2%。
3 讨论
FOLR1是一种膜蛋白,与GPI偶联于细胞膜上,通过内吞过程介导叶酸进入细胞内,对叶酸及其衍生物具有高度亲和力。叶酸对细胞的增殖、分裂和组织生长具有重要调节作用[14, 15]。叶酸缺乏对肿瘤细胞中DNA复制、修复以及基因表达有重大影响。肿瘤细胞的快速生长需要足量的叶酸,有一种假说认为FOLR1在实性恶性肿瘤中的上调是由于叶酸的代谢需求增加,为了给核酸合成和细胞生长提供燃料[16]。已有研究表明FOLR1在不同类型的癌症中表达增加,包括卵巢、子宫内膜、肺、乳腺癌、高级别骨肉瘤和胸膜间皮瘤[6, 7]。O′Shannessy等[16]报道血清FOLR1是区分浆液性卵巢癌和正常对照的一个有潜力的生物标志物,这与本研究结果一致。
CA125是最广泛使用的卵巢癌血清肿瘤标志物,FDA批准其用于监测化疗效果和对盆腔包块患者的鉴别诊断。但血清CA125水平升高常与其他病理情况有关,如子宫内膜异位症、子宫腺肌症、子宫肌瘤、盆腔炎性疾病、卵巢良性肿瘤等,且在早期卵巢癌患者中仅有一半血清CA125升高。因此,CA125对早期卵巢癌敏感性较差,对卵巢癌总体特异性较差。由于这些原因,CA125既没有作为卵巢癌的筛查的生物标志物,也没有作为早期诊断卵巢癌的生物标志物。
本研究观察到上皮性卵巢癌组患者血清FOLR1高,而交界性和良性卵巢肿瘤患者血清FOLR1呈低水平,血清FOLR1水平在早期上皮性卵巢癌患者中即升高,且随FIGO分期逐步升高,提示FOLR1在上皮性卵巢癌发生发展过程中起重要作用,有可能成为上皮性卵巢癌早期诊断的一个血清标志物。进一步进行ROC分析,结果显示血清FOLR1、CA125水平诊断上皮性卵巢癌的曲线下面积分别为0.81、0.72,取截断值时的约登指数分别为0.51、0.39,在诊断上皮性卵巢癌方面,与CA125相比,采用血清FOLR1水平有更高的特异度、阳性预测价值和诊断准确度,而没有牺牲其敏感度,提示血清FOLR1的检测有助于卵巢癌的诊断,可能是一个潜在的卵巢癌血清标志物。Kurosaki 等[17]的报道显示血清FOLR1从盆腔肿块患者中区分上皮性卵巢癌患者的检验效能优于CA125,与本研究结果一致。目前,一些FOLR1靶向治疗药物正在进行临床试验,这可能对化疗疗效监测有用。由于没有对上皮性卵巢癌组患者随访到足够长的时间,因此我们没有对血清FOLR1的预后价值进行分析,这将在后续的研究中探讨。
综上所述,笔者推测,对于上皮性卵巢癌,血清FOLR1可能是一个高度特异性的诊断标志物,并且有望成为上皮性卵巢癌诊断、靶向治疗及化疗疗效监测的一个参考指标。
[1] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] Nakamura K, Sawada K, Yoshimura A, et al. Clinical relevance of circulating cell-free microRNAs in ovarian cancer[J]. Mol Cancer, 2016,15(1):48.
[4] Szajnik M, Czystowska-Kuomicz M, Elishaev E, et al. Biological markers of prognosis, response to therapy and outcome in ovarian carcinoma[J]. Expert Rev Mol Diagn, 2016,16(8):811-826.
[5] Elnakat H, Ratnam M. Distribution, functionality and gene regulation of folate receptor isoforms: implications in targeted therapy[J]. Adv Drug Deliv Rev, 2004,56(8):1067-1084.
[6] Basal E, Eghbali-Fatourechi GZ, Kalli KR, et al. Functional folate receptor alpha is elevated in the blood of ovarian cancer patients[J]. PLoS One, 2009,4(7):6292.
[7] Kelemen LE, Brenton JD, Parkinson C, et al. Conditions associated with circulating tumor-associated folate receptor 1 protein in healthy men and women[J]. PLoS One, 2014,9(5):96542.
[8] Vergote IB, Marth C, Coleman RL. Role of the folate receptor in ovarian cancer treatment: evidence, mechanism, and clinical implications[J]. Cancer Metastasis Rev, 2015,34(1):41-52.
[9] Notaro S, Reimer D, Fiegl H, et al. Evaluation of folate receptor 1 (FOLR1) mRNA expression, its specific promoter methylation and global DNA hypomethylation in type I and type II ovarian cancers[J]. BMC Cancer, 2016,16(5):589.
[10] Leung F, Dimitromanolakis A, Kobayashi H, et al. Folate-receptor 1 (FOLR1) protein is elevated in the serum of ovarian cancer patients[J]. Clin Biochem, 2013,46(15):1462-1468.
[11] Kurosaki A, Hasegawa K, Kato T, et al. Serum folate receptor alpha as a biomarker for ovarian cancer: Implications for diagnosis, prognosis and predicting its local tumor expression[J]. Int J Cancer, 2016,138(8):1994-2002.
[12] Youden WJ. Index for rating diagnostic tests[J]. Cancer, 2010,53(1):32-35.
[13] Holm J, Babol LN, Markova N, et al. The interrelationship between ligand binding and thermal unfolding of the folate binding protein. The role of self-association and pH[J]. Biochim Biophys Acta, 2014,1844(3):512-519.
[14] Holm J, Lawaetz AJ, Hansen SI. Ligand binding induces a sharp decrease in hydrophobicity of folate binding protein assessed by 1-anilinonaphthalene-8-sulphonate which suppresses self-association of the hydrophobic apo-protein[J]. Biochem Biophys Res Commun, 2012,425(1):19-24.
[15] Kelemen LE, Sellers TA, Keeney GL, et al. Multivitamin and alcohol intake and folate receptor alpha expression in ovarian cancer.[J] Cancer Epidemiol Biomarkers Prev, 2005,14(9):2168-2172.
[16] O′Shannessy DJ, Somers EB, Palmer LM, et al. Serum folate receptor alpha, mesothelin and megakaryocyte potentiating factor in ovarian cancer: association to disease stage and grade and comparison to CA125 and HE4[J]. J Ovarian Res, 2013,6(1):29.
[17] Kurosaki A, Hasegawa K, Kato T, et al. Serum folate receptor alpha as a biomarker for ovarian cancer: Implications for diagnosis, prognosis and predicting its local tumor expression[J]. Int J Cancer,2016,138(8):1994-2002.
