低剂量抑制剂Inhibex501存在下的甲烷水合物相平衡研究*
2018-03-15唐翠萍戴兴学梁德青李栋梁
唐翠萍,戴兴学,梁德青†,李栋梁
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院天然气水合物重点实验室,广州 510640;
3. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640;4. 中国科学院广州天然气水合物中心,广州 510640)
0 引 言
天然气水合物是一种笼型晶体,由水和天然气在高压低温下形成的固体化合物。水分子作为主体分子,以氢键相互作用形成笼型结构,气体分子如甲烷、乙烷以及丙烷等填充于笼中。天然气分子与水分子由较弱的范德华力相互作用[1]。自从在天然气管道中发现堵塞管道的不是冰而是水合物引起的,如何在油气生产和输运过程中抑制天然气水合物的形成就成了石油和天然气工业需要解决的问题。为避免天然气水合物管道堵塞,人们采取了很多不同的措施,比如避免高压(但是这种方法会影响管道的输送能力);避免低温(可以通过管线保温来实现,但是在一些自然环境恶劣的条件下很难做到);除水(在输送至脱水平台前的一段距离仍然有水合物形成的风险)。现在最常用的方法是添加抑制剂,包含热力学抑制剂和低剂量抑制剂两种[2]。
常用的热力学抑制剂主要是醇类和电解质类,这些抑制剂主要通过改变水合物形成的相平衡条件,使水合物形成移向更高的压力或更低的温度,从而避免水合物形成,盐或醇类的存在对天然气水合物形成相平衡条件的影响已有诸多报道[3-6]。热力学抑制剂只要加入量足够,就不会形成水合物,但其使用浓度高,有时高达60wt%,加入量大,且一些添加剂会对环境产生危害,比如甲醇等,所以现在人们常常研究低剂量抑制剂来代替热力学抑制剂的使用。与热力学抑制剂相比,低剂量抑制剂在很低浓度时就可以起抑制作用,一般使用浓度在0.5wt% ~ 2wt%。低剂量抑制剂主要包含两种,阻聚剂和动力学抑制剂,被认为是通过阻止水合物成核或者聚集来改变水合物聚集速率,即抑制剂只能在一定时间内起作用[7]。
动力学抑制剂一般是水溶性的高分子化合物,其分子和水合物晶体表面相互作用,从而影响水合物成核或生长[8-12]。目前关于动力学抑制剂的研究主要集中在机理研究和经济有效的抑制剂的开发,特别是动力学抑制剂和其他抑制剂或协同剂联用的抑制剂的开发。KHODAVERDILOO等[13]研究了壬基酚聚氧乙烯醚(NPEs)和 聚乙二醇(PEGs)在乙烷水合物中对聚乙烯吡咯烷酮(PVP)抑制效果的影响,认为NPEs和PEGs能明显增加PVP的抑制效果,使水合物形成诱导期延长4 ~ 20倍,同时还能降低初始形成速率。JOKANDAN等[14]研究了三种高分子 PEG、聚丙烯酰胺(PAM)和羟乙基纤维素(HEC)和 PVP的联合使用对甲烷水合物形成诱导时间和生长速率的影响,三种高分子可以显著提高 PVP的抑制效果,降低水合物生长速率。FOO等[15]研究了低浓度的醇类(<0.45%)对动力学抑制剂 PEO-co-VCap-1效果的影响,认为这些醇分子的存在增加了动力学抑制剂在THF水合物晶体表面的吸附,降低了水合物的笼占有率,增大了抑制效果。
当动力学抑制剂和热力学抑制剂联用时,既能从热力学作用又能从动力学角度进行抑制,但是动力学抑制剂本身对水合物相平衡的影响目前并没有进行研究。本文研究不同质量浓度商业抑制剂Inhibex501(50% N-乙烯基乙酰胺与50% N-乙烯基己内酰胺的共聚物溶解在 2-乙二醇单丁醚中)对甲烷水合物形成的相平衡条件的影响。
1 实验部分
1.1 实验装置
本实验所采用的实验装置在以前的研究中已有介绍[16]。装置的主要部分是一个体积为100 mL的圆柱形不锈钢反应釜,反应釜放置于充满乙二醇的制冷槽内。反应釜上配有磁力搅拌以及温度和压力传感器,温度传感器和压力传感器精度分别为 ±0.1 K和 ±25 kPa,实验数据用安捷伦34901A数据采集仪每隔10 s采集一次。
1.2 实验材料
本实验所用气体为甲烷,纯度99.99vol%,由佛山市华特气体有限公司提供。水为实验室自制二次蒸馏水。添加剂Inhibex501由美国国际特品有限公司(ISP)提供。乙二醇单丁醚由天津市博迪化工有限公司生产,纯度(质量分数)大于99.0%。
1.3 实验过程
水合物相平衡点的测量采用等容压力搜索法[17]。首先连接好装置,对整个体系抽真空,利用真空将反应釜用蒸馏水清洗3 ~ 4遍,再用实验气体吹扫一遍,然后吸入实验液体约60 mL,随后注入甲烷气到预定压力,关闭反应釜和气瓶之间的供气阀。开启恒温水浴,对体系降温,开通磁力搅拌系统。通过压力突降以及温度突升指示水合物形成。当水合物形成后,升高温度到比预测相平衡点稍低一点(1 ~ 2 K)的位置,然后以0.1 K幅度缓慢升温,且在每个温度点恒温至少4 h以上,使釜内温度、压力达到平衡,以确保反应釜内水合物完全分解,直至温度恢复到初始实验时的温度,结束实验。P-T图上温压线出现明显的拐点处被认定为水合物分解点,即水合物相平衡点。
2 结果与讨论
2.1 纯水中的甲烷水合物相平衡
甲烷在纯水中的相平衡数据在之前的研究中已有介绍[16],这里不再详述。
实验结果如图1。
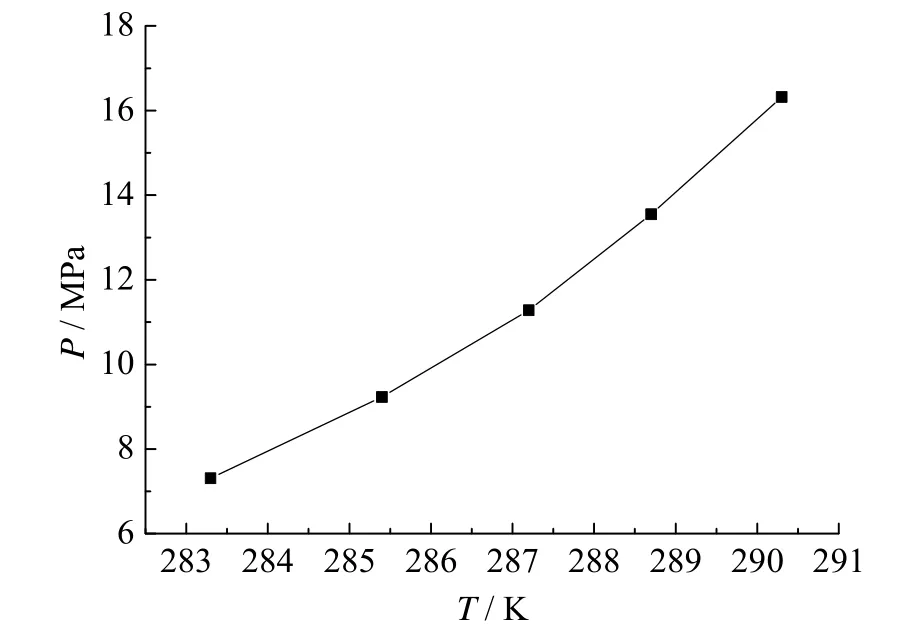
图1 甲烷水合物在纯水中的相平衡曲线Fig. 1 Phase equilibrium curve of methane hydrate in pure water
根据图 1,采用实验数据拟合出温度和压力的对数关系如下:

2.2 含Inhibex501的甲烷水合物的相平衡测试
实验过程中对含有Inhibex501的甲烷体系水合物相平衡条件进行了一系列测试,所测数据显示在表1和图2中。ΔP显示了在相同温度条件下,甲烷水合物相平衡压力的差别,由下式进行计算:

其中,Pcalc由式(1)计算得到,Pexp为实验值。
偏差百分比(D)采用下式进行计算:


表1 Inhibex501存在时甲烷水合物的相平衡数据Table 1 Experimental equilibrium data for methane hydrate in the presence of Inhibex501
从图2可以看出,在实验压力范围内,0.5wt%和2.0wt%浓度的Inhibex501使得甲烷水合物相平衡曲线移向更高的温度,幅度大约为1.5 ~ 2.1 K,即动力学抑制剂Inhibex 501从热力学上来说,能够促进水合物的形成,使得水合物稳定区移向更高的温度或者更低的压力。需要注意的是,从图 2中的P-T曲线可以看出,相对于含有 0.5wt%Inhibex501,含有2.0wt% Inhibex501的甲烷水合物相平衡曲线更靠向低温高压方向,但其差别很小。可见,Inhibex501是一种非常有效的动力学抑制剂,能够抑制水合物的成核或者生长,但是,从热力学上来说,其可以改变甲烷水合物形成的相平衡条件,并且不是像传统的热力学抑制剂,而是具有一定的热力学促进作用,使得水合物形成移向更高的温度或者更低的压力。实际操作中,在进行热力学抑制剂与动力学抑制剂连用时,特别是热力学抑制剂加入量很少的情况下,要考虑动力学抑制剂对溶液相水合物相平衡的影响,否则有可能影响抑制效果。
Inhibex501是有含50% N-乙烯基乙酰胺与50%N-乙烯基己内酰胺的共聚物(P(VP/VC))溶解在2-乙二醇单丁醚中形成的混合物。本文就2-乙二醇单丁醚对甲烷水合物形成相平衡条件的影响进行研究,所得数据列于表2和图3。
表2和图3显示,在0.2wt% ~ 1.0wt%浓度范围内,2-乙二醇单丁醚对甲烷水合物的形成相平衡条件几乎没有改变。

表2 2-乙二醇单丁醚存在时甲烷水合物的相平衡数据Table 2 Experimental equilibrium data for methane hydrate in the presence of 2-butoxyethanol

图3 2-乙二醇单丁醚对甲烷水合物相平衡的影响Fig. 3 Experimental equilibrium data of methane hydrate in the presence of 2-butoxyethanol aqueous solution
图4显示了不同质量浓度的2-乙二醇单丁醚对甲烷水合物形成影响的偏差。在 0.2wt%和 0.5wt%的浓度情况下,偏差百分比在1.5%以内,而当浓度为1.0wt%,最大的偏差也只是3.1%。可以说明,在该浓度和温度范围内,2-乙二醇单丁醚对甲烷水合物相平衡条件的影响很小,可以忽略。那么Inhibex 501在热力学上促进甲烷水合物的形成可能有两个原因:(1)聚合物 P(VP/VC) 对甲烷水合物相平衡有很明显的影响;(2)P(VP/VC) 在2-乙二醇单丁醚中的溶解导致了甲烷相平衡条件的改变。

图4 不同质量浓度2-乙二醇单丁醚对甲烷水合物相衡影响的偏差Fig. 4 Influence of 2-butoxyethanol with different concentrations on methane hydrate equilibrium data
3 结 论
本文在 283.6 ~ 290.6 K、7.51 ~ 15.97 MPa 的温度压力范围内,采用恒容压力搜索法对含有抑制剂Inhibex 501和2-乙二醇单丁醚体系的甲烷水合物相平衡条件进行了研究。实验结果显示,热力学上Inhibex501可以促进水合物的形成,使甲烷水合物形成条件移向更高的温度和更低的压力,不同质量浓度的Inhibex501对甲烷水合物相平衡的影响差别很小,而2-乙二醇单丁醚,作为Inhibex501的组分之一,对甲烷水合物的形成条件基本没有影响。
[1]SLOAN E D. Clathrate hydrate of nature gases[M]. 2nd ed. New York: Marcel Dekker Inc, 1998: 27-49.
[2]KELLAND M A, SVARTAAS T M, DYBVIK L.Studies on gas hydrate inhibitors[C]//Proceedings of the SPE Offshore Europe Conference. Aberdeen: Society of Petroleum Engineers, 1995: 531-539.
[3]LEI H Y, ZHENG Y H, WU B X. Equilibrium PT curve of methane hydrates in the presence of AlCl3[J]. Chinese science bulletin, 2003, 48(1): 53-56. DOI: 10.1007/BF03183334.
[4]DHOLABHAI P D, ENGLEZOS P, KALOGERAKIS N,et al. Equilibrium conditions for methane hydrate formation in aqueous mixed electrolyte solutions[J]. The Canadian journal of chemical engineering, 1991, 69(3):800-805. DOI: 10.1002/cjce.5450690324.
[5]MAEKAWA T. Equilibrium conditions for clathrate hydrates formed from methane and aqueous propanol solutions[J]. Fluid phase equilibria, 2008, 267(1): 1-5.DOI: 10.1016/j.fluid.2008.02.006.
[6]MOHAMMADI A H, KRAOUTI I, RICHON D.Methane hydrate phase equilibrium in the presence of NaBr, KBr, CaBr2, K2CO3, and MgCl2aqueous solutions:experimental measurements and predictions of dissociation conditions[J]. The journal of chemical thermodynamics,2009, 41(6): 779-782. DOI: 10.1016/j.jct.2009.01.004.
[7]唐翠萍, 梁德青, 樊栓狮. 不同气体组成对低剂量抑制剂效果的影响[J]. 石油与天然气化工, 2011, 40(3):228-231. DOI: 10.3969/j.issn.1007-3426.2011.03.002.
[8]MOON C, TAYLOR P C, RODGER P M. Molecular dynamics study of gas hydrate formation[J]. Journal of the American chemical society, 2003, 125(16): 4706-4707.DOI: 10.1021/ja028537v.
[9]JENSEN L, THOMSEN K, VON SOLMS N V. Propane hydrate nucleation: experimental investigation and correlation[J]. Chemical engineering science, 2008, 63(3):3069-3080. DOI: 10.1016/j.ces.2008.03.006.
[10]PENG B Z, SUN C Y, LIU P, et al. Interfacial properties of methane/aqueous VC-713 solution under hydrate formation conditions[J]. Journal of colloid and interface science, 2009, 336(2): 738-742. DOI: 10.1016/j.jcis.2009.04.028.
[11]MAKOGON T Y, SLOAN E D. Mechanism of kinetic hydrate inhibitors[C]//Proceedings of 4th International Hydrate Conference. Yokohama: Keio University, 2002:498-503.
[12]XU P, LANG X M, FAN S S, et al. Molecular dynamics simulation of methane hydrate growth in the presence of the natural product pectin[J]. The journal of physical chemistry C, 2016, 120(10): 5392-5397. DOI: 10.1021/acs.jpcc.5b10342.
[13]KHODAVERDILOO K R, RAD S A, NAEIJI P, et al.Synergistic effects of nonylphenol ethoxylates and polyethylene glycols on performance of gas hydrate kinetic inhibitor[J]. Journal of molecular liquids, 2016,216: 268-274. DOI: 10.1016/j.molliq.2015.12.107.
[14]JOKANDAN E F, NAEIJI P, VARAMINIAN F. The synergism of the binary and ternary solutions of polyethylene glycol, polyacrylamide and Hydroxyethyl cellulose to methane hydrate kinetic inhibitor[J]. Journal of natural gas science and engineering, 2016, 29: 15-20.DOI: 10.1016/j.jngse.2015.12.016.
[15]FOO C W, RUAN L X, LOU X. The inhibition performance in relation to the adsorption of a polymeric kinetic inhibitor towards THF hydrates in the presence of methanol, ethanol and monoethylene glycol[J]. Journal of natural gas science and engineering, 2016, 35:1587-1593. DOI: 10.1016/j.jngse.2016.05.059.
[16]唐翠萍, 戴兴学, 梁德青. 聚乙烯吡咯烷酮对甲烷水合物形成热力学条件的影响[J]. 新能源进展, 2014,4(1): 28-32. DOI: 10.3969/j.issn.2095-560X.2016.01.005.
[17]TOHIDI B, BURGASS R W, DANESH A, et al.Improving the accuracy of gas hydrate dissociation point measurements[J]. Annals of the New York academy of sciences, 2000, 912: 924-931. DOI: 10.1111/j.1749-6632.2000.tb06846.x.
