微量元素对蔬菜废弃物厌氧消化的促进效果*
2018-03-15刘晓风
孙 娟 ,李 东 ,郑 涛 †,刘晓风
(1. 常州大学城乡矿山研究院,江苏 常州,213164;2. 中国科学院成都生物研究所,成都 610041)
0 引 言
据联合国粮农组织统计数据,中国蔬菜产量位居世界第一,占世界总量的 49%[1],同时我国每年产生的蔬菜废弃物达到了1亿t[2]。日常生活和农业生产的过程会产生大量的蔬菜废弃物,新鲜果蔬废弃物占我国城市生活的20% ~ 50%[3]。随着我国农业集约化种植的迅速发展,果蔬废弃物的产量急剧增加,在农作物中所占比重越来越大[4]。目前对蔬菜废弃物的处理主要有焚烧、堆肥、卫生填埋等。其中焚烧和卫生填埋是中国最常见的垃圾处理方式,但其产生的二次污染、能耗以及大范围占地将对环境问题和经济效益带来麻烦[4]。蔬菜废弃物含水率和有机质含量高,非常适宜厌氧消化处理,该工艺能产生沼气清洁能源,消化产物还可用作土壤改良剂或者有机肥,是实现蔬菜废弃物垃圾资源化和减量化的最佳途径[5-6]。
然而,蔬菜废弃物是一种极易腐败的原料,在厌氧消化过程中容易出现酸化抑制产气,尤其是在高负荷厌氧消化条件下,水解酸化与产甲烷两个过程不能较好地匹配,极易引起挥发性有机酸积累,产甲烷受到抑制,最终导致厌氧消化系统失稳[7]。因此,大部分沼气工程选择在低负荷条件下运行,虽能保证沼气发酵系统的稳定,但无法兼顾效率,造成反应器体积资源的浪费,使得工程整体的经济性比较差[8]。
微量元素(trace element, TE)Fe、Co、Ni的添加已成功地促进不同底物的厌氧消化系统,比如玉米秸秆、小麦秸秆、餐厨垃圾、屠宰场垃圾等[9-12]。金属酶是产甲烷化和产酸化阶段重要的辅助因子,同时,微量元素在金属酶中会形成酶活性中心,其中金属酶包括氢化酶、辅脱氢酶、甲基转移酶、甲酸脱氢酶,微量元素对厌氧消化系统非常重要[13-16]。
目前,对微量元素调控蔬菜废弃物厌氧消化系统的研究还非常少,为使蔬菜废弃物厌氧消化过程能够在高负荷下稳定运行,本文通过添加微量元素来及时调控,强化稳定厌氧消化。
1 实验部分
1.1 试验原料
1.1.1 发酵原料
蔬菜废弃物取自四川省成都市海吉星蔬菜交易区,每次取样100 kg,一共取样3次。利用湿物粉碎机将蔬菜样粉碎至粒径4 ~ 5 mm并搅拌均匀,放置于4℃冰柜中冷藏保存。原料基本性质列于表1。
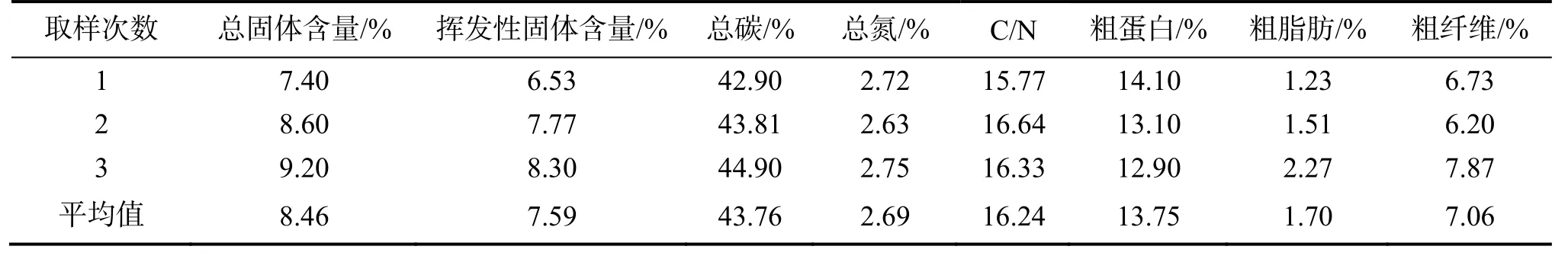
表1 蔬菜废弃物理化性质Table 1 Physical-chemical characteristics indexes of the vegetable waste
1.1.2 接种物
本试验接种物取自成都市双流县某沼气基地沼气池,以猪粪为主。往反应器中加入59.5 L接种物,在中温条件下(35℃)进行为期20 d的驯化培养。驯化后接种物pH值在7 ~ 8范围内,甲烷质量分数在60%以上。
1.2 试验装置与方法
试验装置为连续搅拌全混式反应器(continuous stirred tank reactor, CSTR),在线监测pH、ORP、温度、产气量。发酵罐总体积70 L,有效体积59.5 L,顶部配有搅拌电机,每天搅拌8次,每次搅拌30 min,转速30 ~ 40 r/min。反应器外部有加热保温装置,将反应罐内温度控制在35℃。试验反应装置如图1所示。

图1 70- L厌氧消化试验反应装置图Fig. 1 The reactor of 70 L AD experiment
试验运行条件如表2所示。每天定时从发酵罐排放出2.98 L沼液,并将沼液中沼渣过滤。向反应器投加回流的沼液体积与原料体积之和等于排放沼液的体积。除了在线监测的指标,每天监测沼气中的CH4浓度。当CH4浓度呈持续下降趋势时,立即添加微量元素(Fe、Co、Ni)至系统指标恢复稳定值,再提高有机负荷率(organic Loading rate, OLR)。微量元素投加量为 Fe 1.0 mg/(L·d)、Co 0.1 mg/(L·d)、Ni 0.2 mg/(L·d)。

表2 试验运行条件Table 2 Operating condition of the digestion
1.3 指标分析方法
总固体(total solid, TS)采用烘干法、挥发性固体(volatile solid, VS)采用称重法进行测定;C、N采用元素分析仪测定;粗纤维、粗蛋白和粗脂肪采用国标法(GB/T2009-2003)测定;气体成分采用Agilent 7890A气相色谱进行分析,主要分析CH4和CO2含量,色谱柱为 G3591-70015 3m 1/8 2mm MOLSIEVE 13X 80/100 SS,TCD检测器,载气为氩气,流速为 30 mL/min,进样口、柱箱和检测器温度分别为100℃、70℃和150℃。
微量元素(Fe、Co、Ni)采用电感耦合等离子体质谱(ICP-MS)检测分析(HJ 776-2015)。
2 结果与讨论
2.1 池容产甲烷率与微量元素
微量元素的促进效果需从厌氧消化系统的产甲烷能力来评价,即沼气的甲烷含量及池容产甲烷率(volumetric methane production rate,VMPR)。
图2是CH4含量和微量元素的变化趋势图。在厌氧消化启动初期,蔬菜废弃物逐渐替代原有反应器内的发酵物料。原有反应器的发酵物料为氨氮含量较高的猪粪,产生的沼气中CH4含量较高;而蔬菜废弃物的氨氮含量较低,产生的沼气中CH4含量相对较低。因此,在OLR 0.5 gVS/(L·d) 的运行条件下,CH4含量呈下降趋势。在OLR 1.0 ~ 1.5 gVS/(L·d)的运行条件下,CH4含量稳定在50% ~ 55%,说明厌氧消化系统较为稳定。当OLR提高到2.0 gVS/(L·d),CH4含量开始快速下降,从50%降到了40%,说明系统产甲烷的能力在下降,产甲烷菌可能受到挥发性脂肪酸的抑制。从第103天开始添加微量元素,CH4含量出现了快速上升的趋势,最高达到了72.6%。添加5天后,CH4含量再次稳定在50% ~ 55%,说明厌氧消化系统恢复稳定。此后的运行过程中,进一步提高OLR。当系统运行至OLR 3.0 gVS/(L·d)的第20天,CH4含量从58.9%降至53.4%,虽仍保持在50%以上,但下降的幅度较大,说明厌氧消化系统可能受到轻微的挥发酸抑制,此时立即添加微量元素。3天后CH4含量再次恢复到了55%以上。

图2 CH4含量和微量元素含量趋势图Fig. 2 Evaluation of CH4 and trace elements
图3是VMPR随OLR的变化趋势图。在OLR 0.5 gVS/(L·d) 运行条件下,VMPR呈下降趋势,后10 天则趋于稳定。在 OLR 1.0 ~ 1.5 gVS/(L·d) 的运行条件下,VMPR呈现出阶梯式的增长,说明厌氧消化系统产甲烷性能良好。然而在OLR 2.0 gVS/(L·d) 开始阶段,VMPR值相对OLR 1.5 gVS/(L·d) 没有明显的增长,说明系统产气受到抑制。从第103天开始添加微量元素,VMPR出现了快速上升的趋势,从 0.38 L/(L·d) 升到最高 1.43 L/(L·d),此后稳定在0.6 L/(L·d) 左右。继续提高OLR,VMPR也有明显增大。第二次微量元素的添加对VMPR也起到积极作用。整体来看,VMPR随OLR增大而增大。

图3 VMPR变化趋势图Fig. 3 Evaluation of VMPR
两次添加后,Fe、Co、Ni含量都明显增大,CH4含量和VMPR均随之快速上升。这是由于Co的补给可以促进厌氧消化系统乙酸化,给产甲烷菌提供更多的直接消化底物,同时微量元素 Fe、Co、Ni又能促进产甲烷化[17-19]。停止微量元素添加后,厌氧消化系统内的微量元素仍然能够保证厌氧消化微生物的生长和产甲烷代谢需求,因此厌氧消化系统能够长期稳定运行。
2.2 挥发性脂肪酸含量、pH和ORP的变化规律
表3是添加微量元素前后挥发性脂肪酸浓度的变化情况。第一次添加是103天到112天,第一天微量元素的添加未能迅速改变各挥发性脂肪酸的高含量状态,但在添加了 10天后,挥发性脂肪酸主要为乙酸和丙酸,且含量都比较低,乙酸从3815.24 mg/L降至108.53 mg/L,丙酸从772.10 mg/L降至48.10 mg/L,正/异丁酸和正/异戊酸含量都为0。第二次添加是在196天到198天,这次添加的第一天,乙酸、丙酸、异丁酸和异戊酸含量都迅速降低,在199天时,乙酸含量已降至132.55 mg/L,丙酸、异丁酸和异戊酸含量均低于100 mg/L。

表3 微量元素添加前后挥发性脂肪酸含量的变化Table 3 VFAs changes for trace elements addition
由于微量元素Fe和Co能够促进乙酸化,同时Ni又能够促进乙酸的利用率[17-19],因而在厌氧发酵系统挥发性脂肪酸大量累积后添加微量元素能够加快其转化。
图4是系统pH和ORP的变化趋势图。在OLR 0.5 ~ 1.5 gVS/(L·d) 期间,pH 基本维持在 7.5 ~ 7.9,ORP则基本小于-530 mV,除了厌氧消化启动初期pH和ORP的波动稍大,OLR 0.5 gVS/(L·d) 稳定期后都呈现平稳的趋势。但当厌氧消化过程运行到OLR 2.0 gVS/(L·d) 时,pH出现明显的下降趋势,ORP则明显上升,这说明厌氧消化系统开始出现挥发性脂肪酸的积累。为避免系统进一步恶化,从第113天开始添加微量元素,添加之后,pH迅速从7.21升至7.65,与此同时ORP迅速降低,从-509 mV降至-539 mV,添加5天后,pH与ORP都基本恢复到之前稳定的状态。第二次添加后,pH迅速从7.16升至7.34,再稳定在7.20左右。第一次添加微量元素与第二次添加之间隔了83 d,且这期间 OLR 从 2.0 gVS/(L·d) 升到了 3.0 gVS/(L·d)。
厌氧消化过程 pH值下降一般意味着有挥发性脂肪酸累积,ORP则反映微生物细胞内部的氧化还原状态,若呈上升趋势说明系统的丙酸增加使得NADH被氧化为 NAD+。微量元素的添加促进挥发性脂肪酸的降解,从而使得pH和ORP出现显著变化,说明微量元素对挥发性脂肪酸的降解起了促进作用,稳定了厌氧消化过程。

图4 pH和ORP趋势图Fig. 4 Evaluation of pH and ORP
3 结 论
微量元素添加能够有效提高蔬菜废弃物厌氧消化稳定运行的有机负荷。蔬菜废弃物中温厌氧消化系统在沼液全回流的进料方式下,运行至OLR 2.0 gVS/(L·d) 时,消化过程中CH4含量快速下降,通过添加微量元素Fe、Co、Ni,CH4含量、pH和ORP均快速地恢复至稳定状态,且厌氧消化过程可在高负荷条件下长期稳定运行。同时微量元素的添加可有效提高池容产甲烷率,VMPR在稳定状态下可达到 1.0 L/(L·d)。
[1]李崇光, 包玉泽. 我国蔬菜产业发展面临的新问题与对策[J]. 中国蔬菜, 2010, 1(15):1-5.
[2]刘振东, 李贵春, 杨晓梅,等. 我国农业废弃物资源化利用现状与发展趋势分析[J]. 安徽农业科学, 2012, 40(26):13068-13070. DOI: 10.13989/j.cnki.0517-6611. 2012.26.10.
[3]董永亮. 果蔬废弃物两相厌氧消化特征研究[J]. 能源环境保护, 2011, 25(4): 19-23, 28. DOI: 10.3969/j.issn. 1006-8759.2011.04.005.
[4]张丽颖, 姜永海, 邓舟, 等. 城市生物质废物厌氧消化处理可行性分析[J]. 环境科学与技术, 2010, 33(5): 143-146,150. DOI: 10.3969/j.issn.1003-6504.2010.05.034.
[5]郝吉明, 马广大, 王书肖. 大气污染控制工程[M]. 3版.北京: 高等教育出版社, 2010.
[6]刘广民, 董永亮, 薛建良, 等. 果蔬废弃物厌氧消化特征及固体减量研究[J]. 环境科学与技术, 2009, 32(3): 27-30,49. DOI: 10.3969/j.issn.1003-6504.2009.03.007.
[7]贾传兴, 彭绪亚, 黄媛媛, 等. 有机垃圾厌氧消化系统失稳预警指标的研究进展[J]. 中国给水排水, 2011, 27(24):30-35.
[8]POLAG D, MAY T, MÜLLER L, et al. Online monitoring of stable carbon isotopes of methane in anaerobic digestion as a new tool for early warning of process instability[J].Bioresource technology, 2015, 197: 161-170. DOI: 10.1016/j.biortech.2015.08.058.
[9]EVRANOS B, DEMİREL B. The impact of Ni, Co and Mo supplementation on methane yield from anaerobic monodigestion of maize silage[J]. Environmental technology,2015, 36(12): 1556-1562. DOI: 10.1080/ 09593330.2014.997297.
[10]SCHMIDT T, NELLES M, SCHOLWIN F, et al. Trace element supplementation in the biogas production from wheat stillage-optimization of metal dosing[J]. Bioresource technology, 2014, 168: 80-85. DOI: 10.1016/j.biortech.2014.02.124.
[11]BANKS C J, ZHANG Y, JIANG Y, et al. Trace element requirements for stable food waste digestion at elevated ammonia concentrations[J]. Bioresource technology, 2012,104: 127-135. DOI: 10.1016/j.biortech.2011.10.068.
[12]MOESTEDT J, NORDELL E, YEKTA S S, et al. Effects of trace element addition on process stability during anaerobic co-digestion of OFMSW and slaughterhouse waste[J]. Waste management, 2016, 47: 11-20. DOI: 10.1016/j.wasman.2015.03.007.
[13]FERRY J G. The chemical biology of methanogenesis[J].Planetary and Space Science, 2010, 58(14/15): 1775-1783.DOI: 10.1016/j.pss.2010.08.014.
[14]GLASS J B, ORPHAN V J. Trace metal requirements for microbial enzymes involved in the production and consumption of methane and nitrous oxide[J]. Frontiers in microbiology, 2012, 3: 61. DOI: 10.3389/fmicb.2012.00061.
[15]HOCHHEIMER A, HEDDERICH R, THAUER R K. The formylmethanofuran dehydrogenase isoenzymes in Methanobacterium wolfei and Methanobacterium thermoautotrophicum: induction of the molybdenum isoenzyme by molybdate and constitutive synthesis of the tungsten isoenzyme[J]. Archives of microbiology, 1998, 170(5):389-393. DOI: 10.1007/s002030050658.
[16]SHIMA S, WARKENTIN E, THAUER R K, et al. Structure and function of enzymes involved in the methanogenic pathway utilizing carbon dioxide and molecular hydrogen[J].Journal of bioscience and bioengineering, 2002, 93(6):519-530. DOI: 10.1016/S1389- 1723(02)80232-8.
[17]LJUNGDHAL L G. The autotrophic pathway of acetate synthesis in acetogenic bacteria[J]. Annual review of microbiology, 1986, 40: 415-450. DOI: 10.1146/ annurev.mi.40.100186.002215.
[18]JARVIS Å, NORDBERG Å, JARLSVIK T, et al.Improvement of a grass-clover silage-fed biogas process by the addition of cobalt[J]. Biomass and bioenergy, 1997,12(6): 453-460. DOI: 10.1016/S0961-9534(97) 00015-9.
[19]CHOONG Y Y, NORLI I, ABDULLAH A Z, et al. Impacts of trace element supplementation on the performance of anaerobic digestion process: a critical review[J]. Bioresource technology, 2016, 209: 369-379. DOI: 10.1016/j.biortech.2016.03.028.
