多效唑和矮壮素浸种对藜麦幼苗生长的影响
2018-03-14庞春花张永清华艳宏杨世芳王璐媛
贺 笑,庞春花,* ,张永清,华艳宏,杨世芳,王璐媛
(1.山西师范大学生命科学学院,山西临汾041000;2.山西师范大学现代文理学院生物系,山西临汾041000)
藜麦(Chenopodium quinoa Willd),属藜科,1年生草本植物,原产地为南美洲安第斯山脉,是当地的主要粮食作物之一[1-3]。藜麦具有耐寒、耐旱、耐瘠薄、耐盐碱等特性,是喜冷凉和高海拔作物,从海平面至海拔4 000多米都有分布,食用品种主要种植在安第斯山海拔3 000 m以上、年降雨量300 mm的山区[4-6]。藜麦营养价值丰富,籽粒蛋白质含量高达7%~22%,比普通谷物小麦、玉米等蛋白质含量都高,富含人体生命活动所需的9种必需氨基酸,且氨基酸组成均衡。藜麦含有的矿物质、纤维素等营养元素丰富且易于被人体吸收[7],不饱和脂肪酸、类黄酮、维生素E等多种对人体有益的物质含量也相当丰富,具有极佳的抗氧化能力[8]。藜麦是联合国国际粮农组织(FAO)确认的唯一能满足人体基本营养需求的单体植物,被誉为“超级谷物”,是未来最具潜力的农作物之一[9]。我国于20世纪80年代末在西藏地区进行藜麦试种研究,直到2008年才在山西省形成规模化种植[10]。我国种植藜麦的地区海拔多为700~3 000 m,主要集中在海拔2 000 m以下、年降水量600 mm以上的地方,这些地方由于海拔低、温度高、降雨量大,藜麦株高可长到1.8 m以上,甚至可高达3 m,而在原产区藜麦株高仅1.3 m左右[11]。藜麦本身属于浅根性作物,茎秆脆弱,易发生倒伏和茎秆折断现象。因此,藜麦在低海拔地区种植易发生倒伏,影响其推广。
目前,有多种可用于作物化学调控的植物生长调节剂,其中,多效唑和矮壮素这2种植物生长调节剂可以抑制植物茎的伸长,使植株变矮、茎秆变粗,防止作物徒长倒伏,对增加作物抗逆性具有重要作用,在玉米、大豆、花生、番茄等农作物上应用十分广泛[12-14]。但采用多效唑和矮壮素浸种对藜麦幼苗进行矮化调控的研究还未见报道。鉴于此,设置不同质量浓度的多效唑和矮壮素对藜麦进行浸种,比较多效唑和矮壮素对藜麦幼苗的形态指标、茎秆抗折力和倒伏指数以及叶绿素含量、根系活力、可溶性蛋白含量和可溶性糖含量的影响,旨在筛选出适宜的植物生长调节剂及其最佳的浸种浓度,为其在藜麦幼苗生长及培育壮苗中的应用提供依据。
1 材料和方法
1.1 试验材料
在山西师范大学试验基地进行盆栽试验,试验所用营养钵上口径 15 cm、底部直径 12 cm、高13 cm,每盆装沙3 kg。供试藜麦品种为藜麦1号,购自山西忻州亿隆藜麦科技推广有限公司。
1.2 试剂
主要试剂为30%双氧水、15%多效唑、90%矮壮素。
1.3 试验设计
采用完全随机试验设计,分别设置不同质量浓度多效唑和矮壮素对藜麦进行浸种,具体如下:多效唑质量浓度分别为50 mg/L(P1)、100 mg/L(P2)、150 mg/L(P3)、200 mg/L(P4)、300 mg/L(P5)、400 mg/L(P6),矮壮素质量浓度分别为 500 mg/L(C1)、1 000 mg/L(C2)、2 000 mg/L(C3)、3 000 mg/L(C4)、5 000 mg/L(C5)、7 000 mg/L(C6),同时,以蒸馏水浸种作为对照(CK),共13个处理,每个处理设5次重复,共65盆。
挑选饱满一致且没有病虫害的藜麦种子,用30%双氧水溶液消毒10 min,取出后用蒸馏水冲洗3次,将水分吸干,采用不同处理溶液对藜麦种子浸种12 h,浸种后的藜麦种子用蒸馏水冲洗3次,用于播种。播种时采用穴播方式,用打孔器在每盆中心和边缘等间距打7个孔,穴孔深度为1.5 cm,每孔播3粒藜麦种子,每盆共播种21粒,待幼苗长到2叶1心时定苗,每盆留苗7株,培养前期(前7 d)定量浇水,此后浇灌Hoagland营养液和水。培养50 d后,测定藜麦幼苗的形态指标、茎秆抗折力、倒伏指数和生理指标。
1.4 测定项目与方法
1.4.1 形态指标 株高用刻度尺直接测量,根系的总长和总体积用Win-RHizo 2009根系分析扫描仪测定,叶面积用LI-3000A叶面仪测定,用游标卡尺(精度0.02 mm)测量茎粗。根冠比测定:将不同处理的藜麦幼苗用去离子水洗净,迅速用吸水纸吸干,将植株按根、茎、叶分开,105℃杀青24 h后,75℃烘干48 h至恒质量,冷却后分别测定地上部分和根的干质量,计算根冠比。
1.4.2 茎秆抗折力、倒伏指数和壮苗指数 各处理剪取3株藜麦植株,测定茎秆重心高度、鲜质量、茎秆抗折力。
茎秆重心高度:用米尺准确量取茎秆基部至该茎秆平衡支点的距离,即为茎秆重心高度;茎秆鲜质量:用天平称取植株鲜质量;茎秆抗折力:取茎基部第2节间,置于SH-100数显示拉力计,将植株拉断瞬间的数值计为茎秆抗折力,单位为N。
倒伏指数[(cm·g)/N]=(茎秆重心高度×茎秆鲜质量)/茎秆抗折力,
壮苗指数=(茎粗/株高+根干质量/冠干质量)×总干质量。
1.4.3 生理指标 叶绿素含量测定采用丙酮乙醇混合液提取法[15],根系活力测定采用 TTC 法[14],叶片可溶性糖含量测定采用蒽酮比色法[15],可溶性蛋白含量测定采用考马斯亮蓝G-250染色法[16]。
1.5 数据处理
采用Excel 2007对数据进行处理,采用SPSS 17.0对试验数据进行差异显著性分析。
2 结果与分析
2.1 多效唑和矮壮素浸种对藜麦幼苗形态指标的影响
2.1.1 株高 由表1可知,采用不同质量浓度的多效唑和矮壮素对藜麦进行浸种,除C1处理外,其他各处理的藜麦幼苗株高均显著低于CK。同一调控剂处理,藜麦幼苗株高随调控剂质量浓度的增加而降低,其中,多效唑处理中,P1—P6处理藜麦幼苗的株高分别比 CK 降低 2.66%、11.03%、27.00%、33.84%、39.92%、51.71%;矮壮素处理中,C1—C6 处理藜麦幼苗的株高分别比CK降低1.14%、4.18%、6.84%、17.11%、24.71%、38.02%。
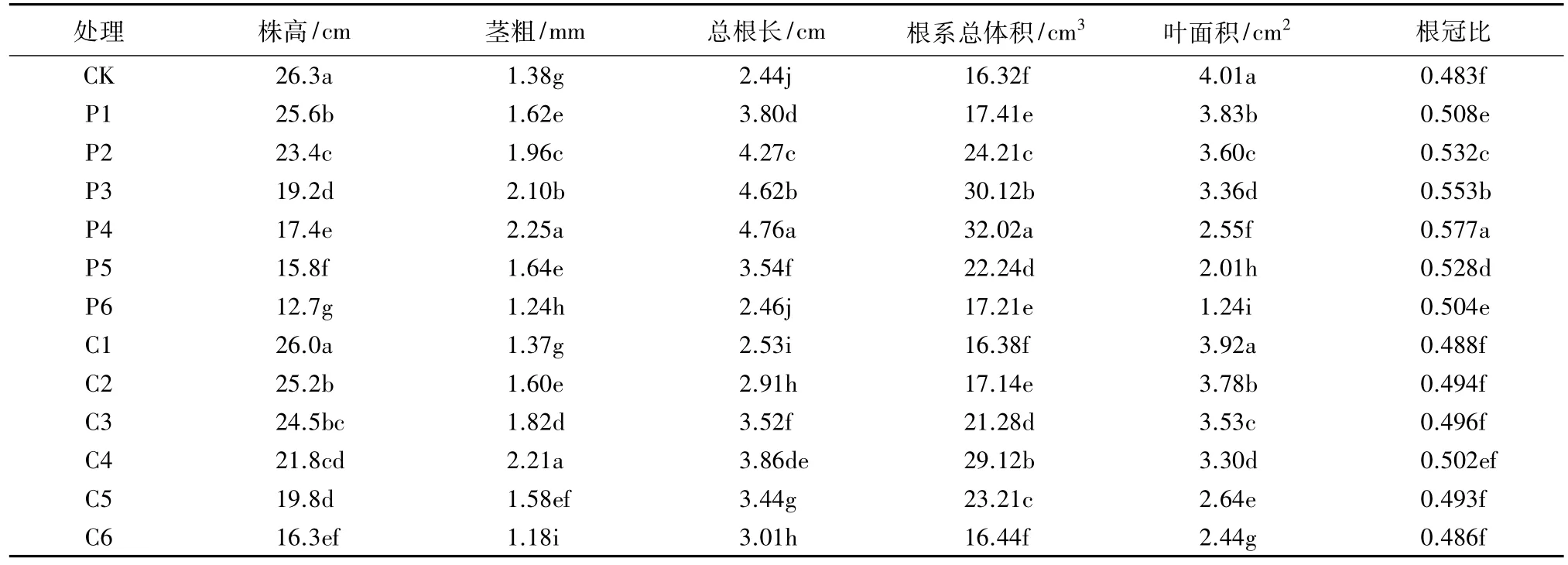
表1 不同质量浓度多效唑和矮壮素浸种对藜麦幼苗形态指标的影响
2.1.2 茎粗 由表1可见,多效唑各处理茎粗随多效唑质量浓度的增加呈先增加后降低的趋势,且均与CK差异显著;矮壮素处理中除C1和C6处理外,其余各处理茎粗与CK相比均呈增加趋势。当多效唑、矮壮素的质量浓度分别为200、3 000 mg/L时,藜麦植株的茎粗分别较 CK增加63.04%、60.14%。当多效唑、矮壮素的质量浓度进一步增加时,茎粗表现出明显的抑制现象。可见,在一定的浓度范围内,藜麦植株茎粗随调控剂质量浓度的增加呈增加趋势,超过一定的质量浓度将呈减小趋势。
2.1.3 根系生长 由表1可以看出,多效唑和矮壮素处理均能促进藜麦幼苗根系的伸长生长,且低浓度处理的促进效果更明显,当多效唑和矮壮素的质量浓度分别为200 mg/L和3 000 mg/L时,藜麦幼苗的根长最长,分别比CK增加95.08%和58.20%,之后,质量浓度增加,促进作用减弱。多效唑和矮壮素浸种在增加藜麦根长的同时也增加了根系的总体积,其中,200 mg/L多效唑浸种处理的根系总体积比CK增加了96.20%,3 000 mg/L矮壮素处理的根系总体积比CK增加了78.43%。同样,藜麦幼苗的根系总体积随矮壮素质量浓度的增加呈先增加后减小的趋势。
2.1.4 根冠比 与CK相比,随着多效唑和矮壮素质量浓度的提高,藜麦幼苗根冠比呈先增加后降低的趋势(表1)。其中,多效唑各质量浓度浸种处理幼苗的根冠比显著高于CK,200 mg/L多效唑浸种处理的根冠比与CK相比增加了19.46%。矮壮素各处理的幼苗根冠比也高于CK,但差异不显著。可见,利用不同质量浓度的多效唑和矮壮素进行浸种处理,可增大藜麦苗期的根冠比,促进地下部生长,有助于积累更多营养物质,为培育壮苗奠定了基础。
2.1.5 叶面积 由表1可知,藜麦幼苗的叶面积随着多效唑和矮壮素质量浓度的增加而减小,除C1处理叶面积与CK差异不显著,其余处理均与CK差异显著。多效唑处理中,P1—P6处理的叶面积分别较 CK 显著减小 4.49%、10.22%、16.21%、36.41%、49.88%、69.08%;矮壮素处理中,C2—C6 处理叶面积分别较 CK 显著减小 5.74%、11.97%、17.71%、34.16%、39.15%。
2.2 多效唑和矮壮素浸种对藜麦幼苗茎秆抗折力和倒伏指数的影响
抗折力是衡量作物茎秆抗倒伏能力的一个重要指标[17]。由表2可知,多效唑和矮壮素浸种处理后,藜麦幼苗茎秆抗折力均明显提高。其中,多效唑处理下,200 mg/L浸种的藜麦幼苗茎秆抗折力增加94.29%;矮壮素处理下,3 000 mg/L浸种的藜麦幼苗茎秆抗折力增加32.86%。可见,多效唑和矮壮素能够增强茎秆机械强度,且多效唑的作用效果更明显。
倒伏指数是茎秆机械强度、植株鲜质量和植株重心高度的综合体现,可作为衡量和评价作物抗倒伏能力的一个重要参数,倒伏指数越高,表明作物茎秆抗倒伏能力越强[18]。由表2可以看出,在一定浓度范围内,随着多效唑和矮壮素质量浓度的增加,藜麦茎秆倒伏指数上升,说明适量浓度的多效唑和矮壮素有利于提高茎秆倒伏指数,增强植株的抗倒伏能力。
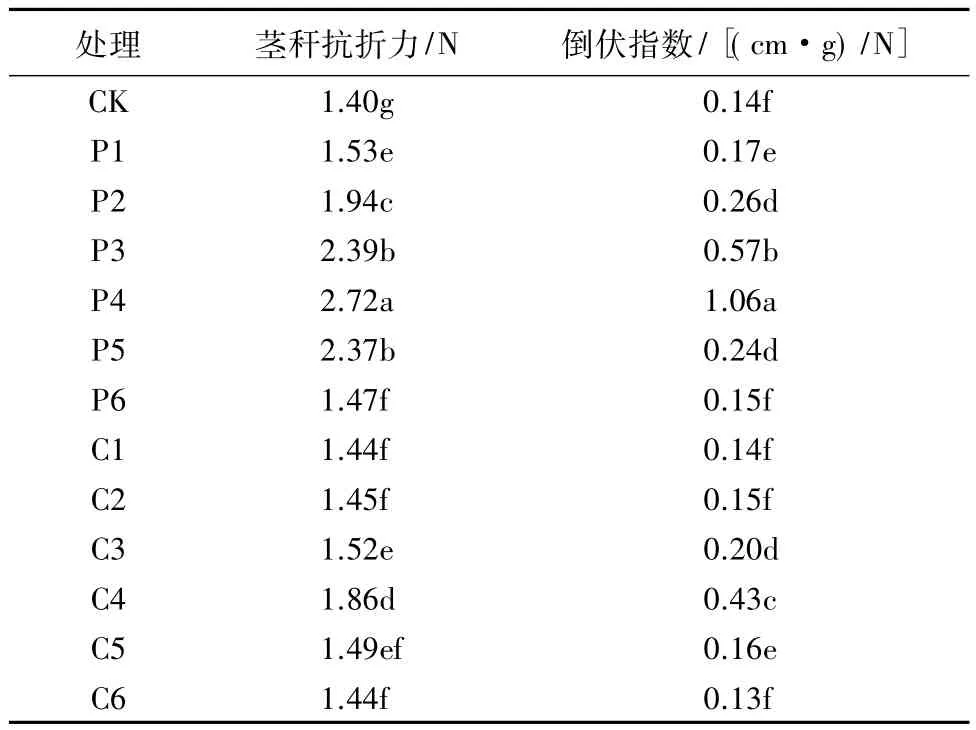
表2 不同质量浓度多效唑和矮壮素浸种对藜麦幼苗茎秆抗折力和倒伏指数的影响
2.3 多效唑和矮壮素浸种对藜麦幼苗壮苗指数的影响
壮苗指数是幼苗质量数量化的综合指标,壮苗指数越大,苗越壮。如图1所示,多效唑和矮壮素浸种处理的藜麦幼苗壮苗指数均呈低浓度促进、高浓度抑制的趋势,多效唑质量浓度为200 mg/L时,藜麦幼苗的壮苗指数最大,显著高于其他处理;低质量浓度(500 mg/L)矮壮素浸种处理藜麦幼苗的壮苗指数与CK无明显差异,随着矮壮素质量浓度的提高,藜麦幼苗的壮苗指数显著高于CK,质量浓度为3 000 mg/L时,藜麦幼苗的壮苗指数最大。
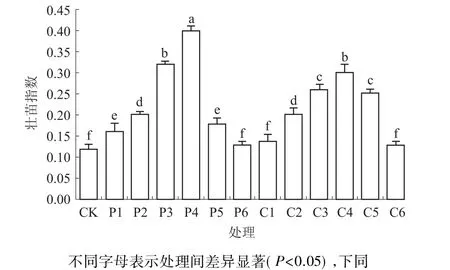
图1 不同质量浓度多效唑和矮壮素浸种对藜麦幼苗壮苗指数的影响
2.4 多效唑和矮壮素浸种对藜麦幼苗生理指标的影响
2.4.1 叶绿素含量 由图2可知,藜麦幼苗的叶绿素含量随多效唑和矮壮素质量浓度的增加均呈先升高后降低的趋势。多效唑处理下,各质量浓度浸种处理的叶绿素含量均显著高于CK,且各浓度处理间差异显著,其中,200 mg/L多效唑浸种处理的叶绿素含量最高,比CK增加了101.15%;矮壮素处理下,除C1和 C6处理外,其他各处理均显著高于CK,其中,3 000 mg/L矮壮素浸种处理的叶绿素含量最高,比CK增加了49.43%。可见,多效唑和矮壮素浸种可以提高幼苗的叶绿素含量,对增强藜麦幼苗的光合性能有正效应。
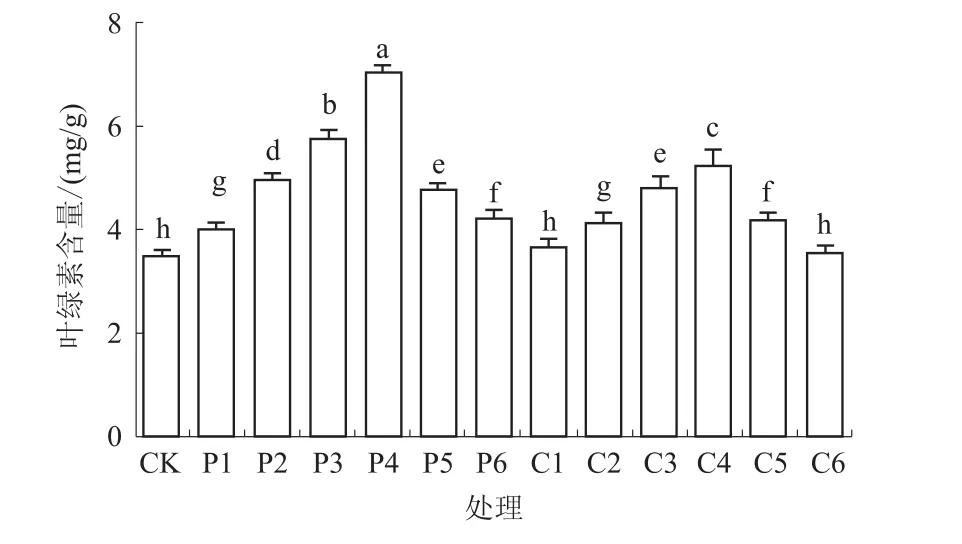
图2 不同质量浓度多效唑和矮壮素浸种对藜麦幼苗叶绿素含量的影响
2.4.2 根系活力 根系是植物吸收水分和养分的主要器官,其活力直接影响植株地上部的生长情况。由图3可知,不同质量浓度的多效唑和矮壮素浸种对藜麦幼苗根系活力有不同程度的影响。多效唑处理中,除了P1处理的根系活力与CK差异不显著外,其他浓度处理均显著高于CK,其中,P4处理根系活力最强,比CK提高52.86%。不同质量浓度的矮壮素浸种处理对藜麦幼苗根系活力的提升效果没有多效唑明显,其中,以3 000 mg/L矮壮素浸种处理的根系活力最大,比CK增加19.52%。可见,适宜浓度的多效唑可以显著提高藜麦幼苗的根系活力,具有壮苗效果。

图3 不同质量浓度多效唑和矮壮素浸种对藜麦幼苗根系活力的影响
2.4.3 可溶性糖含量 由图4可知,不同质量浓度多效唑和矮壮素浸种对藜麦叶片可溶性糖含量均有一定程度的影响。其中,不同质量浓度的多效唑处理显著高于CK,且多效唑对藜麦叶片可溶性糖含量的促进作用表现出随浓度升高呈先增加后降低的趋势,质量浓度为200 mg/L时可溶性糖含量最高,比CK增加27.59%;而矮壮素处理中,C1、C6处理可溶性糖含量与CK差异不显著,C3处理可溶性糖含量最高,较CK显著增加20.69%,C4处理次之,较CK增加 10.34%。
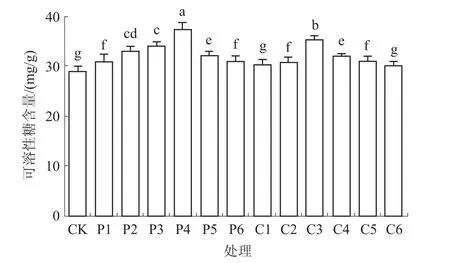
图4 不同质量浓度多效唑和矮壮素浸种对藜麦幼苗可溶性糖含量的影响
2.4.4 可溶性蛋白含量 可溶性蛋白中含有代谢过程中的不同酶类,其含量提高有利于增强相关代谢的活性,对幼苗的生长有利。由图5可知,经多效唑浸种处理的藜麦幼苗可溶性蛋白含量与CK差异显著,其中,200 mg/L处理的可溶性蛋白含量最高,比CK增加27.69%。矮壮素浸种处理的可溶性蛋白含量均低于CK。
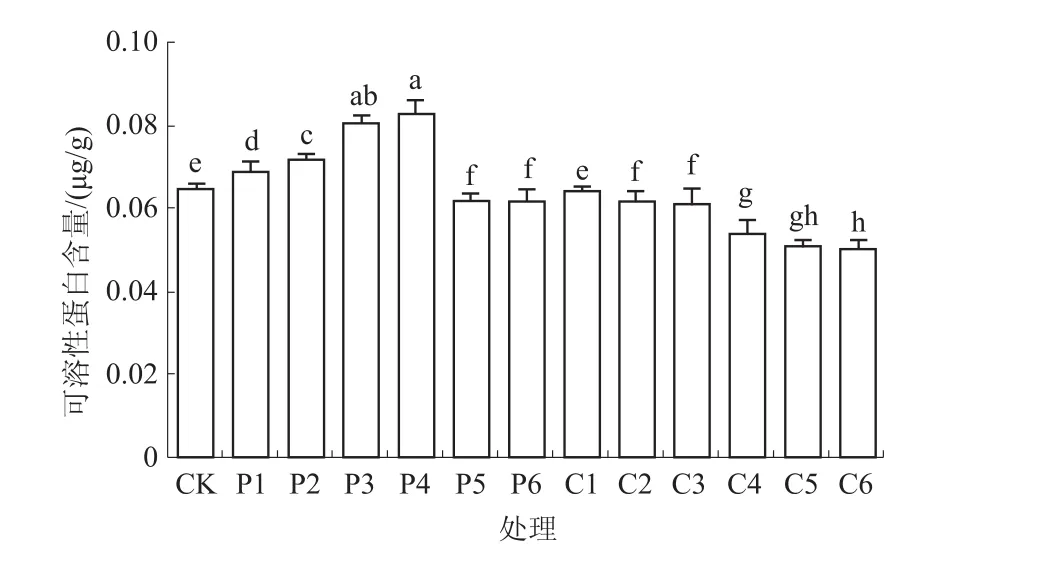
图5 不同质量浓度多效唑和矮壮素浸种对藜麦幼苗可溶性蛋白含量的影响
3 结论与讨论
多效唑和矮壮素这2种植物生长调节剂主要是通过抑制赤霉素的合成使植物体内的赤霉素含量减少[19],表现出植株变矮、茎秆变粗、叶色变绿,从而防止作物徒长倒伏。本研究结果表明,适宜浓度的多效唑和矮壮素浸种均能有效抑制藜麦幼苗地上部分的伸长生长,促进根系的生长,使植株矮化粗壮、叶面积减小,通过控上促下起到矮化壮苗、提高幼苗素质的作用,进而提高植株的抗倒伏能力,这与前人[20-25]的研究结果一致。其中,多效唑和矮壮素浸种的质量浓度分别为50~200 mg/L和500~3 000 mg/L时,藜麦幼苗的茎粗、总根长、根系总体积、根冠比随多效唑和矮壮素质量浓度的增加呈增加趋势,同时,株高和叶面积降低,叶绿素、可溶性糖和可溶性蛋白含量提高;当多效唑、矮壮素质量浓度分别高于200、3 000 mg/L时,藜麦幼苗株高过于矮化、叶片过小,出现不正常生长,这可能是由于多效唑和矮壮素质量浓度过高对植株产生了药害作用。故对藜麦进行多效唑和矮壮素浸种的最适质量浓度分别为200 mg/L和3 000 mg/L。
多效唑和矮壮素在最适质量浓度下,与CK相比,多效唑的矮化效果好于矮壮素的矮化效果,这与姚继刚等[26]的试验结果相似。不同质量浓度的多效唑和矮壮素处理均能不同程度地增加藜麦幼苗的根冠比,适宜质量浓度的多效唑处理对根冠比的增加作用更为明显。同时,在一定质量浓度范围内,多效唑和矮壮素浸种均能提高藜麦幼苗的叶片叶绿素、可溶性糖含量及根系活力,但适宜浓度的矮壮素处理效果不如多效唑明显,这与冯斗等[27]和裴玉贺等[28]的研究结论基本一致。
综上所述,200、3 000 mg/L分别为多效唑、矮壮素对藜麦进行浸种的最适质量浓度,浸种后可增加藜麦幼苗的茎粗、根系总体积、根冠比以及叶片的叶绿素、可溶性糖和可溶性蛋白含量。综合各指标,与CK相比,200 mg/L多效唑浸种处理的效果比3 000 mg/L矮壮素浸种处理效果明显,故以200 mg/L多效唑对藜麦进行浸种较好,可促进幼苗对干物质的合成和积累,有利于培育壮苗。
[1] Abugoch James L E.Quinoa(Chenopodium quinoa Willd.):Composition,chemistry,nutritional,and functional properties[J].Advances in Food & Nutrition Research,2009,58(9):1-31.
[2] White P L,Alvistur E,Dias C,et al.Nutrient content and protein quality of quinua and caihua,edible seed products ofthe Andes Mountains[J].Journalof Agricultural& Food Chemistry,1995,3(6):531-534.
[3] Navruz-Varli S,Sanlier N.Nutritional and health benefits of quinoa(Chenopodium quinoa Willd.) [J].Journal of Cereal Science,2016,69:371-376.
[4] Yang C S,Sang S,Lambert J D.Bioavailability issues in studying the health effects of plant polyphenolic compounds[J].Molecular Nutrition & Food Research,2008,52(S1):S139-S151.
[5] Hirose Y,Fujita T,Ishii T,et al.Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan[J].Food Chemistry,2010,119(4):1300-1306.
[6] Tang Y,Li X,Zhang B,et al.Characterisation of phenolics,betanins and antioxidant activities in seeds of three Chenopodium quinoa Willd.genotypes[J].Food Chemistry,2015,166:380-388.
[7] 周海涛,刘浩,杨修仕,等.藜麦在张家口地区试种的表现与评价[J].植物遗传资源学报,2014,15(1):222-227.
[8] 陆敏佳,蒋玉蓉,陈国林,等.藜麦叶片黄酮类物质的提取及基因型差异[J].浙江农林大学学报,2014,31(4):534-540.
[9] 申瑞玲,张文杰,董吉林,等.藜麦的主要营养成分、矿物元素及植物化学物质含量测定[J].郑州轻工业学院学报(自然科学版),2015,30(5/6):17-21.
[10] 王黎明,马宁,李颂,等.藜麦的营养价值及其应用前景[J].食品工业科技,2014,35(1):381-384,389.
[11] 刘瑞芳,贠超,申为民,等.不同浓度矮壮素对藜麦株高的影响[J].现代农业科技,2015(23):156,160.
[12] 普匡,许建辉,李家湖.不同浓度多效唑对烟苗生长发育的影响[J].云南农业科技,2011(4):29-31.
[13] 武荣花,李东东,张晶,等.植物生长延缓剂对盆栽月季矮化效果的研究[J].河南农业科学,2013,42(5):141-145.
[14] 周运刚,王俊刚,马天文,等.不同DPC(缩节胺)处理对棉花生理生化特性的影响[J].新疆农业科学,2010,47(6):1142-1146.
[15] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:58-60,103-104.
[16] 张志良,瞿伟菁,李小芳.植物生理学实验指导[M].北京:高等教育出版社,2009:32-33.
[17] 杨惠杰,李义珍.水稻茎秆性状与抗倒性的关系[J].福建农业学报,2000,15(2):1-7.
[18] 王勇,李晴祺,李朝恒,等.小麦品种茎秆的质量及解剖学研究[J].作物学报,1998,24(4):452-458.
[19] 柯剑鸿,李正国,杨华,等.植物生长调节剂对玉米生长特性的效应研究[J].中国农学通报,2012,28(33):40-43.
[20] 范娜,白文斌,李振海,等.4种生长调节剂对高粱矮化效果的影响[J].山西农业科学,2014,42(5):443-444,489.
[21] 郑殿峰,宋春艳.植物生长调节剂对大豆氮代谢相关生理指标以及产量和品质的影响[J].大豆科学,2011,30(1):109-112.
[22] 唐秀梅,刘超,钟瑞春,等.多效唑、缩节胺和矮壮素对花生化学调控效应的比较研究[J].南方农业学报,2011,42(6):603-605.
[23] 牛玉,戚志强,韩旭,等.矮壮素和乙烯利对樱桃番茄幼苗生长的影响[J].热带作物学报,2013,34(12):2353-2357.
[24] 曹振木,牛玉,刘子记,等.矮壮素及烯效唑对甜椒幼苗质量的影响[J].热带作物学报,2012,33(12):2156-2160.
[25] 黄小珍,秦嘉岳,李静英,等.多效唑浸种对小麦幼苗生长发育的影响[J].现代农业科技,2010(19):38,40.
[26] 姚继刚,孟庆堂,王素霞.多效唑拌种对小麦生长发育的影响[J].农技服务,2008,25(9):9,13.
[27] 冯斗,张涛,禤维言,等.3种生长延缓剂对甜高粱幼苗生长和生理特性的影响[J].热带作物学报,2009,30(10):1468-1472.
[28] 裴玉贺,郝卫艳,郭新梅,等.植物生长调节剂浸种对玉米种子萌发及幼苗生长的影响[J].湖北农业科学,2016,55(12):3009-3012,3041.
