萝卜泡菜细菌多样性的高通量测序分析
2018-03-13朱琳高凤曾椿淋俞冰倩徐琴刘轶斐李雪魏巍
朱琳,高凤,曾椿淋,俞冰倩,徐琴,刘轶斐,李雪,魏巍
(1.江苏大学食品与生物工程学院,江苏镇江 212013)(2.江苏大学农业装备工程学院,江苏镇江 212013)
泡菜是我国传统民间食品,因风味和口感独特、营养丰富等特征深受广大消费者喜爱[1]。传统的泡菜制备过程是利用蔬菜附着的微生物或添加乳酸菌进行的自然发酵过程[2]。因此,对泡菜发酵过程相关微生物的研究有助于更好地利用和发展泡菜资源。通过传统分离培养方法,一些泡菜发酵过程中的关键微生物种类得到解析,包括明串珠菌属(Leuconostoc)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、片球菌属(Pediococcus)和魏斯氏菌(Weissella)等[3~6]。这些微生物均属于乳酸菌,对泡菜中有机酸的产生至关重要,是泡菜发酵过程中优势的细菌类群。近年来新一代高通量测序技术的出现,为泡菜发酵相关微生物群落的深度研究提供了新方法[7],也因此发现在泡菜的腌制过程中除了上述乳酸菌外的其他一些非乳酸菌菌群,如假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)和拟杆菌属(Bacteroides)等[8]。这些非乳酸菌细菌在自然界氮素循环过程中,尤其是反硝化过程中(硝酸盐→亚硝酸盐→一氧化氮)发挥着重要的作用[9,10]。因此,就产生了泡菜发酵过程中的非乳酸菌细菌类群可能与泡菜中亚硝酸盐产生和降解密切相关这样一种推测,解析泡菜发酵过程中乳酸菌和非乳酸菌菌群就具有重要意义。
萝卜泡菜制作成本低廉、口感爽脆、富含维C以及锌,有助于提高食欲,促进消化,是泡菜企业生产的主要品种[11,12]。然而,萝卜泡菜发酵过程中微生物群落的演替变化以及微生物群落与亚硝酸盐形成和降解的关系并不明确。本文运用新一代基于Illumina平台的高通量测序技术,以细菌16S rDNA序列的V4可变区为靶序列,研究了萝卜泡菜发酵过程中亚硝酸盐的高峰期和回落期发酵液中细菌落结构组成,以揭示萝卜泡菜发酵过程中细菌群落的多样性,探讨细菌群落演替过程和亚硝酸浓度变化之间的关系,为深入对研究泡菜发酵过程中微生物的功能作用奠定基础。
1 材料与方法
1.1 样品制备和采集
白萝卜、食盐、花椒、辣椒、生姜和泡菜坛等购自本地农贸市场;采用传统腌制方法制备萝卜泡菜,共腌制9 d。每天使用一次性移液管在泡菜中间发酵层随机选取3个位置,吸取发酵液各2 mL,进行12000 r/min的离心处理1 min后得到发酵液上清液和菌体沉淀。上清液用来立即进行亚硝酸浓度和pH测定。而菌体沉淀用于微生物基因组DNA的提取。
1.2 亚硝酸浓度测定
首先制备亚硝酸盐的标准品溶液。精密吸取 20 μM亚硝酸钠溶液0、0.2、0.5、1.0和2.0 mL,分别置于15 mL离心管中,各加超纯水2、1.8、1.5、1.0和0 mL,制备成0、2、5、10和20 μM的亚硝酸钠标准品。取磺胺1 g和盐酸10 mL,加超纯水制成100 mL的试剂1。取N-1-氨基-乙二胺二盐酸盐0.1 g溶于100 mL水制成试剂2。取各浓度的标准品2 mL与40 μL的试剂1混合静置4 min,再加入40 μL的试剂2,混合避光静置30 min。于波长540 nm处测定亚硝酸钠标准品的吸光度,绘制亚硝酸盐的标准曲线[13]。
1.3 DNA提取
选择萝卜发酵亚硝酸盐第3 d(峰值期)和第7 d(回落期)的菌体沉淀进行微生物基因组DNA的提取。应用Mobio公司的Power Food Microbial DNA Isolation Kit进行发酵液微生物基因组DNA的提取。提取后的、对应3个位置的微生物基因组DNA进行充分混合后,应用Nanodrop one进行浓度的测定。两样品的DNA浓度分别为236 ng/μL和195 ng/μL。
1.4 PCR扩增及高通量测序
本实验采用细菌16S rRNA的V4区域作为目标DNA序列进行 PCR扩增。以通用引物 515F( 5′-GTGCCAGCMGCCGCGGTAA-3′) 和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)[14]为基础,附加Barcode序列[14]后对2个时期发酵液处理中细菌16S rRNA的 V4区域进行扩增。PCR扩增均采用Takara试剂公司的HS Taq酶进行,反应条件为95 ℃预变性 5 min;95 ℃变性 30 s,56 ℃退火 30 s,72 ℃延伸40 s,25个循环;72 ℃延伸10 min。扩增结束后,PCR扩增产物使用2%琼脂糖进行凝胶电泳检查扩增效果。最后将样品的PCR产物送至北京诺禾至源科技有限公司,在Illumina-HiSeq平台上进行高通量测序。
1.5 数据分析处理
对高通量测序初始数据进行质量控制,以获得更为精准、高质量的DNA序列信息,采用Mothur软件将得到的 16S rDNA基因序列在 RDP(ribosomal database project)数据库中进行嵌合体检验,充分去除嵌合体序列[15]。为了得到每个操作分类单元(Operational Taxonomic Unit,out)对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的操作分类单元(OTU)代表序列进行分类学分析,用Mothur软件构建稀释性曲线[16,17]。利用QIIME软件计算样品Chao1丰富度指数、Shannon多样性指数和 impson多样性指数[18]。其中群落丰富度指数,其值越高表明群落物种的丰富度越高;而多样性指数可以反映样品的多样性程度,其值越大表明样品群落多样性越高。
2 结果与分析
2.1 萝卜泡菜亚硝酸盐含量和pH的动态变化
萝卜泡菜在发酵3 d时,发酵液中亚硝酸盐浓度达到了峰值,显著高于起始浓度(p<0.05),且超过了国标(GB 2762-2005)规定的20 mg/kg。然后迅速下降,并在7 d时降落接近背景值范围。同时,pH值从第1 d起由6.5逐渐下降,第3 d时显著下降至4.8(p<0.05),并在7 d开始保持在3.8左右,显著低于起始浓度(p<0.05)。因此,萝卜泡菜发酵第3 d为亚硝酸盐浓度峰值期,第7 d为回落期,以这两个时间的发酵液进行细菌菌群的高通量测序研究。
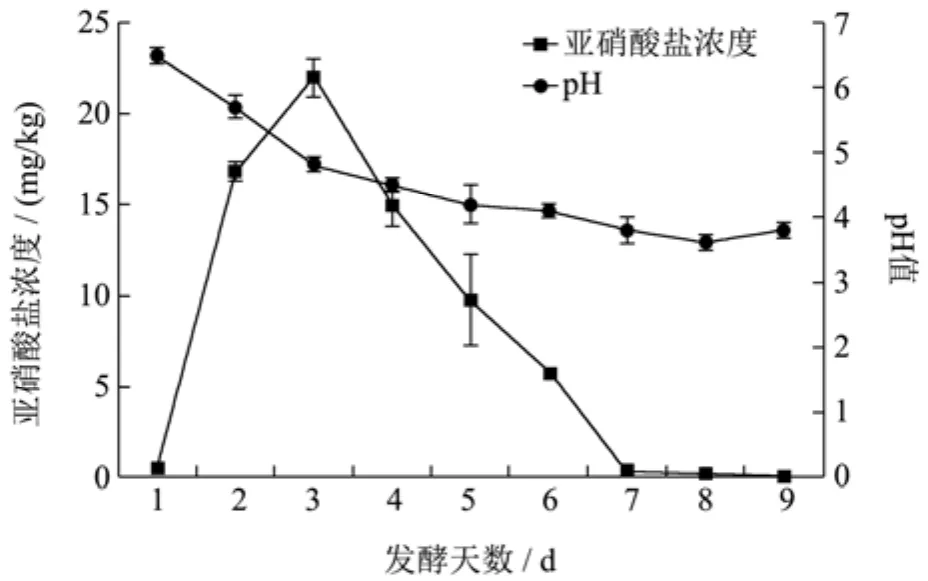
图1 萝卜发酵液中亚硝酸盐浓度和pH的动态变化Fig.1 The dynamic changes of the nitrite concentration and pH in the radish fermentation broth
2.2 细菌16S rRNA的V4区高通量测序文库检测

图2 萝卜泡菜不同发酵时期细菌群落高通量测序文库稀释曲线(a)和OTU维恩图谱(b)Fig.2 Rarefaction curve of high-throughput DNA sequencing library (a) and Venn diagram of bacterial OTU (b) during different fermentation periods of radish pickle
通过对细菌16S rRNA的V4区测序,并对原始序列经去除低质量、Barcode和引物序列后,萝卜发酵液亚硝酸盐浓度峰值期(3 d)的回落期(7 d)样品分别得到69444和66494条有效序列。去冗余后,获得的373和349个细菌OTU,分属于135和127个细菌属(表1)。
根据细菌16S rRNA的测序文库稀释性曲线(图2a),当测序量超过40000条时,两个处理虽然仍有新的 OTU被发现,但是整个曲线已经趋于平缓,说明更深的测序几乎不会产生更多的OTU,该测序文库已经达到饱和。
从图中也可以看出相同序列数时,发酵第3 d的发酵液中细菌群落OTU多于发酵第7 d,说明萝卜发酵液亚硝酸盐浓度达到峰值时的细菌群落丰富度高于已经回落期。通过比较 2个时期的 Chao1指数、Simpson指数和Shannon指数同样可以发现,发酵液亚硝酸盐浓度峰值期的细菌群落丰富度和多样性均高于回落期(表1)。

表1 高通量测序文库质量汇总Table 1 The information of high-throughput DNA sequencing library
维恩图可以直观展示两个发酵时期细菌群落的OTU组成的相似性、重叠情况以及特异性(图2b)。萝卜泡菜亚硝酸盐浓度峰值期和回落期发酵液中共有的细菌OTU数量为283(图2B)。其中17个OTU(87%)分布在两时期细菌群落Top10的优势细菌群落中。亚硝酸盐浓度峰值期发酵液中特异性细菌OTU数量为76,而亚硝酸盐浓度回落期发酵液中特异性细菌OTU数量为66,且均集中在仅占OTU总数量7%的细菌非优势类群中。这说明在经过了6 d的发酵后,细菌群落结构由多样的趋于单一,一些细菌随着亚硝酸盐浓度和pH值的变化,成长为优势的菌群,抢占了发酵液中的生态位。为了进一步明确发生变化的细菌类群,对OTUs进行了物种注释,揭示与亚硝酸盐浓度和pH值变化相关的细菌类群。
2.3 萝卜泡菜亚硝酸盐含量不同时期优势细菌群落组成

图3 萝卜泡菜不同发酵时期在门(a)和属(b)分类水平的细菌群落结构TOP10构成Fig.3 The TOP10 phylum (a) and genus (b) of bacterial community in two fermentation periods of radish pickle
萝卜泡菜亚硝酸盐峰值期(3 d)和回落期(7 d)时,发酵液细菌群落在门分类水平上的分布比例见图3a。两个时期细菌群落结构组成情况相似,但各细菌类群所占比例有较大差异。两个时期细菌群落在门水平上具有相同的TOP10构成。其中,亚硝酸盐浓度峰值期时所占比例大于细菌总数1.0%的门包括:变形菌门(Proteobacteria,72.1%)占主要优势,之后是厚壁菌门(Firmicutes,18.9%)和拟杆菌门(Bacteroidetes,4.5%)。亚硝酸盐浓度回落期时所占比例大于细菌总数 1.0%的门包括:最优势的厚壁菌门(Firmicutes,84.0%),之后是变形菌门(Proteobacteria,10.5%)和拟杆菌门(Bacteroidetes,2.7%)。
萝卜泡菜亚硝酸盐峰值期(3 d)和回落期(7 d)时,发酵液细菌群落在属分类水平上的分布比例见图3b。两个发酵时期细菌群落结构组成情况相似,但各细菌类群所占比例有较大差异。在亚硝酸盐浓度峰值期时占优势的细菌属分别为欧文氏菌属(Erwinia,45.0%)、乳酸菌属(Lactococcusc,10.5%)、气单孢菌属(Aeromonas,7.4%)、假单胞菌属(Pseudomonas,6.6%)、志贺氏菌属(Escherichia-Shigella,6.0%)、代尔夫特菌属(Delftia,5.1%)、金黄杆菌属(Chryseobacterium,4.4%)、魏斯氏菌属(Weissella,4.3%)、明串珠菌属(Leuconostoc,2.2%)和片球菌属(Pediococcus,1.7%)。在亚硝酸盐浓度回落期,明串珠菌属(Leuconostoc,27.5%)、乳球菌属(Lactococcus,19.9%)、魏斯氏菌属(Weissella,19.2%)和片球菌属(Pediococcus,16.3%)等 4属乳酸菌为优势细菌属,之后依次为欧文氏菌属(Erwinia,1.7%)、金黄杆菌属(Chryseobacterium,0.9%)、代尔夫特菌属(Delftia,0.9%)、气单孢菌属(Aeromonas,0.7%)、志贺氏菌属(Escherichia-Shigella,0.6%)和假单胞菌属(Pseudomonas,0.2%)。
2.4 萝卜泡菜发酵液中优势细菌的系统发育

图4 萝卜泡菜两个发酵时期TOP10细菌菌属OTU序列的系统发育进化Fig.4 The phylogeny of the OTU sequence from TOP10 bacterial genus in two periods of radish pickle
选取相对丰度TOP10的属所对应的OTUs数据进行多序列比对,并结合物种注释置信度信息进行整合并绘制了系统发育进化图(图4)。第一层分支的颜色表示分别对应 TOP10属名;第二层柱形的高度表示OTUs的相对丰度大小;第三层柱形的高度表示OTUs注释的可信度。萝卜泡菜发酵过程中相对丰度TOP10的细菌菌属所有OTUs的物种注释均具有较高的置信度。其中,气单孢菌属(Aeromonas)、假单胞菌属(Pseudomonas)和明串珠菌属(Leuconostoc)发生了系统分化,具有2或3个不同的OTU序列。而属于乳酸菌的乳酸菌属(Lactococcus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)以及其他的4个细菌菌属的 OTU序列没有发生分化。说明在萝卜泡菜发酵过程中,优势细菌属没有随着亚硝酸盐浓度和pH的变化而发生系统发育进化。
3 讨论
自上个世纪80年代起,泡菜的微生物发酵过程一直受到国内外研究者的关注[3,19]。已有研究结果表明,泡菜中亚硝酸盐的降解可分为酶降解和酸降解,即微生物亚硝酸还原酶主导的酶降解和微生物发酵过程产生有机酸引起的酸降解[19]。张庆芳等(2002)在MRS液体培养基中添加亚硝酸盐后接种乳酸菌模拟发酵过程,并测定发酵液pH和亚硝酸盐含量,结果表明发酵液 pH>4.5时,亚硝酸盐的降解主要以乳酸菌本身酶降解为主。当 pH<4.0时,亚硝酸盐的降解以酸降解为主,且pH低于3.5下时,亚硝酸盐降解明显。因此,在泡菜发酵过程中,pH值与微生物引发的酶降解和酸降解密切相关,且4.0可能是酶降解和酸降解的分界点[20]。本研究中,发酵第3 d至发酵第7 d的pH值从4.8降低至3.8,该阶段萝卜泡菜发酵液中亚硝酸盐的降解可能以酶降解为主;而第7 d开始,pH一直保持在4.0以下,该阶段萝卜泡菜发酵液中亚硝酸盐的降解可能以酸降解为主。
微生物主导的亚硝酸盐酶降解过程,是指亚硝酸盐在微生物亚硝酸盐还原酶(Nir)的作用下,被还原为一氧化氮(NO),该还原过程是微生物主导的氮素反硝化过程的关键步骤。编码亚硝酸盐还原酶的基因为以铜离子为酶活性位点的 nirK基因和以铁离子为酶活位点的nirS基因[21]。尽管很多报道指出泡菜发酵过程中乳酸菌可以降解亚硝酸盐,如植物乳杆菌、乳链球菌、干酪乳杆菌、赖氏乳杆菌、嗜热乳链球菌和戊糖片球菌等[22~24]。然而,通过对NCBI、KEGG和Fungene三个数据库中记录的细菌全基因组进行筛查,发并没有发现目前上述乳酸菌菌株具有编码亚硝酸盐还原酶的nirK和nirS基因,而非乳酸菌细菌,如Pseudomonas属和 Aeromonas属则已经明确了具有nirK基因。因此,在没有得到乳酸菌属细菌具有编码亚硝酸盐还原酶的nirK和nirS基因的可靠证据前,萝卜泡菜中进行亚硝酸盐酶降解的细菌类群更应被认为广泛分布在非乳酸菌类群中。然而,这一认识还需对相关菌株分离并定性研究后才能定论。
微生物主导的亚硝酸盐酸降解过程,是指泡菜发酵过程中乳酸菌产生的有机酸使发酵液的pH迅速降低,而低pH值导致亚硝酸盐的降解。亚硝酸盐在酸性条件下,反应生成不稳定的HNO2,而HNO2则经过不稳定的N2O3,继续分解为NO2和NO[25]。所以溶液的pH值越低,亚硝酸盐的降解量越大。因此,本研究中发酵第7 d的pH为3.8,此时亚硝酸盐降解过程很可能以酸降解为主,这与第7 d时占绝对优势的明串珠菌属、乳球菌属、魏斯氏菌属和片球菌属4种乳酸菌直接相关。这4种乳酸菌产生的大量有机酸可能促使亚硝酸盐被完全降解,或者是使其降解速率远大于生成速率,导致亚硝酸盐产生完全被压制。
关于泡菜亚硝酸盐的研究以前集中在降解过程,对亚硝酸盐产生机制的解析有助于提高降解速率。亚硝酸盐是微生物主导的氮素循环过程中重要的中间产物之一,产生过程包括微生物的反硝化作用(硝酸盐还原成亚硝酸盐)和硝化作用(铵盐氧化成亚硝酸盐)等。本研究在萝卜泡菜发酵液中没有检测到氨氧化细菌和古菌,因此我们认为微生物反硝化作用是萝卜泡菜中亚硝酸盐产生和积累的原因。不同种类蔬菜的硝酸盐含量不同,根菜类>绿叶菜类>白菜类>豆类。萝卜作为肉质根菜类蔬菜,体内具有大量的硝酸盐[26],为微生物反硝化作用提供了充足的底物。已有报道指出微生物具有两种蛋白酶NarG和NapA,可以将硝酸盐还原成亚硝酸盐[27]。具有编码两种蛋白酶的 narG和 napA基因可以作为判断其具有硝酸盐还原能力的依据。因此,根据fungene数据库最新的全基因组序列进行分析,萝卜泡菜在发酵第3 d时出现的优势性的变形菌门细菌Erwinia属具有narG,Shigella属具有napA,Aeromonas和Pseudomonas属同时具有napA和narG。因此,萝卜泡菜发酵液中优势性的变形菌门细菌通过具有的蛋白酶NarG和NapA,通过反硝化作用将发酵液中的硝酸盐还原成亚硝酸盐,造成发酵液中亚硝酸盐浓度的增加,从而导致萝卜泡菜在第 3 d亚硝酸盐浓度达到峰值。因此,如果对这些非乳酸菌细菌类群加以控制,很可能会从根本上抑制泡菜亚硝酸盐的产生。
4 结论
通过对萝卜泡菜发酵液中随亚硝酸盐浓度和 pH值变化而演替的细菌菌群结构的解析结果表明,变形菌门的部分细菌类群可能在萝卜泡菜发酵液中亚硝酸盐浓度产生和累积过程、以及亚硝酸盐酶降解过程中发挥重要的作用。而厚壁菌门的乳酸菌类群及其产生的低pH值,可能在亚硝酸盐酸降解过程中起关键性作用。
[1]陈功.试论中国泡菜历史与发展[J].食品与发酵科技,2010,46(3):1-5 CHEN Gong. The history and development of Chinese pickles [J]. Food and Fermentation Technology, 2010, 46(3):1-5
[2]李书华,蒲彪,陈封政.泡菜的功能及防腐研究进展[J].中国酿造,2005,24(4):6-8 LI Shu-hua, PU Biao, CHEN Feng-zheng. Research process of function and self-life of pickles [J]. China Brewing, 2005,24(4): 6-8
[3]郭晓红,杨洁彬,张建军.甘蓝乳酸发酵过程中亚硝峰消长机制及抑制途径的研究[J].食品与发酵工业,1989,1(2):29-38 GUO Xiao-hong YANG Jie-bin, ZHANG Jian-jun.Dynamies and inhibition of nitrite-peak during the lacttic acid fermentation of cabbage [J]. Food and Fermentation Industries, 1989, 1(2): 29-38
[4]巨晓英,韩烨,周志江.自然发酵泡菜中乳酸菌的分离鉴定[J].食品与机械,2008,24(5):29-31 JU Xiao-ying, HAN Ye, ZHOU Zhi-jiang. Isolation and identification of lactic acid bacteria from natural fermentation pickles [J]. Food & Machinery, 2008, 24(5): 29-31
[5]李文斌,唐中伟,宋敏丽,等.农家泡菜发酵液中乳酸菌的研究[[J].食品工程,2009,3:38-40 LI Wen-bin, TANG Zhong-wei, SONG Min-li, et al.Research of lactobacillus inzymotic fluid of farmerhouse style pickled vegetable [J]. Food Engineering, 2009, 3: 38-40
[6]金红星,杨希寅,成文玉.辣白菜中分离含内源性质粒的魏斯氏菌及其鉴定[J].中国酿造,2012,31(1):77-79 JIN Hong-xing, YANG Xi-yin, CHENG Wen-yu. Isolation and identification of Weissella containing endogenous plasmids from kimchi [J]. China Brewing, 2012, 31(1): 77-79
[7]佟婷婷,田丰伟,王刚,等.基于宏基因组分析四川泡菜母水作引子的泡菜发酵过程中细菌多样性变化[J].食品工业科技,2015,36(21):173-177 TONG Ting-ting, TIAN Feng-wei, WANG Gang, et al.Metagenomic analysis of bacterial diversity changes during vegetables fermentation using Sichuan pickle water as starter[J]. Science and Technology of Food Industry, 2015, 36(21):173-177
[8]李欣蔚,丛敏,武俊瑞,等.基于16SrRNA基因V3-V4区高通量测序分析东北自然发酵酸菜中细菌群落结构[J].现代食品科技,2017,33(2):69-75 LI Xin-wei, CONG Min, WU Jun-rui, et al. Analysis of the bacterial community structure in naturally fermented cabbage of northeast china by high-throughput sequencing [J].Modern Food Science and Technology, 2017, 33(2): 69-75
[9]Almeida J S, Reis M A, Carrondo M J. Competition between nitrate and nitrite reduction in denitrification byPseudomonas fluorescens [J]. Biotechnology Bioengineerin, 1995, 46(5):476-84
[10]Hrenović J, Orhan Y, Büyükgüngör H, et al. Influence of ammonium, nitrate and nitrite on the performance of the pure culture of Acinetobacter junii [J]. Biologia, 2007, 62(5): 517-522
[11]乐毅,刘学文.白萝卜泡菜的保脆工艺研究[J].食品与发酵科技,2011,47(2):79-81 YUE Yi, LIU Xue-wen. Research on methods of preserving scrip for white radish pickle [J]. Food and Fermentation Technology, 2011, 47(2): 79-81
[12]刘春燕,夏姣,徐林,等.红皮萝卜泡菜自然发酵过程中乳酸菌的动态变化[J].食品工业科技,2015,36(18):176-181 LIU Chun-yan, XIA Jiao, XU Lin, et al. Dynamic changes of lactic acid bacteria flora during the fermentation of red radish pickle [J]. Science and Technology of Food Industry, 2015,36(18): 176-181
[13]Woolley J T, Hicks G P, Hageman R H. Rapid determination of nitrate and nitrite in plant material [J]. Journal of Agricultural & Food Chemistry, 1960, 8(6): 481-482
[14]Caporaso J G, Lauber C L, Walters W A, et al.Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms [J]. The ISME Journal,2012, 6(8): 1621
[15]Cheung M K, Au C H, Chu K H, et al. Composition and genetic diversity of picoeukaryotes in subtropical coastal waters as revealed by 454 pyrosequencing [J]. The ISME Journal, 2010, 4(8): 1053
[16]Haas B J, Gevers D, Earl A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons [J]. Genome Research,2011, 21(3): 494
[17]Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013, 10(10):996
[18]Chao A. Estimating the population size for capture-recapture data with unequal catchability [J]. Biometrics, 1987, 43(4):783
[19]Dodds K L, Collinsthompson D L. Incidence of nitrite-depleting lactic acid bacteria in cured meats and in meat starter cultures [J]. Journal of Food Protection, 1984:7-10
[20]Wei W, Isobe K, Nishizawa T, et al. Higher diversity and abundance of denitrifying microorganisms in environments than considered previously [J]. Isme Journal, 2015, 9(9):1954
[21]张庆芳,迟乃玉,郑燕,等.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002,28(8):27-31 ZHANG Qing-fang, CHI Nai-yu, ZHENG Yan, et al. The study on mechanism of nitrite degradation by lactic acid bacteria [J]. Food and Fermentation Industries, 2002, 28(8):27-31
[22]吕兵,张国农,杨瑞欢.嗜酸乳杆菌生物学特性及其发酵乳的研究[J].中国乳品工业,2002,30(5):37-39 LV Bing, ZHANG Guo-nong, YANG Rui-huan. Study on the biological properties of Lactobacillus acidophilus and its fermented milk [J]. China Dairy Industry, 2002, 30(5): 37-39
[23]蒋欣茵,李晓晖,张伯生,等.腌制食品中降解亚硝酸盐的乳酸菌分离与鉴定[J].中国酿造,2008,27(1):13-16 JIANG Xin-yin, LI Xiao-hui, ZHANG Bo-sheng, et al.Isolation and identification of nitrite-degrading lactic acid bacteria from traditional pickled vegetable [J]. China Brewing, 2008, 27(1): 13-16
[24]张雪梅,曾顺德,唐偲雨,等.不同乳酸菌株对萝卜泡菜中亚硝酸盐降解能力的研究[J].西南农业学报,2014,27(1):450-452 ZHANG Xue-mei, ZENG Shun-de, TANG Si-yu, et al. Study on capability of degradation nitrite of different lactic acid bacteria strains in pickling radish [J]. Southwest China Journal of Agricultural Sciences, 2014, 27(1): 450-452
[25]刘晓英.泡菜中有机酸对亚硝酸盐降解作用及机理的初步研究[D].泰安:山东农业大学,2013 LIU Xiao-ying. Research on nitrite degradation by organic acids in pickled fermentation [D]. Tai’an: Shandong Agricultural University, 2013
[26]黄建国,袁玲.重庆市蔬菜硝酸盐,亚硝酸盐含量及其与环境的关系[J].生态学报,1996,16(4):383-388 HUANG Jian-guo, YUAN Ling. Contents of nitrate and nitrite in vegetables and their relations to the environmental factors in Chongqing area [J]. Acta Ecologica Sinica, 1996,16(4): 383-388
[27]Smith C J, Nedwell D B, Dong L F, et al. Diversity and abundance of nitrate reductase genes (narG and napA), nitrite reductase genes (nirS and nrfA), and their transcripts in estuarine sediments [J]. Applied & Environmental Microbiology, 2007, 73(11): 3612-3622
