拮抗酵母对西兰花黑斑病及品质的影响
2018-03-13余巧银郭红莲邢紫娟乔博鑫
余巧银,郭红莲,邢紫娟,乔博鑫
(天津科技大学新农村发展研究院,食品工程与生物技术学院,天津 300457)
西兰花(Brassica oleacea)营养丰富,富含叶绿素和多种维生素及矿物质,是国际市场上具有极高市场价值的蔬菜品种,也是我国主要出口蔬菜之一[1]。西兰花食用部位主要为绿色花球,富含多种营养及功能成分,具有抗氧化,增强人体免疫能力,有效预防和抵御肿瘤[2]西兰花采后呼吸代谢十分旺盛,在贮运中易受机械损害及病菌侵染,严重影响西兰花的外观及内在品质[3]。市场上销售的西兰花会遭受多种采后病害的侵袭,在所有的病害中,花球表面的黑斑病是其最常见的采后病害,发病率高,传播快[4]。该病害在贮藏期大量发生,可造成严重的经济损失。
酵母菌具有较强的抗逆能力,在生物防治过程中能够迅速的适应果蔬表面干燥恶劣的生存环境,在表面定殖并快速的生长繁殖[5],近年来国内外开展了许多关于果实采后病害生物防治的研究,拮抗酵母菌保鲜技术被认为是一种无公害的生物保鲜技术,其具有对病原菌拮抗效果好、不产生毒素、繁殖能力强等优点[6]。拮抗酵母菌在草莓、柑橘、枣类、番茄和苹果等果蔬上的应用有相关的研究[7~10],如黏红酵母(Rhodotorula glutinis)、柠檬形克勒克酵母(Kloechera apiculata)、罗伦隐球酵母(Cryptococcus laurentii)、汉逊德巴利酵母(Debaryomyces hansenii)等对一些果蔬采后病害均有抑制效果。
本试验通过测定拮抗酵母在西兰花上的生长动态,不同浓度拮抗酵母对病原菌菌落扩展、孢子萌发、芽管生长的影响,以及该拮抗酵母对西兰花生理品质和黑斑病的影响进行分析研究,以期为西兰花在生物防治方向提供基础和依据。
1 材料与方法
1.1 材料与试剂
材料:试验用西兰花购买于天津经济技术开发区农贸市场,无菌水洗涤、沥干,低温4 ℃保存。
菌株:拮抗酵母菌(P.membranaefaciens)、甘蓝交链孢霉菌(Alternaia brassicicola)均由本实验室分离鉴定保存。
培养基:参照文献[11]配制PDA培养基、PDB培养基、YEPD培养基。
分析纯试剂:碳酸钙、石英砂、无水乙醇、抗坏血酸、草酸、碳酸氢钠、2,6-二氯靛酚、氯化钠、蒽酮、浓硫酸、愈创木酚、过氧化氢、磷酸氢二钠、磷酸二氢钠、三氯乙酸、邻苯二酚均购买于天津市化学试剂厂。
生化试剂:蛋白胨、酵母膏、无水葡萄糖、琼脂粉,均购买于北京奥博星化物技术责任有限公司。
1.2 仪器设备
立式圧力蒸气灭菌锅(上海博讯实业有限公司医疗设备厂)、YS1000型生物显微镜(日本NiKOH公司)、PL203型电子天平(梅特勒-托多仪器(上海)有限公司)、DK-98-1型电热恒温水浴锅(天津市泰斯特仪器有限公司)、TU-1810紫外分光光度计(北京普析通用仪器有限责任公司)、ZHJH-CII09B超净操作台(上海智城分析仪器制造有限公司)。
1.3 试验方法
酵母菌悬液的配制:取一环活化后的酵母于 100 mL YEPD液体培养基中,28 ℃恒温振荡培养24 h后,取培养液经4000 r/min离心10 min,去掉上清液,用等体积的无菌生理盐水悬浮后,再4000 r/min离心10 min,再去掉上清液,加入无菌蒸馏水,用血球计数板计数,确定浓度。并用无菌蒸馏水将其调整到试验所需浓度。
病原菌孢子悬浮液的配制:将病原菌接种在PDA培养基上28 ℃下恒温培养7 d后,刮下孢子并悬浮在无菌蒸馏水中,采用血球计数板确定病原菌孢子的浓度,并用无菌蒸馏水将其调整到试验所需浓度[11]。
1.3.1 不同浓度拮抗酵母对病原菌生长的影响
将配制的109、108、107、106CFU/mL不同浓度的酵母菌悬浮液2 mL与高压灭过菌的18 mL PDA培养基混匀后倒平板,使得培养基内的酵母菌悬液终浓度为108、107、106、105CFU/mL,在培养7 d的病原菌菌落边缘取直径为5 mm的菌饼(尽量保证在同一生长期),反接入冷却后的培养基中央,以加入无菌水的PDA平板为对照,上述各处理均置于25 ℃恒温恒湿培养箱中培养。从平板背面采用十字交叉法测量病原菌的菌落直径,计算抑菌率。每组处理重复3次。

1.3.2 不同浓度拮抗酵母对病原菌孢子萌发率和芽管长度的影响
分别取108、107、106、105CFU/mL拮抗酵母菌悬浮液和对照无菌水(CK)100 μL,加入装有5 mL PDB的50 mL三角瓶中,再分别加入100 μL,106CFU/mL病原菌孢子悬浮液。将三角瓶放于25 ℃,70 r/min的摇床培养箱内振荡摇动,12 h和24 h后用显微镜观察统计病原菌孢子的萌发率和芽管长度,每处理各重复随机观察3个以上视野,调查孢子总数不少于200个,每个处理重复3次,整个实验重复三次,分别记录萌发数和萌发孢子的芽管长度,孢子芽管长度大于孢子的短半径视为萌发[12]。
1.3.3 拮抗酵母菌在西兰花上的生长动态
将西兰花用 75%酒精浸泡 1 min之后自来水洗净,晾干备用。接种105CFU/mL拮抗酵母菌悬液于伤口处,2 h后接种106CFU/mL病原菌孢子悬浮液或无菌水作为对照。将其装入盘子内,外套保鲜膜以保持95%左右的相对湿度,于25 ℃下贮存,以1 h后测定的拮抗酵母菌数作为起始值(0 h),每隔24 h测定一次,共测定8次7 d内拮抗酵母菌在西兰花上的生长动态[13]。
测定方法:将西兰花花朵放入已加10 mL无菌生理盐水(0.9% NaCl)的灭菌研体中研磨。用稀释平板法计数,测定西兰花上的酵母菌数量,每组处理3个花朵,整个试验重复三次。将所得的拮抗酵母菌数转化为lg对数进行分析。
1.3.4 不同浓度拮抗酵母对西兰花黑斑病的防治作用
将西兰花花朵用75%酒精浸泡1 min之后自来水洗净,晾干备用。用灭过菌的镊子尖剪掉花蕊使其呈现直径约5 mm的圆形面积,分别在伤口上接种105、106、107、108CFU/mL浓度的拮抗酵母菌悬液,以无菌水为对照。1 h后,再接种106CFU/mL的病原菌孢子悬浮液,晾干后将其装入无菌的盘子中,外套一塑料袋以保持95%左右的相对湿度,于室温(25 ℃)下贮存,7 d后观察并记录西兰花的腐烂情况,测定花朵的病斑直径和发病率。每种浓度的处理组用10个西兰花伤口,每个处理做3次平行,整个试验重复三次[14]。
1.3.5 不同浓度拮抗酵母对西兰花生理品质的影响
将西兰花花朵用75%酒精浸泡1 min之后用自来水洗净,晾干。用105、106、107、108CFU/mL浓度的酵母菌悬液喷洒在西兰花上,无菌水为对照,用保鲜膜包起来,保持95%左右的相对湿度,放置0~4 ℃贮藏,以1 h后测定的各项生理指标作为起始值(0 h),每隔24 h测定一次,共测定6次5 d内生理指标的变化情况。
1.3.5.1 叶绿素含量测定
参照史君彦的方法[15]测定。
1.3.5.2 Vc含量测定
参照刘艳芳[16]的方法,采用2,6-二氯靛酚滴定法。
1.3.5.3 可溶性糖含量测定
参照李晓旭[17]的方法,采用蒽酮法。
1.3.5.4 多酚氧化酶PPO活性测定
采用邻苯二酚法[18]。
1.3.5.5 过氧化物酶POD活性测定
采用愈创木酚法[18]。
1.3.6 数据处理与分析
试验数据采用 Excel 2010软件进行统计,并用SPSS(23.0)软件进行ANOVA邓肯差异分析(p<0.05)。
2 结果与讨论
2.1 不同浓度拮抗酵母对病原菌生长的影响

图1 不同浓度酵母菌悬液对病原菌的抑制效果Fig.1 The effects of different concentrations of yeast suspension on the pathogenic bacteria

图2 不同浓度酵母菌悬液的抑制率Fig.2 The inhibition rate of different concentrations of yeast suspension
从图1观察病原菌生长状态发现,空白对照组平板上的病原菌以非常迅速的态势生长蔓延,培养至7 d时已经布满整个平板。而经过不同浓度酵母菌悬液处理的病原菌菌落直径变化不大至培养后期基本保持不变。且随着酵母菌悬液浓度的升高,病原菌的菌落直径呈依次递减的趋势。
从图2可知不同浓度的酵母菌悬液对病原菌的生长均具有抑制作用,且浓度越高对病原菌的生长抑制率越高,且在整个培养过程中,各处理组抑制率均呈现上升状态。108CFU/mL酵母菌悬液在第7 d的抑制率高达 87.9%,显著高于 105、106CFU/mL处理组(p<0.05)。
高浓度的拮抗酵母接入培养基后,迅速利用培养基中的营养成分定殖、扩增,占据大量生长空间,从而阻碍病原菌的生长繁殖。与Filnow[19]研究报道,酵母菌利用糖类的速度比病原菌快,这一现象相符。
2.2 不同浓度拮抗酵母对病原菌孢子萌发和芽管长度的影响
从表1中能看出空白对照24 h后的萌发率和芽管长度分别为90.00%和65.20 μm,在用拮抗酵母处理的情况下,低浓度酵母溶液(1×105CFU/mL),24 h后病原菌孢子的萌发率为47.82%,芽管长度为46.90 μm,显著低于对照组(p<0.05),但是跟高浓度酵母溶液(1×108CFU/mL)的8.13%萌发率和10.40 μm芽管长度相比,抑制效果明显不够。结果表明,12 h和24 h后,不同浓度的拮抗酵母均对病原菌孢子萌发和芽管生长产生了显著的抑制作用(p<0.05),其中1×108CFU/mL浓度效果最佳,对病原菌孢子24 h后的萌发和芽管生长抑制率高达90.97%和84.05%。
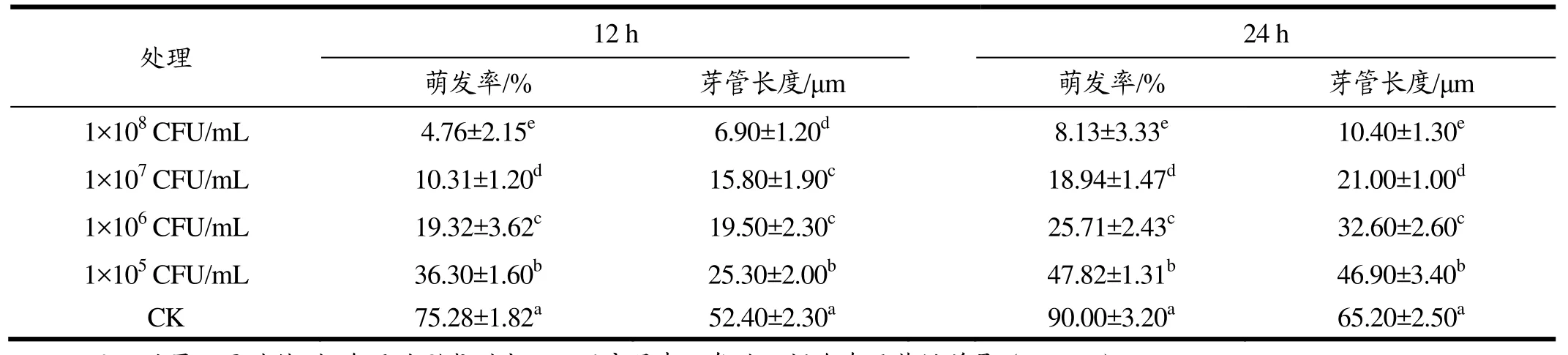
表1 不同浓度酵母菌悬液对病原菌孢子萌发的影响Table 1 Different concentration of yeast suspension have effect on spore germination of pathogenic bacteria
2.3 拮抗酵母菌在西兰花伤口上的生长动态
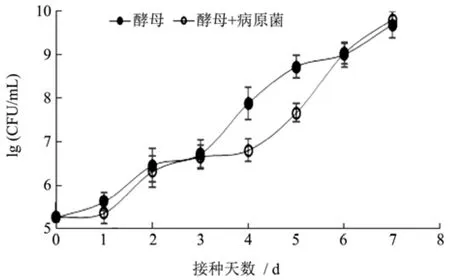
图3 105 CFU/mL酵母菌在西兰花上的生长动态Fig.3 The growth dynamics of 105 CFU/mL yeasts changes in broccoli
拮抗菌能否在水果或者蔬菜上快速生长繁殖,是其能否抑制病原菌的基础条件。从图3中可以看出,105CFU/mL拮抗酵母菌无论是单独存在还是和病原菌同时存在,都能在西兰花伤口处快速繁殖。拮抗酵母通过与病原菌竞争果实表面的营养物质及侵染位点,短时间内利用和消耗伤口营养物质,从而降低果蔬表面病原真菌数量,抑制病害的发生[20]。因此 105CFU/mL酵母菌菌悬液能够用于西兰花的采后生物防治。
2.4 不同浓度拮抗酵母对西兰花黑斑病的防治效果
从表2能看出,随着拮抗酵母菌悬液浓度的增加,西兰花病斑直径和发病率随之减小;这四种浓度拮抗酵母菌悬液处理的西兰花病斑直径和发病率与对照组相比,均显著小于对照组(p<0.05);特别是在浓度为1.3×108CFU/mL时西兰花的病斑直径和发病率最小,仅为4.70 mm和21.27%,与其它浓度处理组相比,均具有显著性差异(p<0.05)。说明该酵母菌在西兰花上能够明显抑制病原菌的生长,减轻病害发生的程度,具有显著的生防作用(p<0.05),1.3×108CFU/mL抑制效果最佳。
因此,高浓度拮抗酵母(108CFU/mL)菌悬液能降低西兰花的病斑直径和发病率,具有显著的生防效果(p<0.05)。
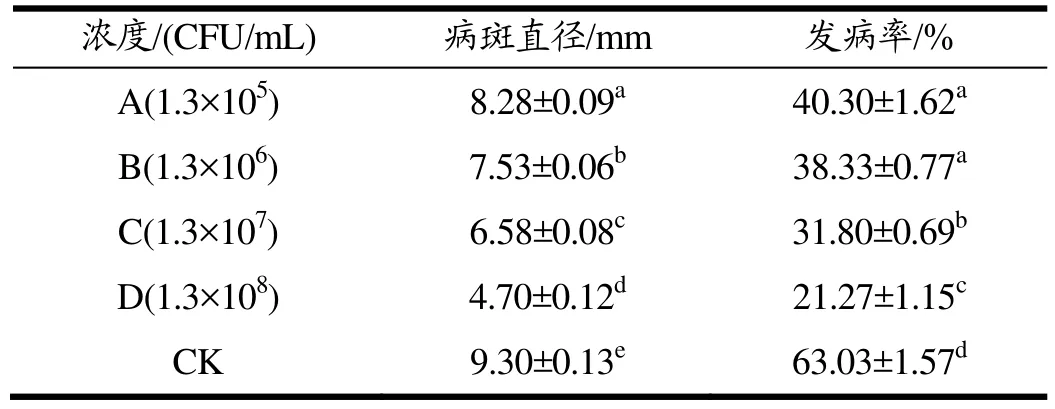
表2 不同浓度酵母菌悬液对西兰花病斑直径和发病率的影响Table 2 Different concentration of yeast suspension have effect on broccoli lesion diameter and disease incidence
2.5 不同浓度拮抗酵母对西兰花生理品质的影响
2.5.1 对西兰花叶绿素含量的影响
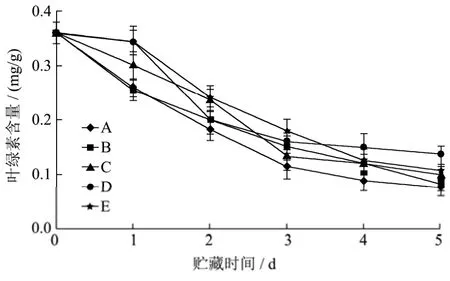
图4 不同浓度酵母菌悬液对西兰花叶绿素的影响Fig.4 Effects of different concentrations of yeast suspension on chlorophyll content in broccoli
叶绿素是西兰花呈现绿色的主要物质,保持较高的叶绿素含量,能延缓西兰花衰老,延长其贮藏期[21]由图4可知贮藏期间,各组变化趋势相似。贮藏至第5 d时,2.7×107CFU/mL和2.7×108CFU/mL处理组的叶绿素含量分别为0.13 mg/g和0.11 mg/g,二者与对照组(0.07 mg/g)相比分别降低了85.71%和57.14%,呈显著性差异(p<0.05)。表明拮抗酵母处理能延缓了西兰花叶绿素的分解速率,在一定程度上保持西兰花固有的鲜绿色泽。其中 2.7×107CFU/mL和 2.7×108CFU/mL浓度的拮抗酵母菌悬液对于西兰花的叶绿素的保持度较好。
2.5.2 对西兰花维生素C含量的影响

图5 不同浓度酵母菌悬液对西兰花Vc的影响Fig.5 Effects of different concentrations of yeast suspension on Vc in broccoli
Vc是果蔬重要的营养成分,其含量的变化可作为评价果蔬贮藏品质的一个指标[22]。由图5可知,西兰花Vc含量在第1 d都有所上升,但之后随贮藏时间的延长逐渐下降,对照组下降趋势更明显。在贮藏 1 d后中,各处理组Vc含量基本上都高于对照组,2.7×108CFU/mL拮抗酵母处理组下降趋势最缓慢。贮藏至第5 d,2.7×108CFU/mL处理组Vc含量为16.11 mg/100 g,是对照组(10.29 mg/100 g)的1.56倍,呈显著性差异(p<0.05)。
其它处理组分别为10.83 mg/100 g、10.36 mg/100 g、11.56 mg/100 g,含量略高于对照组,差异不显著(p>0.05)。不同浓度拮抗酵母处理可延缓西兰花 Vc的降解速度,保持西兰花的营养品质。其中 2.7×108CFU/mL浓度的拮抗酵母菌悬液对于西兰花的Vc的降解速率有显著缓解效果(p<0.05)。
2.5.3 对西兰花可溶性糖含量的影响
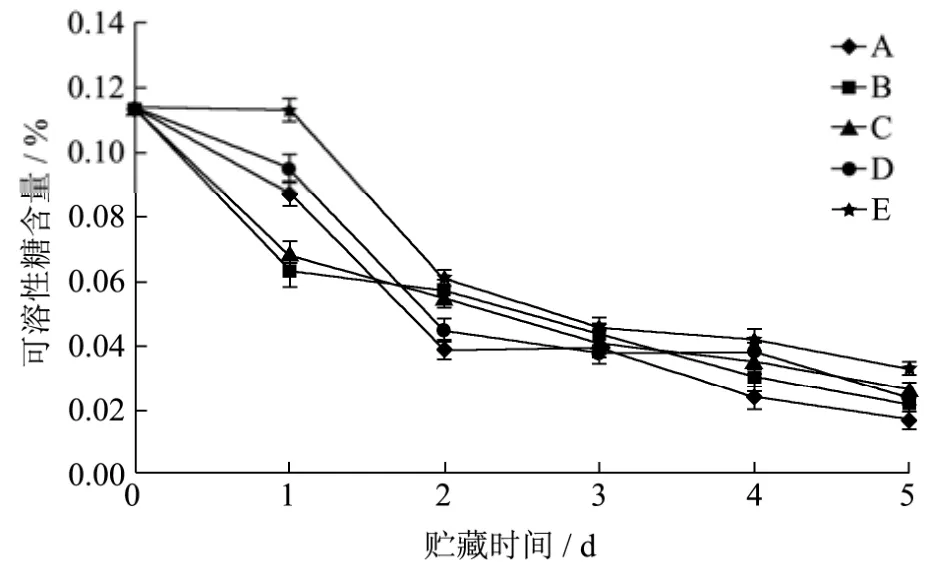
图6 不同浓度酵母菌悬液对西兰花可溶性糖含量的影响Fig.6 Effects of different concentrations of yeast suspension on soluble sugar content in broccoli
由图6可知,贮藏期间各组的可溶性总糖含量均减少,前3 d迅速降低,后又缓慢下降,贮藏第2 d时,对照组骤然下降至最低,由初始含量 0.11%降到0.04%,此时拮抗酵母对西兰花的保鲜作用开始显现,贮藏后期(4~5 d),处理组可溶性总糖含量显著小于对照组(p<0.05)。尤其是2.7×108CFU/mL处理组西兰花的可溶性糖含量在整个变化过程中基本上高于其它组。贮藏至第5 d,2.7×108CFU/mL处理组的可溶性糖含量是对照组的 1.94倍,差异显著(p<0.05),具有很好的保鲜效果。
2.5.4 对西兰花多酚氧化酶(PPO)活性的影响

图7 不同浓度酵母菌悬液对西兰花PPO的影响Fig.7 Effects of different concentrations of yeast suspension on PPO in broccoli
PPO是引起果蔬酶促褐变的主要酶类,PPO催化果蔬原料中的内源性多酚物质氧化生成黑色素,严重影响制品的营养,风味及外观品质[23]。PPO活性往往在果蔬趋向衰老时升高,常被用作反映果蔬衰老的指标之一。由图7可以看出,在西兰花贮藏过程中PPO活性均随贮藏时间的延长而呈上升趋势,对照组PPO活性水平高于其它处理组。贮藏第 5 d,2.7×106CFU/mL、2.7×107CFU/mL、2.7×108CFU/mL处理组均显著低于对照组(p<0.05),其中 2.7×108CFU/mL处理组PPO活性最低。因此,拮抗酵母菌悬液能有效抑制PPO活性的升高,且2.7×108CFU/mL酵母菌悬液效果最好。
2.5.5 对西兰花过氧化物酶(POD)活性的影响

图8 不同浓度酵母菌悬液对西兰花POD的影响Fig.8 Effects of different concentrations of yeast suspension on POD in broccoli
POD作为一种抗氧化酶,能够清除植物组织中的活性氧自由基(ROS),就可以减少ROS的积累,降低氧化损伤,延缓细胞膜膜脂过氧化,延缓果蔬采后衰老的进程[21]。如图8所示,在整个贮藏期间,西兰花的 POD酶活性缓慢上升后下降,对照组下降值最大。贮藏第5 d,2.7×107CFU/mL、2.7×108CFU/mL处理组均显著高于对照组(p<0.05),其中 2.7×108CFU/mL处理组 POD 活性最高。因此,2.7×108CFU/mL酵母菌悬液能显著维持西兰花POD的活性(p<0.05)。
3 结论
3.1 在试验浓度范围内,拮抗酵母菌悬液的浓度越高,对病原菌菌落扩展,孢子萌发和芽管生长的抑制作用越强。推测可能与酵母菌生长密度效应有关。酵母菌生长与病原菌存在营养和空间竞争关系,高浓度的拮抗酵母更有利于西兰花黑斑病的防治。活体试验结果表明,105CFU/mL浓度的拮抗酵母菌无论是单独存在还是和病原菌同时存在,都能在西兰花伤口处快速繁殖。拮抗酵母能对西兰花病原菌产生抑制作用,降低病斑直径和发病率。低浓度(105CFU/mL)酵母虽然有一定的效果,但远不如高浓度(108CFU/mL)酵母作用明显。在前期预备试验中也研究过更高浓度的酵母菌悬液(109CFU/mL、1010CFU/mL)对病原菌的抑制作用和西兰花各生理品质的影响,但 109CFU/mL和更高浓度效果与108CFU/mL浓度处理的结果差异不大,从试验原料和成本角度考虑,选取108CFU/mL拮抗酵母菌悬液为最佳处理浓度。
3.2 西兰花采后仍然会进行一系列的生理生化活动,比如呼吸作用、果实内的营养物质如Vc、叶绿素、可溶性糖等都在进行着降解、消耗和转化等过程[24]。不同浓度拮抗酵母能有效维持西兰花Vc、叶绿素、可溶性糖的含量。贮藏第5 d,经高浓度(2.7×108CFU/mL)拮抗酵母处理过的西兰花叶绿素、Vc、可溶性糖和的含量分别是对照组的1.42倍、1.56倍、1.94倍,差异显著(p<0.05)。2.7×108CFU/mL对贮藏期间西兰花PPO酶活性的升高有显著的抑制作用,同时能显著维持西兰花POD酶活性(p<0.05)。因此108CFU/mL浓度的拮抗酵母能够显著降低西兰花营养物质的消耗和降解,较好地保持西兰花原有的营养价值和感官品质对西兰花黑斑病的生物防治和生理品质保鲜效果最好。
[1]聂青玉.壳寡糖涂被纸包装对西兰花采后保鲜的影响[J].食品科技,2014,6:63-66 NIE Qing-yu. Effect of oligochitosan wrapping paper on the postharvest quality of brassica oleacea [J]. Food Science and Technology, 2014, 6: 63-66
[2]于雅琴,张鹏.GC-MS分析西兰花乙醇提取物的化学成分[J].天津师范大学学报(自然科学版),2012,32(4):67-70 YU Ya-qin, ZHANG Peng. Gas chromatographic-mass spectroscopic analysis of chemical components in ethanol extract from broccoli [J]. Journal of Tianjin Normal University (Natural Science Edition), 2012, 32(4): 67-70
[3]孔秋莲.青花菜采后怎样才能保鲜[J].中国农村科技,2002,5:42 KONG Qiu-lian. How to preserve the freshness of broccoli[J]. China Rural Science and Technology, 2002, 5: 42
[4]刘毅.西兰花采后黑斑病的鉴定以及致病机理的研究[D].上海:华东师范大学,2009 LIU Yi. Identification of black spot disease and how it infects postharvest broccoli [D]. Shanghai: East China Normal University, 2009
[5]陈秀峰.植物病害生物防治[M].西安:山西人民教育出版社,1993
[6]刘晓媛.拮抗酵母菌生防机理及应用研究[D].天津:天津科技大学,2009 LIU Xiao-yuan. Studies on biocontrol mechanism and application of antagonistic yeast fungus [D]. Tianjin: Tianjin University of Science and Technology, 2009
[7]Zhang H Y, Wang L, Dong Y, et al. Postharvest biological control of gray mold decay of strawberry with rhodotorula glutinis [J]. Biological Control, 2007, 40(2): 287-292
[8]Long C A, Yuan C. Kloeckera apiculata strain to control Botrytis cinerea during the pre-and postharvest handing of strawberries [J]. Annals of Microbiology, 2009, 59(1): 77-81
[9]Zhang H Y, Zheng X D, Fu C, et al. Postharvest biological control of gray mold rot of pear with Cryptococcus laurentii[J]. Postharvest Biology and Technology, 2005, 35: 79-86
[10]罗凯.拮抗酵母结合化学物质提高草莓果实采后贮藏性能的研究[D].南京:南京农业大学,2012 LUO Kai. Effect of antagonistic yeast alone or in combination with chemical materials on postharvest storability of strawberry fruits [D]. Nanjing: Nanjing Agricultural University, 2012
[11]曾丽珍.β-葡聚糖提高拮抗酵母生防效力及相关机理研究[D].杭州:浙江大学,2015 ZENG Li-zhen. Effect of β-Glucan on biocontrol efficacy of antagonistic yeast and related mechanism [D]. Hangzhou:Zhejiang University, 2012
[12]闫岩,王明力,李岑,等.汉逊德巴利酵母对采后柑橘青霉病的防治及贮藏品质的影响[J].食品与发酵工业,2013,39(8):216-220 YAN Yan, WANG Ming-li, LI Cen, et al. The effect of the yeast on the control and storage quality of citrus penicillium in the post-harvest citrus [J]. Food and Fermentation Industry,2013, 39(8): 216-220
[13]高云慨.一株对芒果炭疽病菌有拮抗作用的酵母菌的鉴定、生防效果评价及抗逆性改良[D].海口:海南大学,2014 GAO Yun-kai. Identification and biocontrol efficacy assessment of yeast strain against Colletotrichum gloeosporioides of mango fruit and its stress resistance improvement [D]. Haikou: Hainan University, 2014
[14]温新宇.拮抗酵母菌的筛选、鉴定及其制剂对枇杷贮藏保鲜的影响[D].镇江:江苏大学,2016 WEN Xin-yu. Screening identification of antagonistic yeast and effect of its biocontrol agents on postharvest loquat during storage [D]. Zhenjiang: Jiangsu University, 2016
[15]史君彦,王清,高丽朴,等.外源硝普钠处理对青花菜贮藏过程中品质的影响[J].安徽农业科学,2012, 40(33):16383-16385 SHI Jun-yan, WANG Qing, GAO Li-pu, et al. The effect of exogenous sodium nitroprusside treatment on broccoli quality during the storage [J]. Journal of Anhui Agricultural Sciences,2012, 40(33): 16383-16385
[16]刘艳芳,孙学文,杨晴.紫外分光光度法测定Vc含量的方法改进[J].安徽农业科学,2011,39(22):13270-13272 LIU Yan-fang, SUN Xue-wen, YANG Qing, et al.Improvement of ultraviolet spectrophotometry to measure the content of Vc [J]. Journal of Anhui Agricultural Science,2011, 39(22): 13270-13272
[17]李晓旭,李家政.优化蒽酮比色法测定甜玉米中可溶性糖的含量[J].保鲜与加工,2013,4:24-27 LI Xiao-xu, LI Jia-zheng. Determination of the content of soluble sugar in sweet corn with optimized anthrone colorimetric method [J]. Storage and Process, 2013, 4: 24-27
[18]曹建康,姜微波,赵玉梅,等.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007
[19]Filonow A B. Role of competition for sugars by yeasts in the biocontrol of gray mold of apple [J]. Biocontrol Science and Technology, 1998, 8(2): 243-256
[20]刘海波,田世平.水果采后生物防治拮抗机理的研究进展[J].植物学通报,2001,18(6):657-664 LIU Hai-bo TIAN Shi-ping. Recent advances on the mechanism of postharvest biocontrol [J]. Chinese Bulletin of Botany, 2001, 18(6): 657-664
[21]黄宇斐,乔勇进,刘晨霞,等.气调对西兰花贮藏效果与品质的影响[J].食品与机械,2017,33(6):114-118 HUANG Yu-fei, QIAO Yong-jin, LIU Chen-xia, et al. Effect of controlled atmosphereon preservation and freshness storage of broccoli [J]. Food and Machinery, 2013, 33(6):114-118
[22]王丹,李雪,马越,等.不同清洗剂对鲜切西兰花贮藏期间品质的影响[J].食品与机械,2013,5:190-193 WANG Dan, LI Xue, Ma Yue, et al. Effec on storage quality of fresh-cut broccoli with different washing methods [J].Food and Machinery, 2013, 5: 190-193
[23]陈学玲,张莉会,严守雷,等.不同包装材料对鲜切西兰花贮藏品质的影响[J].食品科学CHEN Xue-ling, ZHANG Li-hui, YAN Shou-lei, et al.Different packaging materials on the storage quality of fresh-cut broccoli [J]. Food Science
[24]田建,周红丽,易有金,等.辣椒炭疽病菌拮抗内生菌筛选及其对辣椒采后保鲜效果的研究[J].现代食品科技,2016,32(5):151-160 TIAN Jian, ZHOU Hong-li, YI You-jin, et al. Screening of an antagonistic endophytic bacterium against Colletotrichum capsici and its fresh-keeping effects on postharvest capsicum[J]. Modern Food Science and Technology, 2016, 32(5):151-160
