天冬氨酸转氨酶/胆碱酯酶比值预测慢性乙型肝炎肝纤维化程度的性能评价
2018-03-13张正华潘云鹤张占卿
黄 丹, 陆 伟, 汪 洁, 张正华, 潘云鹤, 张占卿
(1. 上海市公共卫生临床中心肝胆内科,上海 201508; 2. 上海市奉贤区古华医院感染科,上海 201499;3. 上海市浦东新区南华医院感染科,上海 201300)
近10年来,慢性乙型肝炎(chronic hepatitis B, CHB)肝纤维化程度的无创预测已取得了很大进展。其中,预测指标可分为疾病特异性和病因特异性指标[1-2];预测模型包括Logistic回归模型、Fisher判别函数、比例模型和积分模型等[3-5]。但迄今只有两个比例模型,天冬氨酸转氨酶/血小板比值(aspartate aminotransferase to platelet ratio, APR)和基于4个参数的纤维化指数(fibrosis index based on the 4 factors, FIB-4)被推广应用[6-7]。作为一项评估肝脏储备功能的指标,血清胆碱酯酶(cholinesterase, ChE)与肝纤维化程度密切相关[8-9]。本研究参照APR构建了一个新的数学模型: 天冬氨酸转氨酶/胆碱酯酶比值(aspartate aminotransferase to cholinesterase ratio, ACR)。本研究旨在对比评价ACR与APR及其构件预测CHB肝纤维化程度的性能。
1 资料与方法
1.1 一般资料
2006年8月至2017年7月上海市公共卫生临床中心收治的初治CHB患者2361例入选本研究,其中HBeAg阳性1335例,HBeAg阴性1026例;诊断符合中华医学会肝病学分会、感染病学分会联合修订的《慢性乙型肝炎防治指南(2015版)》的标准[7],合并其他类型的病毒性肝炎、自身免疫性肝病、药物性肝损害、酒精性肝病、非酒精脂肪性肝病和胃肠道疾病,以及近6个月内曾接受核苷(酸)类、干扰素类、甘草酸类和苦参碱(素)类药物治疗的患者被排除;合并肝脏失代偿和肝细胞癌的患者被排除。本研究得到了上海市公共卫生临床中心伦理委员会的批准,研究过程遵循2013版赫尔辛基宣言。
1.2 病理学诊断
所有患者在接受肝活检前常规签署知情同意书。肝脏活检采用1s经皮肝穿刺法。标本采集后立即置塑料标本管内冰冻送检。标本的质量评价和肝脏病理学诊断由1名有经验的病理学医师独立完成。肝脏病理学诊断采用Scheuer评分系统[10]。本研究将病理学分期≥S2和≥S4分别定义为显著肝纤维化和肝硬化。
1.3 实验室检查
血清HBsAg和HBeAg采用Abbott Architect 12000全自动化学发光免疫系统检测;血清丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)和ChE采用Hitachi 7600全自动生化分析仪检测,正常参考值分别为9~50、15~40和4~15 kU/L;外周血血小板(platelet, PLT)采用Sysmex-XT 4000i全自动血细胞分析仪检测,正常参考值(125~350)×109/L。
ACR、APR计算[11]: AST相对值=AST测量值/ULN,PLT相对值=PLT测量值/100;ACR=AST相对值/ChE测量值,APR=AST相对值/PLT相对值。式中,AST计量单位为IU/L,ChE计量单位为kU/L,PLT计量单位为×109/L;ULN为正常参考值上限(upper limit of normal)。
1.4 统计学处理
数据分析和图形制作采用Medcalc 15.8软件。HBeAg阳性与阴性患者性别比例、肝脏病理学分级和分期构成比之间的差异比较采用χ2检验。中位年龄,中位ALT,中位ACR、APR及其构件AST、ChE、PLT之间的差异比较采用两独立样本Mann-WhitneyU检验。ACR、APR及其构件AST、ChE、PLT预测HBeAg阳性与阴性患者相同肝纤维化程度的ROC曲线下面积(AUROCs)之间的差异比较采用独立样本Delong非参数检验。在HBeAg阳性和阴性患者框架内,ACR、APR及其构件AST、ChE、PLT彼此预测相同肝纤维化程度的AUROCs之间的差异比较采用配对样本Delong非参数检验。P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的临床、实验室和肝脏病理学特征
HBeAg阳性与阴性患者性别比例之间的差异无统计学意义(P>0.05),中位年龄之间的差异有统计学意义(P<0.0001);HBeAg阳性与阴性患者中位ALT,中位ACR、APR及其构件AST、ChE、PLT之间的差异均有统计学意义(P均<0.0005);HBeAg阳性与阴性患者病理学分级和分期构成之间的差异均有统计学意义(P均<0.0001)。见表1。

表1 研究对象的临床、实验室和肝脏病理学特征Tab.1 Clinical, laboratory and hepatic pathological characteristics of CHB patients
a:χ2检验;b: Mann-WhitneyU检验
2.2 ACR、APR及其构件预测肝纤维化程度的AUROCs
无论HBeAg阳性或阴性患者,ACR、APR及其构件预测显著肝纤维化和肝硬化的AUROCs均大于对角参考线下面积(P均<0.0001)。其中,ACR、APR及其构件预测HBeAg阳性与阴性患者显著肝纤维化的AUROCs之间的差异均无统计学意义(P均>0.05);APR、ChE和PLT预测HBeAg阳性与阴性患者肝硬化的AUROCs之间的差异均无统计学意义(P均>0.05),ACR、AST预测HBeAg阳性与阴性患者肝硬化的AUROCs之间的差异均有统计学意义(P均<0.05),见图1。
对于HBeAg阳性患者,ACR预测显著肝纤维化的AUROCs大于AST(P<0.0001),接近ChE(P>0.05),预测肝硬化的AUROCs大于AST(P<0.0001),小于ChE(P<0.0001);APR预测显著肝纤维化的AUROCs均大于AST和PLT(P均<0.0001),预测肝硬化的AUROCs大于AST(P<0.0001),接近PLT(P>0.05)。对于HBeAg阴性患者,ACR预测显著肝纤维化的AUROCs均大于AST和ChE(P均<0.05),预测肝硬化的AUROCs大于AST(P<0.001),小于ChE(P<0.001);APR预测显著肝纤维化的AUROCs均大于AST和PLT(P均<0.005),预测肝硬化的AUROCs均大于AST和PLT(P均<0.05)。见表2。
对于HBeAg阳性患者,ACR预测显著肝纤维化的AUROCs接近APR(Z=1.050,P=0.2938),大于PLT(Z=4.214,P<0.0001),预测肝硬化的AUROCs接近APR(Z=0.681,P=0.4958)和PLT(Z=1.285,P=0.1989);ChE预测显著肝纤维化的AUROCs接近APR(Z=0.881,P=0.3784),大于PLT(Z=3.419,P=0.0006),预测肝硬化的AUROCs大于APR(Z=3.241,P=0.0012),接近PLT(Z=1.565,P=0.1175)。对于HBeAg阴性患者,ACR预测显著肝纤维化的AUROCs接近APR(Z=1.628,P=0.1036),大于PLT(Z=4.642,P<0.0001),预测肝硬化的AUROCs接近APR(Z=1.818,P=0.0691),大于PLT(Z=2.382,P=0.0172);ChE预测显著肝纤维化的AUROCs接近APR(Z=1.308,P=0.1907),大于PLT(Z=2.736,P=0.0062),预测肝硬化的AUROCs大于APR(Z=3.504,P=0.0005)和PLT(Z=4.269,P<0.0001)。
2.3 ACR、APR及其构件ChE、PLT预测肝纤维化程度的性能
参照预测显著肝纤维化和肝硬化的特异度与灵敏度之和的最大值,选择最佳截断值。ACR、APR及其构件ChE、PLT的最佳截断值及其对应的诊断参数见表3、图1。
参照预测显著肝纤维化和肝硬化的特异度与灵敏度之差的最小值,选择折中截断值;ACR、APR及其构件ChE、PLT的折中截断值及其对应的诊断参数见表3、图2。
在预测显著肝纤维化的特异度和预测肝硬化的灵敏度的重叠区间内,参照预测显著肝纤维化的特异度与预测肝硬化的灵敏度之和的最大或较大值,选择单一的实用截断值;ACR、APR及其构件ChE、PLT实用截断值及其对应的诊断参数见表3、图2。

图1 ACR、APR及其构件预测显著肝纤维化和肝硬化的ROC曲线Fig.1 ROC curves of ACR, APR and their components for predicting significant liver fibrosis and cirrhosisA、B: 预测HBeAg阳性显著肝纤维化和肝硬化;C、D: 预测HBeAg阴性显著肝纤维化和肝硬化
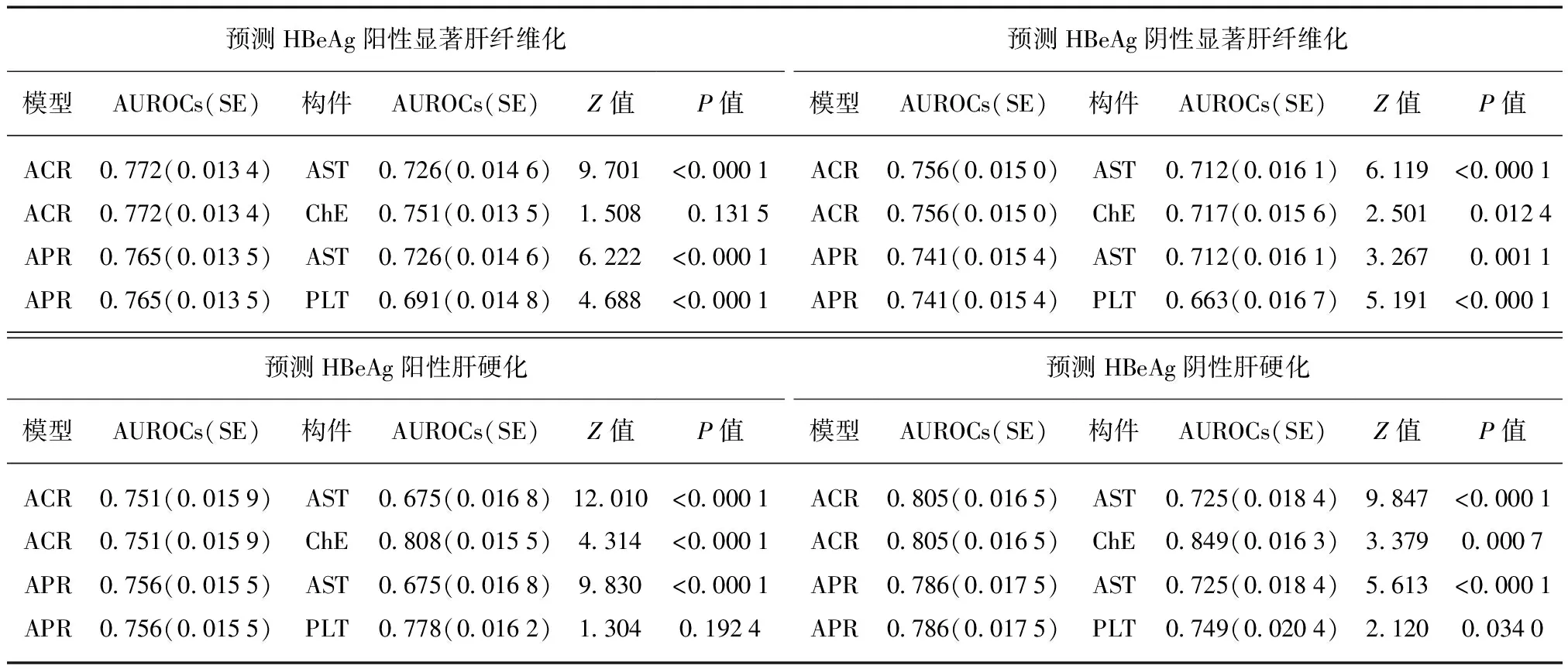
预测HBeAg阳性显著肝纤维化预测HBeAg阴性显著肝纤维化模型AUROCs(SE)构件AUROCs(SE)Z值P值模型AUROCs(SE)构件AUROCs(SE)Z值P值ACR0772(00134)AST0726(00146)9701<00001ACR0756(00150)AST0712(00161)6119<00001ACR0772(00134)ChE0751(00135)150801315ACR0756(00150)ChE0717(00156)250100124APR0765(00135)AST0726(00146)6222<00001APR0741(00154)AST0712(00161)326700011APR0765(00135)PLT0691(00148)4688<00001APR0741(00154)PLT0663(00167)5191<00001预测HBeAg阳性肝硬化预测HBeAg阴性肝硬化模型AUROCs(SE)构件AUROCs(SE)Z值P值模型AUROCs(SE)构件AUROCs(SE)Z值P值ACR0751(00159)AST0675(00168)12010<00001ACR0805(00165)AST0725(00184)9847<00001ACR0751(00159)ChE0808(00155)4314<00001ACR0805(00165)ChE0849(00163)337900007APR0756(00155)AST0675(00168)9830<00001APR0786(00175)AST0725(00184)5613<00001APR0756(00155)PLT0778(00162)130401924APR0786(00175)PLT0749(00204)212000340

表3 ACR、APR及其构件ChE、PLT预测显著肝纤维化和肝硬化的参考截断值及其对应的诊断参数Tab.3 Reference cutoffs and corresponding diagnostic parameters of ACR, APR and their components ChE, PLT for predicting significant liver fibrosis and cirrhosis
ChE计量单位为kU/L,PLT计量单位为×109/L;a: 最佳截断值;b: 折中截断值;c: 实用截断值
3 讨 论
慢性乙型肝炎病毒感染,无论HBeAg阳性和阴性阶段,均依次或反复经历肝炎非活动期和活动期[12]。理论上讲,HBeAg阳性与HBeAg阴性患者肝损伤和肝纤维化的生物学表现存在差异。但是,同一指标或模型预测HBeAg阳性与阴性患者肝纤维化程度的性能比较却少有报道[3-7,13]。本研究显示,HBeAg阳性与阴性患者肝脏不同病理学分级和分期构成比、中位ALT和中位ACR、APR及其构件AST、ChE、PLT之间的差异均有统计学意义。提示对肝纤维化程度无创指标或模型的性能评价应当分别在HBeAg阳性和阴性患者框架内进行。
根据对催化底物的偏好,ChE分乙酰ChE和丁酰ChE两型。其中,血清或血浆ChE主要指由肝脏产生的丁酰ChE,全血ChE还包括红细胞来源的乙酰ChE。血清ChE已被用于肝硬化患者肝脏储备功能的评价,但很少有文献探讨它是否可用于肝纤维化程度的预测[8-9]。本研究显示,无论对于HBeAg阳性或阴性患者,ACR预测显著肝纤维化和肝硬化的AUROCs均接近APR;对于HBeAg阳性患者,ACR和APR预测显著肝纤维化的AUROCs均接近ChE,显著大于PLT,预测肝硬化的AUROCs均显著小于ChE,接近PLT;对于HBeAg阴性患者,ACR和APR预测显著肝纤维化的AUROCs分别大于和接近ChE,均显著大于PLT,预测肝硬化的AUROCs均显著小于ChE,均显著大于PLT。提示血清ChE和基于血清ChE构建的ACR均具有较高的预测肝纤维化程度的效能。


图2 ACR、APR及其构件ChE、PLT预测显著肝纤维化(≥S2)和肝硬化(≥S4)的灵敏度和特异度的散点图Fig.2 Scatter plot of sensitivity and specificity of ACR, APR and their components ChE, PLT for predicting significant liver fibrosis(≥S2) and cirrhosis(≥S4)A、C、E、G: HBeAg阳性患者;B、D、F、H: HBeAg阴性患者;Sen=Sensitivity;Spe=Specificity;Cutoff: 截断值。
为进一步比较和评价ACR、APR及其构件ChE、PLT预测肝纤维化程度的性能,本研究在选择惯用的最佳截断值的同时,提出了灵敏度和特异度之差接近“0”值的折中截断值。需要指出的是,ACR、APR及其构件ChE、PLT预测HBeAg阳性与阴性患者相同肝纤维化程度的最佳截断值或折中截断值并不一致。参照折中截断值,与ACR、APR相比,PLT预测HBeAg阳性和阴性患者、ChE预测HBeAg阴性患者显著肝纤维化的灵敏度或特异度相对较低;PLT和ChE预测HBeAg阴性患者肝硬化的灵敏度或特异度相对较低和较高。提示无论HBeAg阳性或阴性患者,与PLT和ChE相比,ACR、APR预测显著肝纤维化和肝硬化的稳定性相对较高。
临床实践和研究已证实,肝脏坏死炎症的缓解可导致肝脏纤维化回归,但是否可导致伴随显著结构紊乱的肝硬化逆转一直存在争议[14-17]。因此,在肝硬化前做出显著肝纤维化的诊断具有重要现实意义。本研究也选择了易于记忆且尽可能降低显著肝纤维化误诊率和降低肝硬化漏诊率的实用截断值。ACR>0.200时,其预测HBeAg阳性患者显著肝纤维化和肝硬化的灵敏度、特异度分别为60.4%、79.2%和77.3%、61.2%;ACR>0.125时,其预测HBeAg阴性患者显著肝纤维化和肝硬化的灵敏度、特异度分别为59.0%、80.4%和80.7%、68.3%。APR>1.000时,其预测HBeAg阳性患者肝纤维化和肝硬化的灵敏度、特异度分别为56.8%、78.8%和76.2%、63.8%;APR>0.750时,其预测HBeAg阴性患者显著肝纤维化和肝硬化的灵敏度、特异度分别为58.1%、79.8%和80.2%、68.5%。提示无论HBeAg阳性或阴性患者,参照实用截断值预测显著肝纤维化和肝硬化,ACR的灵敏度和特异度均与APR高度一致。
[1] ZHANG Z Q, LU W, WANG Y B, et al. Measurement of the hepatitis B core-related antigen is valuable for predicting the pathological status of liver tissues in chronic hepatitis B patients [J]. J Virol Methods, 2016,235: 92-98.
[2] 张占卿,陆伟,翁齐铖,等.血清病毒学标记物预测慢性乙型肝炎肝组织病理状态的评价[J].同济大学学报(医学版),2015,36(4): 57-63.
[3] EUROPEAN ASSOCIATION FOR THE STUDY OF THE LIVER, ASOCIACION LATINOAMERICANA PARA EL ESTUDIO DEL HIGADO. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis [J]. J Hepatol, 2015,63(1): 237-264.
[4] 张占卿,陆伟,张丽军.乙型肝炎相关肝纤维化和肝硬化无创判别模型的研究进展[J].临床荟萃,2012,27(8): 719-723.
[5] 张占卿,陆伟,张丽军.乙型肝炎相关肝纤维化和肝硬化无创回归模型的研究进展[J].肝脏,2012,17(3): 201-205.
[6] SARIN S K, KUMAR M, LAU G K, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update [J]. Hepatol Int, 2016,10(1): 1-98.
[7] 中华医学会肝病学分会、中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年版)[J/OL].中华实验和临床感染病杂志(电子版),2015,9(5): 570-589.
[8] 张占卿,陆伟,饶敏,等.血清胆碱酯酶活性对慢性乙型肝炎肝组织病理分级分期的预测价值[J].实用肝脏病杂志,2011,14(4): 257-258,261.
[9] RAMACHANDRAN J, SAJITH K G, PRIYA S, et al. Serum cholinesterase is an excellent biomarker of liver cirrhosis [J]. Trop Gastroenterol, 2014,35(1): 15-20.
[10] BRUNT E M. Grading and staging the histopathological lesions of chronic hepatitis: The Knodell histology activity index and beyond [J]. Hepatology, 2000,31(1): 241-246.
[11] WAI C T, GREENSON J K, FONTANA R J, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C [J]. Hepatology, 2003,38(2): 518-526.
[12] EUROPEAN ASSOCIATION FOR THE STUDY OF THE LIVER. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection [J]. J Hepatol, 2017,67(2): 370-398.
[13] ZENG X, XU C, HE D, et al. Performance of several simple, noninvasive models for assessing significant liver fibrosis in patients with chronic hepatitis B[J]. Croat Med J,56(3): 272-279.
[14] DESMET V J, ROSKAMS T. Cirrhosis reversal: a duel between dogma and myth [J]. J Hepatol, 2004,40(5): 860-867.
[15] CALVARUSO V, CRAXI A. Regression of fibrosis after HBV antiviral therapy. Is cirrhosis reversible? [J]. Liver Int, 2014,34(Suppl 1): 85-90.
[16] OHKOSHI S, HIRONO H, WATANABE K, et al. Natural regression of fibrosis in chronic hepatitis B [J]. World J Gastroenterol, 2016,22(24): 5459-5466.
[17] JUNG Y K, YIM H J. Reversal of liver cirrhosis: current evidence and expectations [J]. Korean J Intern Med, 2017,32(2): 213-228.
