甘蔗蔗糖磷酸合成酶SPSⅢ基因表达分析
2018-03-12黄诚梅杨翠芳魏源文邓智年吴凯朝曹辉庆李杨瑞
黄诚梅, 杨翠芳,, 魏源文, 邓智年, 吴凯朝, 曹辉庆, 李杨瑞,
(1.广西作物遗传改良生物技术重点开放实验室,广西南宁 530007; 2.中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,广西南宁 530007)
甘蔗蔗糖积累过程是甘蔗最重要的代谢途径,与甘蔗产量和品质形成密切相关。甘蔗蔗糖积累过程主要涉及蔗糖合成酶(sucrose synthase,简称SS)、蔗糖磷酸合成酶(sucrose phosphate synthase,简称SPS)、可溶性酸性转化酶(acid invertase,简称AI)和中性转化酶(neutral invertase,简称NI)等,与蔗糖合成和分解反应密切相关[1-2]。SPS在蔗糖代谢中被认为是控制蔗糖合成的一个关键酶,其活性不仅能影响蔗糖的合成能力,还影响光合同化碳的分配和糖分积累[1-6]。Langenkämper等用生物信息学方法对高等植物已知的SPS基因的全长序列和其保守序列进行分析,把SPS基因分为A、B、C这3个家族[7]。但Castleden等对小麦等单子叶植物的SPS基因进行研究后发现,单子叶植物中的SPS基因分为5个家族,除了存在A(Ⅱ)、B(Ⅴ)、C(Ⅰ)家族外,还包括D(Ⅲ)和D(Ⅳ)家族[8]。目前,从美国国家生物技术信息中心网站(http://www.ncbi.nlm.nih.gov)上检索可知,已经从玉米[9]、菠菜[10]、甜菜[11]、柑橘[12]、苹果[13]、水稻[14]、甘蔗[15]、马铃薯[16]等作物中克隆到SPS基因。
甘蔗(SaccharumofficinarumL.)是最主要的糖料作物,蔗糖占世界食糖总产量的76%,占我国食糖总产量的90%以上。作为C4高生物量和高纤维作物,甘蔗是一种理想的能源作物。蔗糖代谢是甘蔗生长发育过程中最重要的代谢途径。甘蔗SPS基因SPSⅡ于1997年被成功克隆[15],近年来,甘蔗SPS基因家族的其他成员也先后被成功克隆,如SPSⅡ(EU269038.1)、SPSⅢ(EU278618.1、EU278617.1)、SPSA(HM854011.1)、SPSB(JN584485.1、HQ117935.1)。但到目前为止,对甘蔗SPS基因家族的功能及表达特性等方面的研究报道仍然较少。利用已克隆的甘蔗SPSⅢ cDNA片段,通过半定量RT-PCR方法对SPSⅢ在工艺成熟期中甘蔗不同基因型及其不同部位中的表达差异进行分析,为进一步研究SPSⅢ的表达特性及其在甘蔗蔗糖代谢中的作用机制提供参考。
1 材料与方法
1.1 植物材料与试剂
供试甘蔗材料包括桂糖28号(GT28)、果蔗Badila、新台糖20号(ROC20)、新台糖22号(ROC22),均由广西农业科学院广西遗传改良生物技术重点开放实验室提供。
甘蔗总RNA提取世纪Trizol购自Invitrogen公司;Ex-Taq酶、dNTPs Mixture、DNA Maker、载体pMD-18-T-Vector、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、X-Gal等均购自宝生物工程(大连)有限公司;PCR扩增引物由宝生物工程(大连)有限公司合成;所用的菌株为笔者所在实验室保存的大肠杆菌JM109,小量胶回收试剂盒购自上海华禹生物工程有限公司;其他试剂均为进口分装或国产分析纯。
1.2 植物材料的种植与取样
试验在广西农业科学院温室大棚进行,采用口径为 35 cm、桶底直径为28 cm的黑色塑料桶装沙质土壤进行桶栽,每桶4~6芽,齐苗后定苗,每桶2~3株,其余管理措施与一般桶栽试验的管理措施相同。于甘蔗生长后期、工艺成熟初期进行取样,每个甘蔗基因型选取生长比较一致的5株植株,取+1、0叶、嫩叶鞘、幼茎(最高可见肥厚带的第1张完全展开叶为+1叶,自下而上位于+1叶之上的为0叶,自上往下数位于+1叶下面的为+2叶,依此类推[17])。叶片选用距叶环20~60 cm区段,去除中脉后立即放于液氮中,混匀分装保存用于总RNA的提取。
1.3 引物设计
根据NCBI的GenBank与DDBJ数据库中的甘蔗SPS基因核酸序列,采用生物学软件Primer Premier 5.0分析设计半定量RT-PCR的特异性引物,引物序列为SF2:5′-GGGAGGAGAAGGACTAAGGA-3′和SR2:5′-GCAAGACAA TAGGCTGAAGAG-3′。内参基因引物参考甘蔗的看家基因25S rRNA的实时PCR引物[18],引物序列为RF2:5′-GCAGCCAAGCGTTCATAGC-3′和RR2:5′-CCTATTGGTGG GTGAACAATCC-3′。
1.4 甘蔗总RNA提取及cDNA第1链合成
参照Invitrogen的Trizol方法[19]提取甘蔗各部位的总RNA。取各个部位的总RNA 500 ng,用TaKaRa公司的AMV Reverse Transcriptase XL反转录酶进行反转录合成cDNA第1链,反应后将cDNA冻置-20 ℃备用。
1.5 甘蔗SPSⅢ基因半定量RT-PCR分析
以甘蔗工艺成熟期各基因型各个部位的cDNA第1链为模板,以目的基因SPSⅢ引物及内参基因25S rRNA的引物进行半定量RT-PCR扩增,分析SPSⅢ的表达情况。25 μL PCR反应体系为10×Ex-TaqBuffer 2.5 μL、2.5 mmol/L dNTPs Mixture 2.0 μL、10 pmol/μL前引物1.0 μL、10 pmol/μL 后引物1.0 μL,模板cDNA第1链1.0 μL,5 U/μL Ex-Taq酶 0.2 μL,ddH2O补足至25.0 μL。PCR反应程序为:94 ℃预变性3 min;94 ℃变性45 s,50~55 ℃退火35 s,72 ℃延伸90 s,35个循环;最后72 ℃延伸10 min,4 ℃下保存。反应完成后,取5 μL扩增产物用1%琼脂糖凝胶进行电泳检测。
2 结果与分析
2.1 甘蔗各个部位总RNA的提取及其cDNA第1链的合成
由图1可见,4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎4个不同部位采用Trizol法提取得到的总RNA经电泳检测,2条主带28S与18S清晰完整,没有明显的拖尾现象。RNA浓度及其纯度检测表明,D260 nm/D230 nm比值大于2.0,D260 nm/D280 nm比值在1.8~1.9之间。以500 ng总RNA进行cDNA第1链合成,以进行下一步的半定量PCR扩增。
2.2 甘蔗工艺成熟初期SPSⅢ基因表达分析
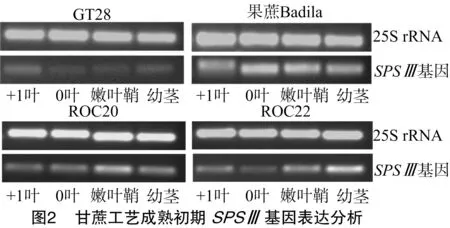
在甘蔗工艺成熟初期,SPSⅢ在4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎中均已有表达,但SPSⅢ表达因甘蔗基因型不同而有所差异(图2)。GT28的4个部位中,在+1叶中表达量较高,0叶、嫩叶鞘和幼茎的表达量都很低;在果蔗Badila的4个部位中表达量差异不大,以0叶的表达量最高;在ROC20中以嫩叶鞘中的表达量最高;而在ROC22中以幼茎中表达量最高。由此可见, 不同基因型的SPSⅢ表达情况存在差异。
2.3 甘蔗工艺成熟中期SPSⅢ基因表达分析
由图3可见,在甘蔗工艺成熟中期,SPSⅢ在4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎中的表达量较初期没有明显差异。在果蔗Badila 4个部位中的表达量稍高于其他3个品种,而在GT28的4个部位中表达量最低;ROC20与ROC22的4个部位中均以在嫩叶鞘中的表达量较高,其次为+1叶。

2.4 甘蔗工艺成熟后期SPSⅢ基因表达分析
由图4可见,在甘蔗工艺成熟后期,SPSⅢ在4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎中的表达量较前2个时期迅速提高,均达到了较高的表达水平,尤其是在GT28、果蔗Badila和ROC20中,而在ROC22的0叶、幼嫩叶鞘2个部位中表达量较低。其中,SPSⅢ基因在GT28的4个部位中表达较前2个时期迅速提高,+1叶、0叶、嫩叶鞘、幼茎的表达水平相当;SPSⅢ基因在果蔗Badila的幼茎中表达量稍弱外,其他3个部位的表达水平均较高;SPSⅢ在高糖品种ROC20的幼茎中表达量较其他3个部位的高;而在ROC22的+1叶与幼茎中表达量较0叶与嫩叶鞘高。结果表明,在甘蔗工艺成熟后期,SPSⅢ基因达到较高的表达水平,以利于甘蔗糖分积累进入成熟收获期。
3 结论与讨论
SPS已经被确认是甘蔗蔗糖积累过程中的主要关键酶之一,SPS活性可直接影响甘蔗的蔗糖合成能力和糖分积累[1-6,20]。SPS基因家族的不同成员在不同植物体内的表达特性不同,所发挥的功能也不同[21]。由于生产上的甘蔗品种多为异源多倍体,遗传背景复杂且差异很大,加上甘蔗SPS基因家族又十分复杂,由此推断,甘蔗SPS基因的表达情况也是十分复杂的。Gpl等研究发现,甘蔗SPS基因中的 B(Ⅴ) 和C(Ⅰ)家族主要在叶片中表达,D家族中的2个亚家族[D(Ⅲ)和D(Ⅳ)]在各种部位中均表现出较相似的表达水平[22];而A(Ⅱ)家族在叶中表达量最低,从茎尖分生组织往下到第7节间的表达量表现为逐渐降低,而从甘蔗顶部叶到下部茎表达量逐节增强,在蔗茎中的转录量占SPS转录总量的40%。叶冰莹等研究表明,在糖分积累初期蔗茎中的SPSⅡ相对表达量最大,在糖分积累中期蔗叶中的SPSⅡ相对表达量达到最高峰[23];同组织部位中,糖分积累初期SPSⅡ 相对表达量高于糖分积累中、后期。Verma等用半定量PCR对甘蔗SPSⅡ的表达进行研究,结果表明,甘蔗SPSⅡ 基因在成熟节间比未成熟节间表达量高,高糖品种比低糖品种表达量高[24]。

关于SPSⅢ在甘蔗中的表达情况仍鲜有报道,本研究结果表明,SPSⅢ在GT28、果蔗Badila、ROC20、ROC22这4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎中均有表达,其表达量因基因型不同及测定部位与时期不同而异。其中,在工艺成熟初期,4个甘蔗基因型中,以GT28的4个部位较其他3个品种的低,而在果蔗Badila的4个部位中表达较稳定,在ROC20中以嫩叶鞘中表达量最高;而ROC22以在幼茎中表达量最高。在工艺成熟中期,SPSⅢ在4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎中的表达量较初期没有明显差异;以在果蔗Badila 4个部位中的表达量稍高于其他3个品种,而在GT28的4个部位中表达量最低;在ROC20与ROC22的4个部位中表达量变化一致,以+1叶、嫩叶鞘中表达量明显高于0叶和幼茎,尤其是在嫩叶鞘中。在工艺成熟后期,SPSⅢ在4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎中的表达量较前2个时期迅速提高,均达到了较高的表达水平,尤其是在GT28、果蔗Badila和ROC20中,而在ROC22的0叶和嫩叶鞘2个部位中表达量较低。这表明,在甘蔗工艺成熟后期,SPSⅢ 达到较高的表达水平,利于甘蔗糖分积累,利于进入成熟收获期。在本研究的4个甘蔗材料中,GT28、ROC20、ROC22都是生产上的甘蔗品种,遗传背景差异很大。而果蔗Badila是甘蔗属中的热带种典型代表之一,遗传背景较单一[25]。因此,SPSⅢ在这4种不同基因型中的表达差异可能与甘蔗材料的遗传背景有关。基因表达是SPS活性调控的主要方式之一[3],因此,为了进一步探讨SPS基因表达与甘蔗糖分积累的关系,对SPS基因家族中各成员的表达情况进行深入研究是十分必要的。至于SPSⅢ在高、低糖甘蔗基因型及不同成熟度节间的表达情况等还有待于继续研究,以进一步探讨SPSⅢ基因表达对甘蔗糖分积累的影响。
SPSⅢ在GT28、果蔗Badila、ROC20、ROC22这4个甘蔗基因型的+1、0叶、幼嫩叶鞘、幼茎中均有表达,其表达量因基因型不同及测定部位与时期不同而异。在甘蔗工艺成熟后期,SPSⅢ达到较高的表达水平,利于甘蔗糖分积累,以利于甘蔗进入成熟收获期,表明该基因很有可能在甘蔗的蔗糖代谢过程中发挥着重要作用。
[1]Lingle S E,Smith R C. Sucrose metabolism related to growth and ripening in sugarcaneinternodes[J]. Crop Science,1991,31(1):172-177.
[2]Zhu Y J,Komor E,Moore P H. Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose phosphate synthase[J]. Plant Physiology,1997,115(2):609-616.
[3]Huber S C,Huber J L. Role and regulation of sucrose-phosphate synthase in higher plants[J]. Annual Review of Plant Physiology & Plant Molecular Biology,1996,47(2):431.
[4]Winter H,Huber S C. Regulation of sucrose metabolism in higher plants:localization and regulation of activity of key enzymes[J]. Critical Reviews in Biochemistry and Molecular Biology,2000,35(4):253-289.
[5]Batta S K,Deeksha,Thind K S,et al. Variability in activities of sucrose metabolizing enzymes in relation to sucrose accumulation among parents and their progenies of sugarcane[J]. Sugar Technology,2011,13(2):114-122.
[6]Sachdeva M,Bhatia S,Batta S K. Sucrose accumulation in sugarcane:a potential target for crop improvement[J]. Acta Physiologiae Plantarum,2011,33(5):1571-1583.
[7]Langenkämper G,Fung R W M,Newcomb R D,et al. Sucrose phosphate synthase genes in plants belong to three different families[J]. Journal of Molecular Evolution,2002,54(3):322-332.
[8]Castleden C K,Aoki N,Gillespie V J,et al. Evolution and function of the sucrose-phosphate synthase gene families in wheat and other grasses[J]. Plant Physiology,2004,135(3):1753-1764.
[9]Worrell A C,Bruneau J M,Summerfelt K,et al. Expression of a maize sucrose phosphate synthase in tomato alters leaf carbohydrate partitioning[J]. Plant Cell,1991,3(10):1121-1130.
[10]Klein R R,Craftsbrandner S J,Salvucci M E. Cloning and developmental expression of the sucrose-phosphate-synthase gene from spinach.[J]. Planta,1993,190(4):498.
[11]Hesse H,Sonnewald U,Willmitzer L. Cloning and expression analysis of sucrose-phosphate synthase from sugar beet (BetavulgarisL.)[J]. Molecular Gene Genet,1995,247(4):515-520.
[12]Komatsu A,Takanokura Y,Omura M,et al. Cloning and molecular analysis of cDNAs encoding three sucrose phosphate synthase isoforms from a citrus fruit (CitrusunshiuMarc.)[J]. Molecular Gene Genet,1996,252(3):346-351.
[13]Atkinson R G,Johanna P,Toshiyuki M,et al. A stress-,pathogenesis-,and allergen-related cDNA in apple fruit is also ripening-related[J]. New Zealand Journal of Crop & Horticultural Science,1996,24(1):103-107.
[14]Valdez-Alarcon J J,Ferrando M,Salermo G,et al. Characterization of a rice sucrose-phosphate synthase- encoding gene[J]. Gene,1996,170(2):217-222.
[15]Sugiharto B,Sakakibara H,Saumadi,et al. Differential expression of two genes for sucrose-phosphate synthase in sugarcane:molecular cloning of the cDNAs and comparative analysis of gene expression[J]. Plant & Cell Physiology,1997,38(8):961-965.
[16]Tobias D J,Hirose T,Ishimaru K,et al. Elevated sucrose-phosphate synthase activity in source leaves of potato[Solanumtuberosum]plants transformed with the maize[Zeamays]SPSgene[J]. Plant Production Science,2008,2(2):92-99.
[17]Clements H F,Ghotb A. The numbering of leaves and internodes for sugarcane nutrition studies[J]. Proc Intl Soc Sugar Cane Technol,1968,13:569-584.
[18]Iskandar H M,Simpson R S,Casu R E,et al. Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane[J]. Plant Molecular Biology Reporter,2004,22(4):325-337.
[19]杨翠芳,黄诚梅,潘有强,等. 甘蔗蔗糖磷酸合成酶SPSⅢ基因表达的初步研究[J]. 南方农业学报,2012,43(6):723-726.
[20]潘有强,罗海玲,李杨瑞. 甘蔗节间蔗糖含量与和蔗糖代谢相关的4种酶活性之间的关系剖析[J]. 植物生理学通讯,2007,243(5):861-864.
[21]Reimholz R,Geiger M,Haake V,et al. Potato plants contain multiple forms of sucrose phosphate synthase,which differ in their tissue distributions,their levels during development,and their responses to low temperature[J]. Plant Cell & Environment,1997,20(3):291-305.
[22]Cpl G,Cte S,Perroux J M,et al. The five families of sucrose-phosphate synthase genes inSaccharumspp. are differentially expressed in leaves and stem.[J]. Functional Plant Biology,2006,33(6):605-610.
[23]叶冰莹,邱 思,周 平,等. 甘蔗蔗糖磷酸合成酶SPSⅡ cDNA片段克隆与表达分析[J]. 应用与环境生物学报,2011,17(5):673-677.
[24]Verma A K,Upadhyay S K,Verma P C,et al. Functional analysis of sucrose phosphate synthase (SPS) and sucrose synthase (SS) in sugarcane (Saccharum) cultivars[J]. Plant Biology,2011,13(2):325.
[25]王 英,高和琼,庄南生,等. 崖城割手密11号与拔地拉核型比较分析[J]. 中国农学通报,2008,24(3):52-57.
