豆纹动脉供血区的分支动脉粥样硬化病和腔隙性脑梗死的临床比较
2018-03-12吴春丽严永兴梁丽贞
顾 婧,吴春丽,严永兴,梁丽贞
分支动脉粥样硬化病(branch atheromatous disease,BAD),是一种急性缺血性脑卒中,指脑主干动脉分出的穿支动脉入口处发生动脉粥样硬化性狭窄或闭塞所致的脑梗死[1]。腔隙性脑梗死(lacunar infarction,LI)则是指穿支动脉脂质透明样变或纤维玻璃样变所致的缺血性小梗死。两者同属于穿支动脉病变,但发病机制完全不同。与LI相比,BAD急性期易出现神经功能的恶化,是进展性脑卒中的主要原因之一[2,3]。本文旨在观察豆纹动脉(lenticulostriate artery,LSA)供血区的BAD和LI(LSA_BAD、LSA_LI)患者在肢体功能及日常生活能力方面的预后情况,指导临床治疗。
1 资料与方法
1.1 一般资料:选择2015年1月至2017年7月于我院神经内科住院治疗的LSA供血区的BAD和LI患者共84例,其中BAD患者44例,LI患者40例。入选标准:(1)符合《中国急性缺血性卒中诊治指南2014》制定的急性缺血性脑卒中诊断标准[4];(2)发病时间≤1周;(3)首次发病或非首次发病但此次病前未有神经功能缺失症状;(4)大脑中动脉、颈内动脉狭窄率<50%,无明确心源性栓子来源;(5)入院时头部核磁共振弥散成像(MRI_DWI)检查由神经内科、放射科两名以上医师阅片确认为LSA供血区病灶,且符合如下标准:LSA_BAD:梗死灶位于LSA供血区,在头部轴位MRI影像上梗死灶≥3个层面,且梗死区长轴直径≥10mm,冠状位显示为“逗号样巨大腔隙梗死灶”;LSA_LI:梗死灶位于LSA供血区,在头部轴位MRI影像上梗死灶<3个层面[5]。排除标准:有心房颤动病史;大脑中动脉、颈内动脉狭窄率≥50%或者闭塞;合并恶性肿瘤性疾病或严重心、肺、肝、肾功能衰竭的患者;合并有精神障碍、癫痫或痴呆患者。
1.2 方法:比较BAD、LI患者入院时美国国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS)评分、Brunnstorm运动功能恢复(Brs)分级、Barthel(BI)指数评分;比较两组患者的平均住院时间及出院时Brs、NIHSS、BI评分。
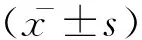
2 结果
2.1 两组患者基线水平比较:年龄、性别、糖尿病、高血压、高脂血症、起病到入院时间、右侧肢体偏瘫比例、发病前的改良Rankin量表(modified Rankin Scale,mRS)评分、吸烟、酗酒等因素比较,两组间差异无统计学意义(P>0.05),见表1。
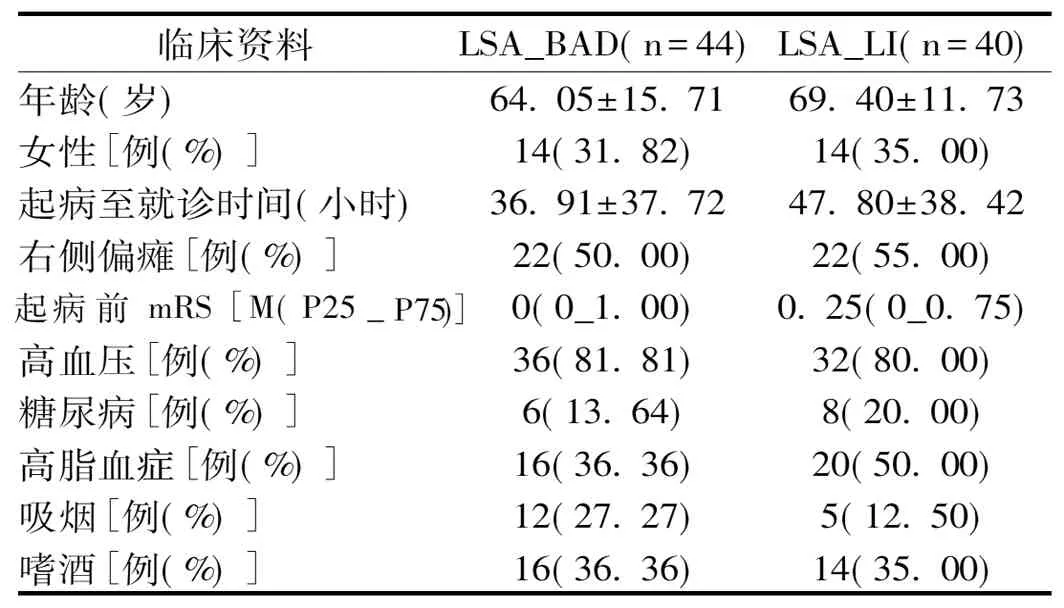
表1 两组患者基线水平比较
2.2 两组临床资料和日常生活能力及出、入院时NIHSS、Brs评分比较:两组患者入院及出院时的NIHSS、BI、Brs评分、住院时间比较差异均有统计学意义(P<0.05),LSA_BAD患者入院及出院时的NIHSS评分均更高,Brs、BI评分更低,住院时间更长,见表2。LSA_BAD患者出院时NIHSS、Brs、BI评分与入院时比较差异无统计学意义;LSA_LI患者出院时NIHSS评分比入院时低,而Brs、BI评分比入院时高,差异有统计学意义(P<0.05),见表2。

表2 两组患者临床资料和日常生活能力比较
注:与LSA_LI组比较*P<0.05;与入院评分比较#P<0.05
3 讨论
BAD的概念最早由Caplan教授于1989年提出,其病理学机制并非脂质透明样变,而是动脉粥样硬化。典型的BAD包括LSA_BAD、脑桥旁正中动脉BAD(PPA_BAD)及脉络膜前动脉BAD[6]。而只有LSA_BAD和PPA_BAD因其独特的影像学征象在临床上能被识别。本研究按照Hoshino等[5]提出的诊断标准选取LSA_BAD患者,与LSA_LI患者比较,发现两组患者在年龄、高血压、糖尿病、高脂血症、吸烟、酗酒等传统的脑卒中危险因素方面比较无统计学差异,这也与此前多项国内外研究结果一致[7,8]。因而,有无合并高血压、糖尿病、高脂血症,对鉴别LSA_BAD、LSA_LI并无特殊意义。
多项研究[7,9]表明BAD在急性期容易出现神经功能恶化,多表现为纯运动障碍,即进展型运动障碍,从而导致严重偏瘫,影响日常生活能力。Yamamoto等[7]比较了BAD和LI患者在起病后1个月的mRS,发现短期内BAD患者功能预后更差,且豆纹动脉供血区的BAD和进展型运动障碍及不良预后的产生明显相关。本研究通过比较LSA_BAD和LSA_LI患者入、出院时的NIHSS、BI和Brs评分,表明LSA_BAD患者在发病早期偏瘫症状更严重,日常生活活动能力更差,而通过急性期脑卒中单元的规范化治疗,LSA_BAD患者在急性期肢体运动及日常生活能力并无明显改善,短期内肢体运动能力及日常生活能力仍比LSA_LI患者更差,其短期转归明显不如LSA_LI患者,与此前研究一致。目前对于BAD患者早期神经功能恶化的原因并未完全明确,可能的原因有[10]:血流灌注不足,穿支动脉入口处粥样硬化斑块破裂损伤、致栓子脱落播散,血栓扩大使穿支动脉入口完全闭塞、甚至相邻穿支动脉受累等。已有的研究表明[11,12],常规用阿司匹林和/或氯吡格雷抗血小板聚集治疗并不能阻止部分BAD患者病情进展,而西洛他唑在BAD患者治疗中更具优势。同时,如脑卒中能早期被识别,在时间窗内进行静脉溶栓治疗对于BAD患者预后的改善也显著有效[13,14]。这意味着在临床工作中,早期识别BAD对于选择有效地治疗方法,正确判断预后有重要指示作用。
本研究显示LSA_BAD患者的平均住院日比LSA_LI患者更长,这表示LSA_BAD患者可能需要经过更长时间达到病情平稳。本研究中LSA_BAD患者最长住院时间为29天,而Niimi等[8]的研究认为,经过长达3个月及以上积极的功能康复锻炼,BAD患者在出院时的运动能力及肢体日常生活能力和LI患者相比无明显区别。同时,Suto等[15]研究发现BAD和LI患者3年内的死亡率和复发率无明显差异。上述研究表明如果经过更长时间的康复训练,LSA_BAD患者的肢体功能及日常生活能力有可能恢复到和LSA_LI患者一样的水平。本研究并未对入选病例进行长期随访,故而无法比较BAD和LI患者的长期预后,但从以往的国外研究来看,BAD患者的运动及日常生活能力通过较长时间的康复训练均能显著改善,长期预后良好。
本研究仍然存在一些缺陷和不足。首先,可能存在选择偏倚。如在设定排除标准时我们排除了心房颤动病史的缺血性脑卒中患者,但是这些患者的病因并非全都是心源性栓塞,故部分有心房颤动病史的BAD或LI患者并未能入选在内。其次,BAD采用的是影像学诊断标准,而MRI_DWI上梗死灶的大小随着时间不断变化,故而根据MRI_DWI上病灶大小区别BAD和LI存在一定争议。近年来逐渐发展的高分辨磁共振技术能有助于发现大脑中动脉和基底动脉的易损斑块,但其敏感性并不高,无法判断斑块性质、具体成分,尚无法在对BAD和LI的临床鉴别中展开应用。再次,本研究样本量偏少,疗效观察时间短,需进一步开展更大样本的队列研究,随访观察患者短期和长期预后。
总之,年龄、高血压、糖尿病、高脂血症、吸烟及酗酒危险因素对LSA_LI和LSA_BAD并无明确鉴别意义。与LSA_LI患者相比,LSA_BAD患者早期容易出现神经功能恶化,尤其表现为进展型运动障碍,且短期内LSA_BAD患者的运动能力及日常生活能力较LSA_LI患者差。
[1]Caplan LR. Intracranial branch atheromatous disease: a neglected, understudied, and underused concept[J]. Neurology,1989,39(9):1246-1250.
[2]Nakase T, Yamamoto Y, Takagi M, et al. The impact of diagnosing branch atheromatous disease for predicting prognosis[J]. J Stroke Cerebrovasc Dis,2015,24(10):2423-2428.
[3]Deguchi I, Hayashi T, Kato Y, et al. Treatment outcomes of tissue plasminogen activator infusion for branch atheromatous disease[J]. J Stroke Cerebrovasc Dis,2013,22(7):e168-e172.
[4]中国医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[5]Hoshino H, Takagi M, Yamamoto Y, et al. Neurological progression and clinical outcome of branch atheromatous disease (results from the J_BAD registry)[J]. Rinsho Shinkeigaku,2010,50(11):919-920.
[6]Kwan MW, Mak W, Cheung RT, et al. Ischemic stroke related to intracranial branch atheromatous disease and comparison with large and small artery diseases[J]. J Neurol Sci,2011,303(1-2):80-84.
[7]Yamamoto Y, Ohara T, Hamanaka M, et al. Characteristics of intracranial branch atheromatous disease and its association with progressive motor deficits[J]. J Neurol Sci,2011,304(1-2):78-82.
[8]Niimi M, Abo M, Miyano S, et al. Comparison of Functional Outcome between Lacunar Infarction and Branch Atheromatous Disease in Lenticulostriate Artery Territory[J]. J Stroke Cerebrovasc Dis,2016,25(9):2271-2275.
[9]Nakase T, Yamamoto Y, Takagi M, et al. The impact ofdiagnosing branch atheromatous disease for predictingprognosis[J]. J Stroke Cerebrovasc Dis,2015,24(10):2423-2428.
[10]彭想想,周志明.颅内分支动脉粥样硬化病变的治疗[J].国际脑血管病杂志,2016,24(8):756-759.
[11]Kamal AK, Naqvi I, Husain MR, et al. Cilostazol versus aspirin for secondary prevention of vascular events after stroke of arterial origin[J]. Stroke,2011,42(6):e382-e384.
[12]Nakase T, Sasaki M, Suzuki A. The effect of acute medication with cilostazol, an anti_platelet drug, on the outcome of small vessel brain infarction[J]. J Stroke Cerebrovasc Dis,2014,23(6):1409-1415.
[13]Deguchi I, Hayashi T, Kato Y, et al. Treatment outcomes of tissue plasminogen activator infusion for branch atheromatous disease[J]. J Stroke Cerebrovasc Dis,2013,22(7):e168-e172.
[14]朱仁洋,楼敏, 徐敏,等.穿支动脉区孤立性梗死静脉溶栓治疗研究[J].中华急诊医学杂志,2012,21(2):193-197.
[15]Suto Y, Nakayasu H, Maeda M, et al. Long_term prognosis of patients with large subcortical infarctions[J]. Eur Neurol,2009,62(5):304-310.
