二氧化锆对大鼠牙周膜细胞分子生物学行为的影响*
2018-03-12黄玉喜王莉莉张振庭李京荣刘洪良董海涛
黄玉喜 王莉莉 张振庭 李京荣 刘洪良 董海涛
全瓷冠如今已经逐渐发展成为了口腔固定修复的主要修复材料。在各类全瓷冠体系中,二氧化锆全瓷冠的机械性能、美学性能均得到临床的广泛认可。相对于金属烤瓷冠,特别是镍铬合金烤瓷冠、钴铬合金烤瓷冠的细胞毒性而言,全瓷冠的不良反应较少[1-3]。对于口腔修复材料的生物安全性,诸多学者都做了相关的研究,发现金属烤瓷冠中的金属成分对机体均存在某种形式的影响,无论何种金属均如此,即使在全瓷冠中,金属的含量也存在,但低于10%[4,5]。二氧化锆属于惰性陶瓷,不会引起细胞的转化,无细胞毒性、无诱变、致畸、致癌等作用,已有实验对二氧化锆全瓷冠的细胞生物学行为进行了评价,认为其生物相容性良好且安全性较高[6]。但有研究者发现在37℃的人工唾液中检测到有锆离子、钇离子的释放,甚至在酸性条件下,金属离子成分释放的更多[7]。此外,在二氧化锆的加工制作过程中也难免会有杂质的渗入。因此,对于二氧化锆的生物安全性有必要进行进一步的检测。目前,主要的研究多集中在二氧化锆全瓷冠的细胞生物相容性、细胞生物学行为方面,但二氧化锆与牙周膜细胞之间相互作用的分子生物学行为的机制研究并不多。本文将二氧化锆制作的浸提液作用于大鼠的牙周膜细胞,对其细胞活力、细胞凋亡、细胞周期、相关基因的表达影响如何等进行了评价,现报道如下。
1.材料和方法
1.1 主要试剂及材料 含10%胎牛血清的DMEM培养液;胰蛋白酶(Hyclone,美国);PBS(Amresco,美国);培养瓶、培养板(6孔、24孔、96孔)(Corning公司,美国);CO2孵箱(Shellab,美国);ZHJH-C1118C型超净工作台(上海智城分析仪器制造有限公司);CKX41型倒置相差显微镜;DT5-1低速离心机(北京时代北利离心机有限公司);5y2002型电子天平(上海良平仪器仪表有限公司);流式细胞仪(Beckman Coulter,美国);真空铸造机(ARGONCASTER-SE,Shofu,Japan);镍铬合金、钯银合金的相关材料(vita,美国);二氧化锆瓷块(WIELAND公司,德国);低速精密切割机(Isomet 4000,Buehler,美国);酶联免疫仪(Bio-Rad公司,美国);CCK-8试剂盒(Cell ProliferationAaaay,Promega公司,美国);Annexin V/PI凋亡检测试剂盒(BU-Annexin V-FITC Apoptosis Detection Kit,Biouniquer公司,美国);PCR扩增仪(2720,Applied biosystems,USA); Real-time qPCR 仪 (7500Fast, Applied biosystems,USA)。
1.2 实验方法
1.2.1 大鼠牙周膜细胞的培养及胚胎来源的鉴定 将SD大鼠的上下颌颌骨分离,取出其上下磨牙,漂洗10次。刮取磨牙根中1/3的牙周膜组织,剪碎,采用胰酶消化法,将牙周膜碎屑平铺于培养皿中置于CO2孵箱内(37℃,5%CO2,100%湿度)。当牙周膜细胞生长覆盖达到培养皿底约60%时,进行首次传代。对细胞进行胰酶消化,倒置显微镜下观察细胞的形态,当细胞回缩至圆形时,弃去胰酶,加入含l5%FBS的DMEM,反复吹打,制成细胞悬液,将此细胞悬液移入培养瓶中继续培养。当细胞再次长满瓶底时,对细胞进行传代。第4代细胞用于细胞来源鉴定及后续的实验。
1.2.2 实验分组及各组试件的制作 实验组(二氧化锆试件组);阳性对照组1(镍铬合金试件组);阳性对照组2(钯银合金试件组);阴性对照组(DMEM培养液组)。
于技工室按照烤瓷熔附金属修复体的制作要求在真空加氩气保护环境下对阳性对照组的合金材料进行熔铸,获得1cm×1cm×3mm的阳性对照组试件。利用低速精密切割机将二氧化锆瓷块在喷水冷却条件下切割成1cm×1cm×3mm的实验组试件。将所得的所有合金试件经碳化硅砂纸(P240-P1200)由粗到细进行抛光,后置于95%的乙醇溶液中超声清洗20min,再去离子水漂洗10min,无油无水压缩空气吹干,经环氧乙烷灭菌后备用。
1.2.3 各组材料浸提液的制备 按照试件表面积与细胞培养液之比为0.5cm2/ml的标准,在6孔板中每孔加入6.4ml的DMEM培养液,置于CO2孵箱内(37℃、5%CO2、100%湿度的条件下),浸提96h后备用。
1.2.4 细胞活性检测——Cell Counting Kit-8取第四代大鼠牙周膜细胞,经胰酶消化后,用含10%胎牛血清的DMEM培养液调整细胞浓度至5×104/ml,接种于96孔板中,每孔100μL。待细胞贴壁后,弃去原培养液,按各自的分组,将不同组的浸提液加入每孔中,每孔浸提液100μL,每组设5个复孔。将其置入CO2孵箱内预培养24h、48h、72h。终止实验时,将孔板内注入10μL CCK-8溶液,孵箱内继续培养2h后,30min内在酶标仪上读取吸光光度值OD490nm。
细胞增殖抑制率(%)=(1-实验组吸光度值均数/对照组吸光度值均数)×100%。
1.2.5 细胞凋亡检测——Annexin V/PI双染色法 取第四代大鼠牙周膜细胞,经胰酶消化后,用含10%胎牛血清的DMEM培养液调整细胞浓度至5×105/ml,接种于96孔板中,每孔100μL。待细胞贴壁后,弃去原培养液,按各自的分组,将不同组的浸提液加入每孔中,每孔浸提液100μL,每组设5个复孔。将其置入CO2孵箱内预培养48h后,收集细胞,将细胞浓度调整为1×106/ml,以PBS离心2000rpm,5min,洗涤2次,收到约5×105个细胞。将处理所得细胞取出一部分,加入500μL的Annexin V Bingding Buffer悬浮细胞,再加入5μL的Annexin V-FITC混匀后,加入5μL Propidiumlodide混匀、避光下,染色30min,在流式细胞仪以激发波长488nm、发射波长530nm检测细胞早期凋亡率、晚期凋亡率、总凋亡率。将处理所得的另一部分细胞70%冰乙醇固定后加入PI在室温下进行避光染色,应用流式细胞仪测定细胞的不同细胞周期的比例。
1.2.6 凋亡相关分子表达量的检测 取第四代大鼠的牙周膜细胞,按传代的方法将其制成单细胞悬液,调整细胞浓度至4×105个/ml,接种于六孔板中,待细胞长满约孔板底的80%左右时,以不含胎牛血清的DMEM培养液置换,血清饥饿24h,使细胞周期同步化。阴性对照组以新鲜培养液置换,其余各组分别用各组试件的浸提液置换并标记,置于CO2孵箱内培养48h。抽提RNA,依照相应试剂盒进行操作,反应得到cDNA,而后进行PCR的扩增,扩增的基因包括Caspase-3,Caspase-8,Caspase-9,根据扩增曲线计算mRNA的相对表达量(2-ΔΔCT值)。
1.3 统计分析 采用SPSS22.0统计软件对数据进行分析,计量资料以均数±标准差表示,各组间均数的比较采用单因素方差分析和SNK-q检验,P<0.05为差异有统计学意义。
2.结果
2.1 各组材料浸提液对大鼠牙周膜细胞形态的影响 大鼠牙周膜细胞在各组浸提液中培养48h后,DMEM培养液组中为正常牙周膜细胞形态,呈长梭形或多角星形;二氧化锆组的细胞形态亦呈梭形或多角形,贴壁生长且轮廓清晰,核浆比例正常,胞质均匀;钯银合金组的细胞生长状态亦良好,偶见脱落的悬浮细胞;镍铬合金组的细胞部分贴壁生长,有部分细胞呈圆形或不规则形态,胞膜增厚,胞质内出现空泡,还可见一些质膜崩解、核膜破裂的死亡细胞(见图1)。

图1 不同材料浸提液对大鼠牙周膜细胞培养48h的形态观察
2.2不同时间点的各组材料浸提液对大鼠牙周膜细胞活性的影响 应用CCK-8法检测不同时间点的各组材料浸提液对大鼠牙周膜细胞活性的影响,由表1可以看出,24h时二氧化锆组、钯银合金组抑制率分别为1.40%和2.75%,与DMEM阴性对照组三者之间两两比较,均无统计学差异(P>0.05),而镍铬合金组抑制率13.41%明显高于其余各组,差异均有统计学意义(P<0.05)。48h时,DMEM组、二氧化锆组、钯银合金组的OD值都略有增长,与DMEM阴性对照组三者之间两两比较,均无统计学差异(P>0.05),但镍铬合金组OD值增长缓慢,高于其余各组,与其余各组相比均有统计学差异(P<0.05)。随着时间的增长,当72h时,二氧化锆组、钯银合金组的OD值依旧在增长,与DMEM阴性对照组三者之间两两比较,均无统计学差异(P>0.05),镍铬合金组OD值基本无增长,而抑制率已经达到了22.42%,明显高于其余各组(P<0.05)。

表1 CCK-8法检测不同时间点的各组材料浸提液对大鼠牙周膜细胞活性的影响(n=5,x¯±SD,%)
2.3 各组材料浸提液对大鼠牙周膜细胞凋亡的影响 流式细胞仪检测了各组材料浸提液对大鼠牙周膜细胞凋亡的影响。结果发现,各组材料浸提液作用于大鼠牙周膜细胞48h后,早期细胞凋亡率二氧化锆组最低,为0.51%,钯银合金组次之,镍铬合金组最高,达到17.72%,二氧化锆组、钯银合金组、镍铬合金组三者间两两比较均有统计学差异(P<0.05)。晚期细胞凋亡率、总凋亡率也如此,二氧化锆组、钯银合金组与镍铬合金组两两比较均有差异(P<0.05)(见表2,图2)。
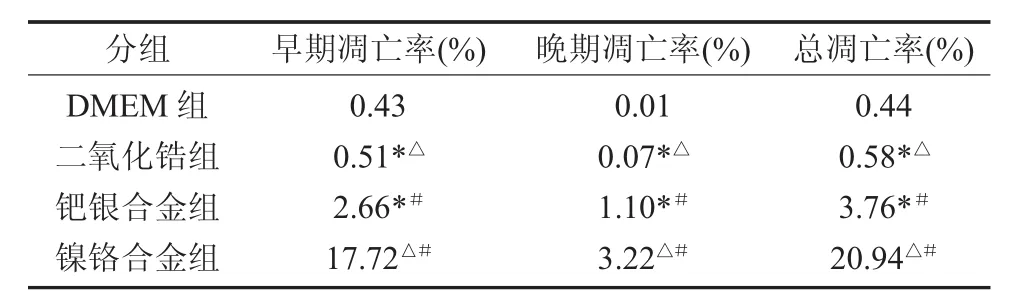
表2 各组材料浸提液对大鼠牙周膜细胞凋亡率的影响(n=5,%)
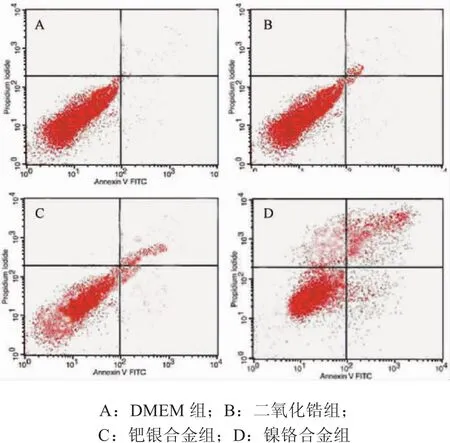
图2 各组材料浸提液对大鼠牙周膜细胞凋亡率的检测
2.4 各组材料浸提液对大鼠牙周膜细胞细胞周期的影响 各组材料浸提液作用于大鼠牙周膜细胞48h后,DMEM组的G0/G1期细胞周期比例最低,Prl指数最高。二氧化锆组与DMEM组的G0/G1期细胞周期比例无统计学差异(P>0.05),钯银合金组、镍铬合金组的G0/G1期均高于前两组,且差异有统计学意义(P<0.05),钯银合金组与镍铬合金组之间的G0/G1期无统计学差异(P>0.05)。Prl指数从高到低依次为二氧化锆组、钯银合金组、镍铬合金组,钯银合金组、镍铬合金组与二氧化锆组相比,均有统计学差异(P<0.05),钯银合金组与镍铬合金组之间的Prl指数无统计学差异,见表3。
2.5 不同浸提液组处理对大鼠牙周膜细胞Caspase含量的影响 各组Caspase-3的 2-ΔΔCT值从数值上看由大到小依次为:镍铬合金组>DMEM组>钯银合金组>二氧化锆组,二氧化锆组、钯银合金组mRNA的相对表达量低于DMEM组,差异无统计学意义(P>0.05),镍铬合金组mRNA的相对表达量高于DMEM组,差异有统计学意义(P<0.05)。各组 Caspase-8 的 2-ΔΔCT值从数值上看由大到小依次为:DMEM组>镍铬合金组>二氧化锆组>钯银合金组,二氧化锆组、钯银合金组、镍铬合金组的mRNA相对表达量均低于DMEM组,但二氧化锆组、钯银合金组与DMEM组差异有统计学意义(P<0.05),二氧化锆组与钯银合金组之间差异无统计学差异(P>0.05),镍铬合金组高于二氧化锆组、钯银合金组,差异有统计学意义(P<0.05)。各组 Caspase-9 的 2-ΔΔCT值从数值上看由大到小依次为:镍铬合金组>DMEM组>二氧化锆组>钯银合金组,二氧化锆组、钯银合金组mRNA的相对表达量低于DMEM组,差异无统计学意义(P>0.05),镍铬合金组mRNA的相对表达量高于DMEM组,差异有统计学意义(P<0.05)。具体见表4。
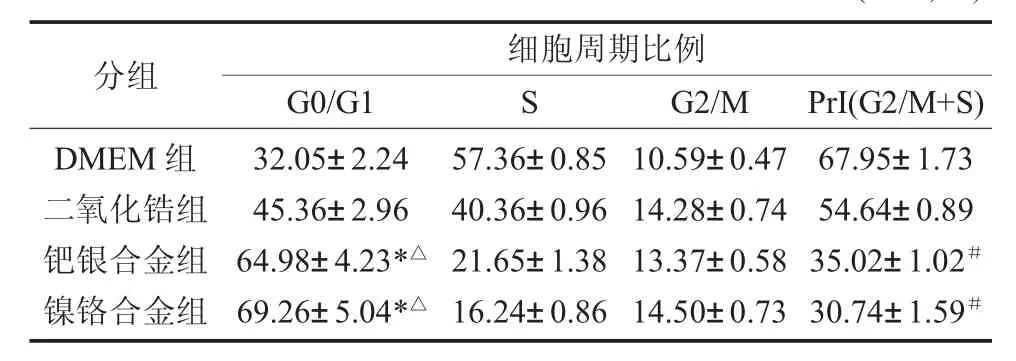
表3 各组材料浸提液对大鼠牙周膜细胞细胞周期的影响(n=5,%)

表4 不同浸提液组处理对大鼠牙周膜细胞CaspasemRNA相对表达量(2-ΔΔCT 值)的比较(x¯±SD, n=5)
3.讨论
全瓷冠与金属烤瓷冠在用于临床牙冠修复时,不仅要考虑修复材料的耐磨性及强度外,还应考虑材料的生物相容性。金属烤瓷冠的物理强度是可以满足临床冠修复的要求,但是对于牙龈的刺激性不容忽视。全瓷冠的组织相容性及耐腐蚀性均较理想,即使在龈沟液的持续作用下也基本不会有金属离子的析出,因此对牙周组织的损伤较小[8]。对于二氧化锆的研究,国内外多集中在它的细胞生物相容性、细胞生物学行为方面,例如细胞增殖率、毒性的分级、溶血能力等[9,10],但对于其为何会产生如此结果的分子生物学行为,研究甚少。本研究从分子生物学行为入手,研究分析了二氧化锆全瓷冠、钯银合金烤瓷冠、镍铬合金烤瓷冠浸提液对大鼠牙周膜细胞的活性、细胞周期、凋亡及相关mRNA的表达的影响。
近年来,越来越多的实验证实,牙周膜成纤维细胞的功能异常与牙周炎的发生、牙槽骨的吸收有密切的联系,不同材料制作出的浸提液作用于牙周膜细胞,其损伤程度基本能反映出不同修复材料对牙周组织的损伤程度[11]。本实验培养了大鼠的牙周膜细胞,经二氧化锆全瓷冠、钯银合金烤瓷冠、镍铬合金浸提液处理后,以CCK-8法检测细胞的活性。经活力分析可知,二氧化锆组、钯银合金组、DMEM组OD值两两比较均无统计学差异(P>0.05),而镍铬合金组OD值明显高于其余各组,差异均有统计学意义(P<0.05),说明二氧化锆全瓷冠、钯银合金烤瓷冠不会造成牙周膜细胞的损伤。流式细胞术是通过对DNA含量的计算来推算出细胞所处的细胞周期。所以,流式细胞术只能将G0/G1、S期、G2期的细胞区分开。细胞的Pr I指数为G2/M与S期占细胞总量的比例,它能够反映细胞对DNA的复制能力。在流式细胞仪对细胞周期的检测中也发现,能够反映细胞增殖活力的Pr I指数,二氧化锆的表现优于钯银合金及镍铬合金,这也从另一方面说明了二氧化锆对细胞周期没有抑制作用。
细胞凋亡是一个极复杂,且受控于多种基因的死亡过程,它大体可以分为三个阶段:起始阶段、效应阶段、清除阶段。它是一系列导致细胞解体的分子级联反应,它需要凋亡受体的激活,凋亡诱导因子的活化,转导后引起线粒体的变化,随着核酸内切酶被激活,细胞即出现凋亡特有的表现,直至形成凋亡小体[12]。有学者提出,观察细胞总RNA量结合细胞毒性实验、分子生物学实验可以作为综合评价材料生物相容性的参考[13]。有学者应用RT-PCT方法来研究材料与细胞的交互过程,发现监测细胞的mRNA表达量可以作为反映细胞与材料间生物相容性的有效手段之一[14]。天冬氨酸特异性半胱胺酸蛋白酶(Caspases)家族是线粒体凋亡通路下游重要的执行分子。Caspases-3、Caspases-8、Caspases-9均属于Caspases家族。Caspases-8、Caspases-9作为启动者,当得到信号时,可通过自剪接激活,从而引发Caspase的级联反应,此时细胞凋亡开始;Caspases-3作为执行者,可使细胞内的结构蛋白、功能蛋白发挥作用,引起凋亡,但它不参与自剪接,这提示我们,可能仍存在其他的凋亡因子或凋亡途径参与了细胞的凋亡反应[15]。本文对二氧化锆、钯银合金、镍铬合金浸提液处理后的细胞Caspases-3、Caspases-8、Caspases-9 mRNA相对表达量进行了检测,发现Caspase-3、Caspase-9 的 2-ΔΔCT值,二氧化锆组、钯银合金组与DMEM组差异无统计学意义(P>0.05),镍铬合金组高于DMEM组,差异有统计学意义(P<0.05)。各组 Caspase-8 的 2-ΔΔCT值,二氧化锆组、钯银合金组与DMEM组差异有统计学意义(P<0.05),二氧化锆组与钯银合金组之间差异无统计学差异(P>0.05),镍铬合金组高于二氧化锆组、钯银合金组,差异有统计学意义(P<0.05),二氧化锆、钯银合金的 Caspases-3、Caspases-8、Caspases-9 mRNA相对表达量并未增多,这与李菊等研究结果相似,二氧化锆不会增加 Caspases-3、Caspases-8、Caspases-9 mRNA相对表达量[16];而镍铬合金的 Caspases-3、Caspases-8、Caspases-9mRNA相对表达量较高,这与林泓磊、王学等[17,18]利用流式细胞仪得出的镍铬合金会诱导细胞凋亡的结果相一致。由此,本研究认为,镍铬合金诱导细胞发生凋亡可能是由内源性途径转导细胞凋亡的信号,从而引发了细胞的凋亡。
综上所述,二氧化锆在提高细胞增殖活力,抑制细胞凋亡方面优于钯银合金及镍铬合金材料,其良好的生物相容性,不会影响牙周膜细胞的细胞活力、细胞周期、细胞凋亡以及相关基因的表达。但本实验只对内源性的少数几个相关基因的mRNA表达进行了研究,信号通路的传导是一个复杂的过程,是否存在其它的凋亡因子或凋亡途径仍需进一步的研究。
[1]Nayar S,Aruna U,Bhat WM.Enhanced aesthetics w ith all ceramics restoration[J].JPharm Bioallied Sci,2015,7(Suppl 1):S282-S284
[2] Bavbek AB,Özcan M,Eskitascioglu G.Radioactivepotential of zirconium-dioxide used for dental applications[J].J Appl Biomater Funct Mater,2014,12(1):35-40
[3] Zhu DB,Liang JP,Qu YX,et al.Functionalized bioartifactfabricated via selective slurry extrusion.Part 2:fabrication of ceramic dental crow n[J].JNanosci Nanotechnol,2014,14(5):3703-3706
[4]Pjetursson BE,Thoma D,Jung RA,et al.Systematic review of the survival and complication rates of implant-supported fixed dentalprostheses(FDPs)after a mean observation period of at least 5 years[J].Clin Oral Implants Res,2012,23 Suppl 6:22-38
[5] Hey J,Beuer F,Bensel T,et al.Single crow ns with CAD/CAM-fabricated copings from titanium:6-year clinical results[J].JProsthet Dent,2014,12(2):150-154
[6] Han JM,Hong G,Matsui H et al.The surface characterization and bioactivity of NANOZR in vitro[J].Dent Mater J,2014,33(2):210-219
[7]Yang R,Arola D,Han ZA,et al.Comparison of thefracture resistance of three machinable ceramics after thermal and mechanical fatigue[J].JProsthet Dent,2014,112(4):878-885
[8] Pradies G,Zarauz C,Valverde A,et al.Clinical evaluation comparing the fit of all-ceramic crowns obtained from silicone and digital intraoral impressions based on w avefront sampling technology[J].JDent,2015,43(2):201-208
[9]要炳文,张光磊,田秀淑,等.牙科全瓷修复用长石瓷的生物相容性评价[J].2008,12(14):2671-2674
[10]Zhang B,Chen JH,Gao JQ,et al.Microstructureanalysis of a composite system composed of zirconia/alumina composites and vita alpha coating-glass for dental applications[J].Key Eng Mater,2007,336:1599-1602
[11]石 磊,杨 亮,黄捷淳.In-Ceram全瓷冠与金属烤瓷冠对成纤维细胞株L929细胞活力及相关基因表达的影响[J].海南医学院学报,2016,22(8):829-832
[12]谢晓莉.LTA及LPS对人牙周膜细胞凋亡和炎性细胞因子的影响[D].中南大学,2010
[13]宁 丽,刘 俊,叶莉明,等.从生物材料对细胞总RNA量的影响初探其分子生物相容性[J].上海生物医学工程,1998,19(4):6-9
[14]Kato S,Akagi T,Sugimura K,et al.Evaluation of biological response to polymeric biomaterials by PT-PCR analysis IV:study of c-myc,c-fosand p53 mRNA expression[J].Biomaterials,2000,21(5):521-527
[15]冯翠娟,张 雪,王 强,等.表面氧化镍钛合金对L-929细胞凋亡、总RNA量及caspase-3,8,9 mRNA表达影响的研究[J].口腔医学,2011,31(1):19-24
[16]李 菊,徐近源,王振国.不同全瓷冠材料对成纤维细胞活力的影响及可能分子机制的初步探究[J].海南医学院学报,2016,22(4):400-404
[17]林泓磊.反复熔铸对非镍基烤瓷合金细胞毒性的影响及其机制的研究[D].福建医科大学,2012
[18]王 学,章非敏,刘 梅,等.5种牙体修复材料对L929细胞凋亡及相关基因的影响[J].华西口腔医学杂志,2010,28(3):250-253
