固相微萃取-气质联用法测定饮用及地表水样中6种多环芳烃
2018-03-10潘永红叶元坚蔡锦安袁嘉伟郭永翔
潘永红,叶元坚,蔡锦安,陈 志,袁嘉伟,郭永翔
(广州质量监督检测研究院,广东 广州 511447)
多环芳烃化合物(Polycyclic Aromatic Hydrocarbons,简称PAHs)是两个或两个以上苯环以稠环形式相连的一类化合物,由于其具有“致癌、致畸和致基因突变”的三致特性的持久性有机污染物,已被世界各国列为优先控制的环境污染物[1]。PAHs以痕量浓度广泛分布于自然水体中。而水体中PAHs的含量直接危及人们的身体健康,因此,检测水体中PAHs的含量具有重要意义。
固相微萃取技术(Solid-phase microextraction SPME)是一项集采样、萃取、浓缩、进样于一体的样品前处理与富集技术,具有操作简单,无溶剂消耗等诸多优点,已在多个领域得到广泛应用[2-3]。利用SPME技术测定水体中多环芳烃已有研究[4-6],但针对几种常见的PAHs进行萃取优化的研究不多。本文利用SPME技术,建立了SPME-GC-MS测定饮用及地表水中6种常见的PAHs的方法。该方法操作简单,具有快速、简单和环保等特点。
1 试验部分
1.1 仪器和试剂
Agilent 7890B-5977A气质联用仪、配EI源检测器。固相微萃取装置及萃取头:100 μm PDMS(polydimethylsiloxane);75 μm CAR/PDMS(carboxen/polydimethylsiloxane)、85 μm PA(polyacrylate),(美国Supelco公司)。
试剂:多环芳烃标准样品(甲醇介质):浓度均为100 g/L,含萘、苊烯、苊、芴、菲、蒽,实验用水为二次蒸馏水。
1.2 仪器工作条件
1)色谱条件:DB-EUPAH色谱柱(20 m×180 μm×0.14 μm);柱升温程序:初始温度70 ℃,保持2 min,以15 ℃·min-1升至170 ℃后,用10 ℃·min-1升至300 ℃,保持7min。载气及流速:高纯氦气,流速1.0 mL·min-1;进样口温度:270 ℃;进样方式:不分流进样。
2)质谱条件:电离方式:EI源;电离能量:70 eV;离子源温度:300 ℃;扫描方式:选择离子扫描(SIM),溶剂延迟:5 min;各物质特征选择离子参数见表1。

表1 6种化合物质谱参数
1.3 固相微萃取实验方法
使用前萃取头需置于GC-MS进样口,在载气保护下260 ℃老化0.5 h以去除原有杂质。往带有磁力搅拌子的样品瓶中加入水样,将SPME萃取头浸入试液中,在30 ℃下萃取40 min后取出,然后将萃取头插入GC-MS进样口进行解析检测。
2 结果与讨论
2.1 萃取条件的优化
本研究对萃取涂层、萃取时间、搅拌速度及萃取温度四个影响固相微萃取效果较大的因素进行了优化。当对一个因素进行优化时,其余因素均采用最佳条件,使用溶液为1.0 μg·L-1的多环芳烃混合标准溶液。
2.1.1 萃取涂层
实验比较了85 μm PA、100 μm PDMS及75 μm CAR/PDMS不同萃取涂层对6种PAHs的萃取效果,所得结果见图1。由图可见,不同涂层对6种PAHs的萃取能力顺序为PA>PDMS> CAR/PDMS。该结果表明:虽然已知PAHs主要属于非极性化合物,但萘、苊烯、苊、芴、菲、蒽仍具有一定的极性[3],PA涂层效果优于PDMS。因此,本实验后续研究采用PA涂层的萃取头进行。
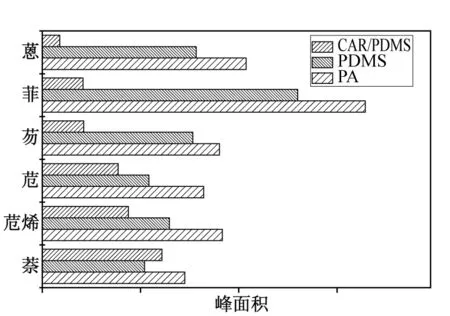
图1 不同萃取头萃取效果比较图
2.1.2 萃取时间
比较了10、20、30、40和60 min五个不同萃取时间的萃取效果,所得结果见图2。由图可见,随着萃取时间的增加,富集量逐渐增多。在40 min后,SPME富集能力增加趋势有所减缓,考虑到节省时间成本提高实验效率,本研究最终选取40 min作为SPME萃取时间。
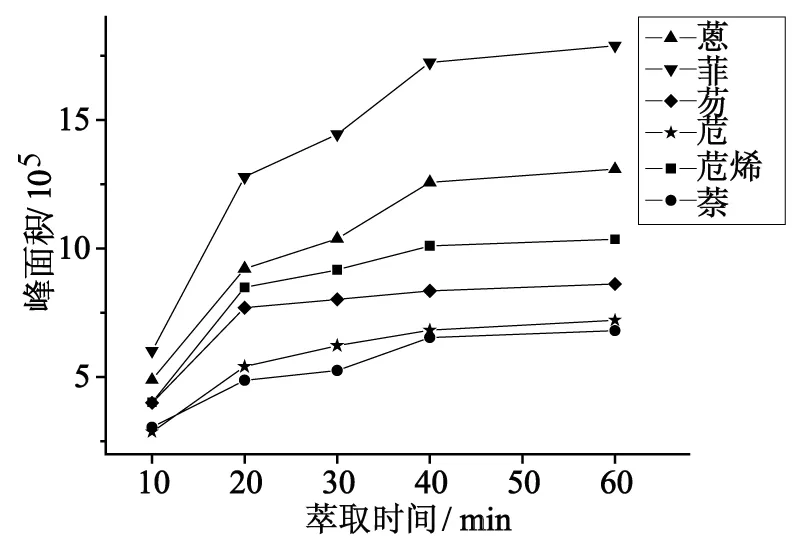
图2 萃取时间对富集的影响
2.1.3 萃取温度

图3 萃取温度对富集的影响
比较了20 ℃、30 ℃和40 ℃ 三个萃取温度的萃取效果,所得结果见图3。由图可见,随着温度的增加,萃取效果也增大,但超过30 ℃后,部分化合物萃取效果反而有所降低,这是因为温度的改变影响了目标物在萃取涂层及水相之间分配系数大小及扩散速率[7]。在20~30 ℃阶段,萃取主要受动力学影响,温度越高扩散速率越大;当温度超过30 ℃,涂层中的分配系数开始变小,富集到涂层上的目标物开始变小,因此反而降低了整体萃取效果。综上所述,本实验选取30 ℃为实验萃取温度。
综合以上优化条件,图4为选用PA萃取涂层,在最优条件下萃取1 μg·L-16种PAHs混标所得选择离子监测色谱图(SIM)。

图4 混合标准溶液的选择离子监测色谱图
2.2 线性范围、检出限和精密度
将PAHs标准溶液用水逐级稀释,配制成浓度为0.02~2.0 μg/L的系列标准溶液。在优化的实验条件下进行分析,以浓度为横坐标,各目标物响应的峰面积为纵坐标绘制标准曲线。以1.0 μg/L的PAHs标准溶液平行测定6次,计算萃取方法的相对标准偏差(RSD)。逐级稀释标准溶液,以各物质的特征离子峰信噪比S/N≥3确定方法的检出限(LOD)。所得结果见表2。由表可见,各目标化合物线性方程相关系数r范围为0.9976~0.9996;RSD(n=6)为5.3%~9.8%;检出限为0.006~0.008 μg/L。

表2 方法的相关系数、线性范围、检出限和精密度
2.3 样品实测
对本地饮用水进行取样,并对珠江水进行取样,使用本方法检测饮用水及江河水中PAHs含量情况。结果发现,饮用水源中未见多环芳烃检出;而珠江水中仅萘、菲和蒽有痕量检出,含量分别为0.12、0.04和0.02 μg/L。
3 结论
本文建立了固相微萃取-气相色谱-质谱法测定水样中6种多环芳烃的方法。针对所测定的6种PAHs,提出使用PA萃取涂层具有更好的选择性。通过研究萃取时间、搅拌速度及萃取温度对萃取效果的影响找到最优萃取条件。并用该方法对饮用水及地表水进行了测试,该方法前处理简单,可快速用于水样中多环芳烃的检测,对于水体中PAHs的检测具有一定的实用意义。
[1]杨若明.环境中有毒有害化学物质的污染与监测[M]. 北京:中央民族大学出版社,2001:21-178.
[2]李学博,周海梅,李 朴,等. SPME-GC-MS法快速检测尿液中的甲基苯丙胺[J].中国法医学杂志,2010,25(4): 252-254.
[3]吴惠勤,黄晓兰,陈江韩,等.SPME/GC-MS鉴别地沟油新方法[J].分析测试学报,2012,31(1):1-6.
[4]陶敬奇,王超英,李碧芳,等.固相微萃取-高效液相色谱联用分析环境水样中的痕量多环芳烃[J].色谱,2003,21(6):599-602.
[5]罗世霞,朱淮武,张笑一.固相微萃取-气相色谱法联用分析饮用水源水中的16种多环芳烃[J].农业环境科学学报,2008,27(1):395-400.
[6]原文婷,梁 峰,高占啟,等.固相微萃取-气相色谱-质谱联用测定水体中多环芳烃[J].环境化学,2014(5):819-825.
[7]Jinno K,Muramatsu T,Saito Y, et al. Analysis of pesticides in environmental water samples by solid-phase micro-extraction-high-performance liquid chromatography[J]. Journal of Chromatography A,1996,754(1-2):137.
