DEHP对高脂饮食大鼠血脂代谢的影响
2018-03-10杨振华陈云竹张月霞弓晓娟张全喜孟紫强鲜明董川
杨振华,陈云竹,张月霞,弓晓娟,张全喜,孟紫强,鲜明,董川
(山西大学 环境科学研究所,山西 太原 030006)
0 引言
邻苯二甲酸酯(PAEs)作为一类典型的环境内分泌干扰物(EDCs),常在各种聚氯乙烯塑料制品和医疗耗材中用作增塑剂,其中邻苯二甲酸二(2-乙基己基)酯(DEHP)是使用最多的增塑剂之一[1-3]。这类型化合物可通过饮食、饮水、呼吸、皮肤接触等途径进入机体,进而对人群健康造成不同程度的危害[4-5]。代谢综合征(MS)是集胰岛素抵抗、高血糖、高血压、血脂紊乱和肥胖症等多种代谢紊乱为一体的一种临床综合征[6-8],其发病率的急剧增高除了与遗传、饮食不均衡及运动减少等因素有关外[7-8],EDCs暴露也是其重要诱因[9]。Hatch等[10]证实了包括DEHP在内的PAEs暴露会增加MS的发生概率。
目前,肥胖已成为一个全球性的日益严重的健康问题[11]。流行病学研究表明,PAEs暴露可能会增加胎儿、婴儿、青少年群体的肥胖发生风险[12-13]。Kim等[14]发现婴儿早期DEHP暴露也与肥胖发生有关。此外,Bluher[15]和Dyck[16]研究发现代谢综合征和肥胖都与脂代谢紊乱存在非常密切的关系,主要表现在:(1)载脂蛋白B、甘油三酯(TG)、总胆固醇(TC)水平升高;(2)高密度脂蛋白胆固醇(HDL-C)水平降低;(3)低密度脂蛋白胆固醇(LDL-C)水平轻度升高,而且一些脂源性调控因子也与该过程有关。鉴于此,本文通过灌胃染毒方法研究了DEHP对高脂饮食大鼠血脂代谢的影响,为进一步研究DEHP对代谢综合征的影响提供借鉴。
1 材料与方法
1.1 实验仪器与试剂
SPECTRAmax M5型多功能酶标仪(Molecular Devices公司);U-3010型紫外-可见分光光度计(日本日立有限公司)。
DEHP纯度≥99.5%,由美国Sigma公司提供;丙氨酸氨基转移酶(ALT)、LDL-C、HDL-C、TG和TC试剂盒均购自南京建成生物工程研究所;大鼠瘦素(Leptin)试剂盒和大鼠脂联素(Acrp30)试剂盒均购自上海西唐生物科技有限公司。
1.2 实验动物及其分组处理
健康清洁级Wistar雄性大鼠30只,体重180~200 g,购自河北医科大学实验动物中心。动物饲养环境为:温度24±2℃,湿度(50±5)%。适应性喂养一周后,将大鼠随机分为5组,每组6只:(1)对照组,(2)高脂组,(3)高脂+10 mg/kg DEHP组,(4)高脂+100 mg/kg DEHP组,(5)高脂+300 mg/kg DEHP组。对照组饲以普通饲料,其余4组饲以高脂饲料[17-18](质量百分比分别为:基础饲料79%、胆固醇3.5%、猪油12%、胆酸钠0.5%、白糖5%)的同时,每天分别给予0,10,100,300 mg/kg的DEHP进行灌胃染毒。DEHP溶解于玉米油中以配制不同的浓度。记录大鼠初始体重,5周后记录最终体重、体长、腰围等体质指标,将大鼠用戊巴比妥钠麻醉处死,心脏取血,剥离大鼠肾脏、肝脏和附睾周脂肪,称重后置于液氮,最后于-80 ℃冰箱保存备用。
1.3 血清指标检测
心脏取血,室温放置2 h,4℃下3 000 r/min离心15 min,取上清即得大鼠血清。用生物化学法和酶联免疫法分析血清中TG,TC,HDL-C,LDL-C,Leptin,Acrp30,ALT水平。
1.4 数据统计与处理
所有数据均以均值±标准差表示。用SPSS 19.0对数据进行统计处理,组间差异用one-way ANOVA法进行检验,均数间多重比较采用最小显著差异法(LSD)。P<0.05 表示差异显著。若两组数据后标注的字母(a,b,c,d)至少有一个相同,则说明两组数据差异不显著;否则,两组数据差异显著。
2 结果
2.1 DEHP对高脂饮食大鼠体质指标及脏器的影响
由表1可看出,相对于高脂组,10 mg/kg和300 mg/kg DEHP组大鼠的Lee’s指数明显下降(P<0.05),而且300 mg/kg DEHP组大鼠的腰围显著减小(P<0.05)。另外,对于体重增量,三个剂量DEHP组相对于高脂组和对照组均有所减少,但无统计学差异(P>0.05)。
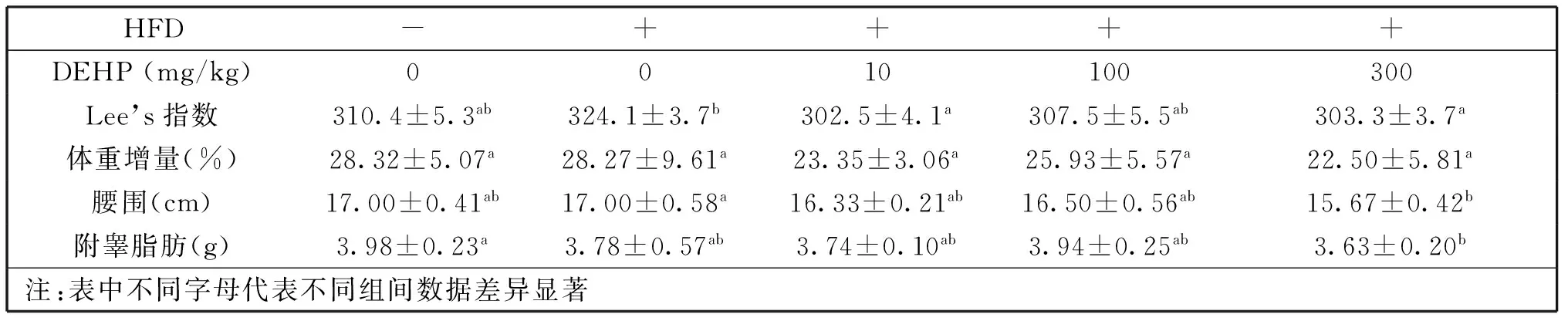
表1 大鼠体质指标
从图1A和1B可知,高脂组大鼠肝重、肝体比相对于对照组显著增大(P<0.05),且高脂饮食大鼠的肝重随着DEHP剂量增加而增加,但无统计学差异(P>0.05)。300 mg/kg DEHP组大鼠的肝体比相对于其他4组显著增大(P<0.05)。300 mg/kg DEHP组大鼠肾体比显著高于高脂组(P<0.05)。另外,与高脂组相比,高脂+DEHP组大鼠血清中ALT含量无明显变化(图2)。

Fig.1 Effect of DEHP on weight (A) and organ/body weight ratio (B) of liver and kidney in HFD rats图1 DEHP对高脂饮食大鼠肝重与肾重(A)和肝体比与肾体比(B)的影响
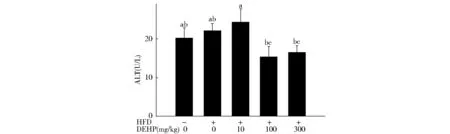
Fig.2 Effect of DEHP on the level of ALT in serum in HFD rats图2 DEHP对高脂饮食大鼠血清中ALT含量的影响
2.2 DEHP对高脂饮食大鼠血脂的影响
从图3A、3B可看出,与对照组相比,单纯高脂饮食对大鼠TG和TC含量无明显影响,但经DEHP染毒后,大鼠体内TG和TC含量发生显著变化(P<0.05)。与高脂组相比,10 mg/kg DEHP会使TG和TC含量显著升高(P<0.05),300 mg/kg DEHP组TG和TC含量显著降低(P<0.05)。由图3C可知,与对照组相比,单纯高脂饮食会导致大鼠体内LDL-C含量显著下降(P<0.05),与高脂组相比DEHP暴露使大鼠体内LDL-C含量显著提高(P<0.05)。从图3D可发现,与对照组相比,高脂饮食会使大鼠体内HDL-C含量显著下降(P<0.05),且DEHP暴露未对高脂饮食大鼠体内HDL-C含量产生影响(P>0.05)。
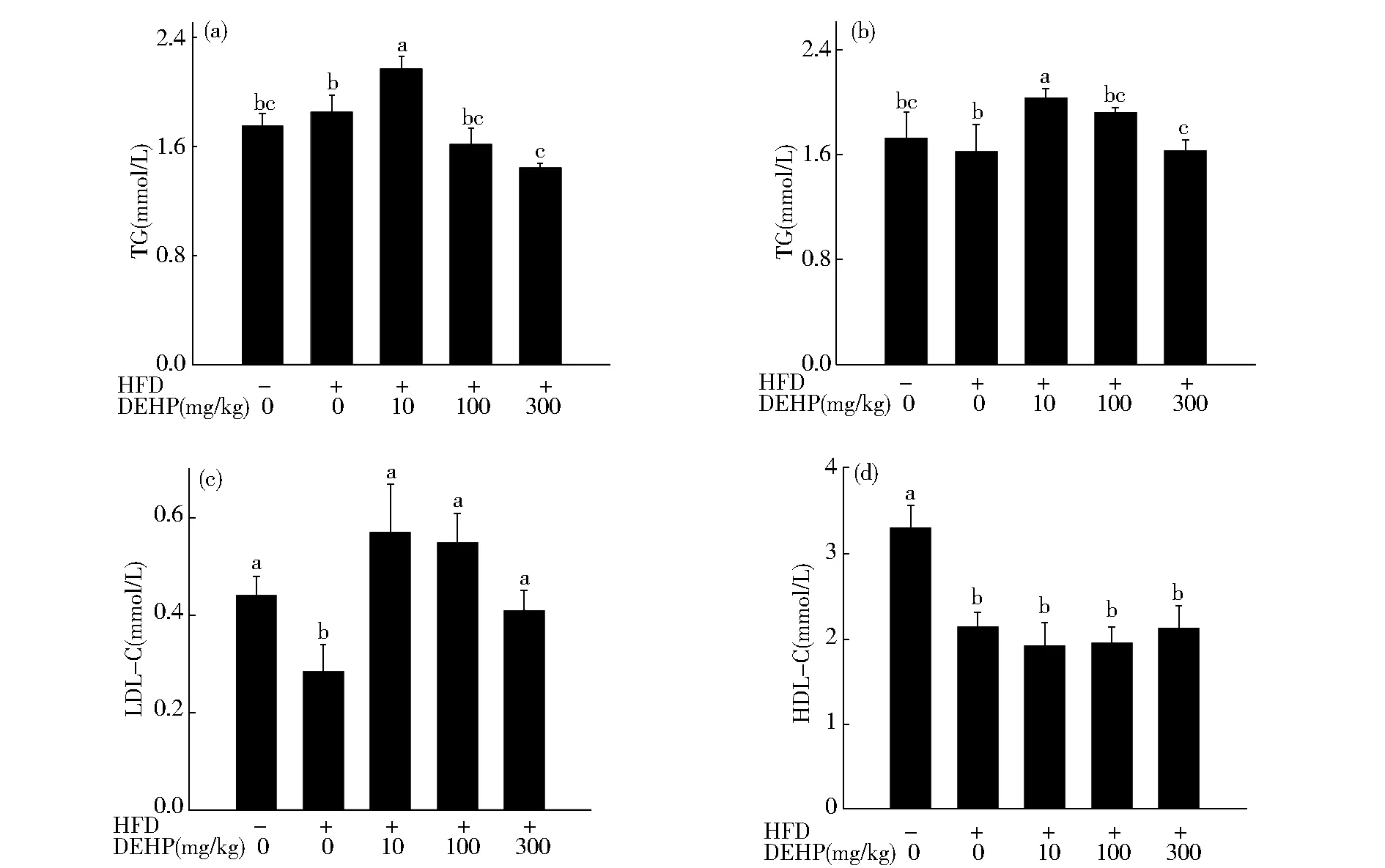
Fig.3 Eeffect of DEHP on levels of TG (A), TC (B), LDL-C (C) and HDL-C (D) in HFD rats图3 DEHP对高脂饮食大鼠血清中TG(A)、TC(B)、LDL-C(C)和HDL-C(D)含量的影响
2.3 DEHP对高脂饮食大鼠血清中瘦素和脂联素的影响
从图4A可看出,与对照组相比,高脂组和DEHP组大鼠体内瘦素含量显著增加(P<0.05)。从图4B可知,单纯高脂饮食会使大鼠体内的脂联素含量显著下降(P<0.05)。与对照组相比,10 mg/kg和100 mg/kg的DEHP暴露可使脂联素含量显著减少(P<0.05)。与高脂组相比,300 mg/kg DEHP暴露可显著增加大鼠血清中脂联素含量(P<0.05)。
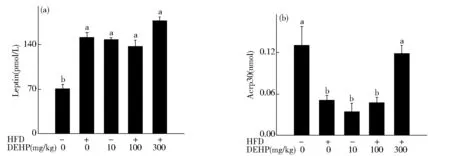
Fig.4 Effect of DEHP on levels of Leptin (A)and Acrp30 (B) in HFD rats图4 DEHP对高脂饮食大鼠血清中瘦素(A)和脂联素(B)水平的影响
3 讨论
DEHP作为一种常用增塑剂,在环境中普遍存在,与高血压、糖尿病、肥胖等代谢综合征相关疾病的发生密切相关[14,19]。一般而言,肥胖发生时常伴随着脂质代谢紊乱[15-16],包括胆固醇(CHOL)和TG水平异常。CHOL代谢失常主要表现为血浆TC水平增高和HDL-C含量降低,其机制可能是CHOL转化利用能力降低,参与其分解代谢的调节酶或受体活性及数量降低,导致其合成速度大于分解速度。肥胖发生时,HDL-C合成代谢存在障碍,生成减少,对TC清除能力不足[15]。此外,高脂饮食可引起血糖升高,刺激胰岛素分泌增加,出现胰岛素抵抗现象,进而可促进肝脏合成TG和LDL-C增加,引起血浆TG和LDL-C浓度升高[20]。另有研究发现,血清LDL-C含量与TC含量具有正相关性[21-22]。血脂中TG、TC、LDL-C和HDL-C异常表达与MS发生密切相关[15-16]。本研究发现,与高脂组相比,低剂量(10 mg/kg)DEHP暴露可显著增加大鼠血清中TG、TC和LDL-C含量,并使HDL-C含量减少;高剂量(300 mg/kg)DEHP暴露会使血清TG、TC含量显著下降,并使LDL-C含量显著增加,而对HDL-C水平无显著影响。提示DEHP暴露可能会导致HFD大鼠脂质代谢紊乱,而且剂量不同所产生的效应也存在差异。低剂量DEHP暴露可能会增加MS发病风险。
研究表明,肥胖时脂肪组织的内分泌功能异常改变,脂肪细胞异常分泌脂源性细胞因子瘦素和脂联素,调节肥胖相关疾病的发生[20,22-25]。瘦素主要通过负反馈作用来调控体重,即通过与瘦素受体直接结合,使食物摄入减少和能量消耗增加,进而减少体内脂肪沉积[24]。瘦素还能直接作用于脂肪细胞,抑制脂肪的合成,降低肥胖发生几率,但当瘦素合成减少或机体对瘦素反应不敏感时,则会增加机体肥胖发生风险[25]。脂联素是体内唯一的保护性脂肪因子,主要作用是增加游离脂肪酸氧化,降低TG储存,使肌肉对胰岛素敏感性上升[16,26]。脂联素还可通过降低游离酸脂肪转运子在细胞膜上的富集而减少脂质堆积[16]。但是,当肥胖发生时,短时间内体内便会发生脂联素抵抗,出现对游离脂肪酸促氧化能力下降现象,进而导致脂质摄取增加或脂质堆积。本研究发现,DEHP暴露对HFD大鼠体内瘦素水平无显著影响,但当DEHP暴露剂量为300 mg/kg时,HFD大鼠体内的脂联素含量显著升高,而10 mg/kg DEHP可使脂联素水平降低,可以看出,脂联素水平与TC、TG水平呈负相关,这与Diez[23]和Asayama等[24]的研究结果一致。另外,文献报道[27]肥胖者体内过多堆积的脂肪组织会通过大量分泌肿瘤坏死因子,并结合自分泌或旁分泌作用来限制脂联素的合成与分泌过程,因此认为脂联素水平的降低与体内脂肪组织的增加有关。然而本研究中并未发现附睾周脂肪含量发生明显变化,具体原因还有待进一步研究。
此外,肝脏是脂质代谢的主要器官,肝脏受损时血脂代谢也会发生异常[27]。本研究发现,DEHP(300 mg/kg)暴露会使HFD大鼠肝体比显著增大,提示高剂量DEHP暴露可能会对肝脏造成一定的影响,进而影响血脂代谢。
总之,DEHP暴露会导致高脂饮食大鼠脂质代谢紊乱,而且剂量不同所产生的效应也不同。低剂量DEHP暴露可能会增加MS发病风险,而高剂量DEHP暴露所产生的效应有待进一步研究。
[1] Heudorf U,Mersch S V,Angerer J.Phthalates:Toxicology and Exposure[J].InternationalJournalofHygieneandEnvironmentalHeath,2007,210(5):623-634.DOI:10.1016/j.ijheh.2007.07.011.
[2] Latini G,Ferri M,Chiellini F.Materials Degradation in PVC Medical Devices,DEHP Leaching and Neonatal Outcomes[J].CurrentMedicinalChemistry,2010,17(26):2979-2989.DOI:10.2174/092986710792064992.
[3] Rudel R A,Gray J M,Engel C L,etal.Food Packaging and Bisphenol A and bls(2-Ethylhexyl)Phthalate Exposure:Findings from Adietary Intervention[J].EnvironmentalHealthPerspectives,2011,119(7):914-920.DOI:10.1289/ehp.1003170.
[4] Shaz B H,Grima K,Hillyer C D.2-(Diethylhexyl)Phthalate in Blood Bags:Is This a Public Health Issue?[J].Transfusion,2011,51(11):2510-2517.DOI:10.1111/j.1537-2995.2011.03164.x.
[5] Swan S H.Environmental Phthalate Exposure in Relation to Reproductive Outcomes and Other Health Endpoints in Humans[J].EnvironmentalResearch,2008,108(2):177-184.DOI:10.1016/j.envres.2008.08.007.
[6] Kwon H,Kim D,Kim J S.Body Fat Distribution and the Risk of Incident Metabolic Syndrome:A Longitudinal Cohort Study[J].ScientificReports,2017,7(1):10955.DOI:10.1038/s41598-017-09723-y.
[7] Lakka H M,Laaksonen D E,Lakka T A,etal.The Metabolic Syndrome and Total and Cardiovascular Disease Mortality in Middle-aged Men[J].JamatheJournaloftheAmericanMedicalAssociation,2002,288(21):2709-2716.DOI:10.1001/jama.288.21.2709.
[8] Wang J,Ruotsalainen S,Moilanen L,etal.The Metabolic Syndrome Predicts Cardiovascular Mortality:A 13-year Follow-up Study in Elderly Non-diabetic Finns[J].EuropeanHeartJournal,2007,28(7):857-864.DOI:10.1093/eurheartj/ehl524.
[9] 林怡.围产期BPA暴露增加子代大鼠代谢综合征的风险及机制研究[D].武汉:华中科技大学,2011.DOI:10.7666/d.d186491.
[10] Hatch E E,Nelson J W,Qureshi M M,etal.Association of Urinary Phthalate Metabolite Concentrations with Body Mass Index and Waist Circumference:A Cross-sectional Study of NHANES data,1999-2002[J].EnvironmentalHealth,2008,7(1):27.DOI:10.1186/1476-069X-7-27.
[11] Wang J,Yan S S,Xiao H S,etal.Anti-obesity Effect of a Traditional Chinese Dietary Habit-blending Lard with Vegetable Oil While Cooking[J].ScientificReports,2017,7:14689.DOI 10.1038/s41598-017-14704-2.
[12] Kim S H,Mi J P.Phthalate Exposure and Childhood Obesity[J].AnnPediatrEndocrinolMetab,2014,19(2):69-75.DOI:10.6065/apem.2014.19.2.69.
[13] Zhang Y,Meng X,Chen L,etal.Age and Sex-specific Relationships Between Phthalate Exposures and Obesity in Chinese Children at Puberty[J].PlosOne,2014,9(8):e104852.DOI:10.1371/journal.pone.0104852.
[14] Jin H K,Park H,Lee J,etal.Association of Diethylhexyl Phthalate with Obesity-related Markers and Body Mass Change from Birth to 3 Months of Age[J].JournalofEpidemiologyandCommunityHealth,2016,70(5):466-472.DOI:10.1136/jech-2015-206315.
[15] Bluher M.Serum Levels of Tumor Necrosis Factor-α,Angiotensin Ⅱ,Growth Hormone,and IGF-Ⅰ are Not Elev-ated in Insulin-resistant Obese Individuals with Impaired Glucose Tolerance[J].DiabetesCare,2001,24(2):328-334.DOI:10.2337/diacare.24.2.328.
[16] Dyck D J.Adipokines as Regulators of Muscle Metabolism and Insulin Sensitivity[J].ApplPhysiolNutrMetab,2009,34(3):396-402.DOI:10.1139/H09-037.
[17] 杨鹏远,芮耀诚,焦亚斌.动脉粥样硬化大鼠实验模型的建立[J].第二军医大学学报,2003,24(7):802-804.DOI:10.3321/j.issn:0258-879X.2003.07.031.
[18] 贺庆芝,曾怀才,易岚,等.姜黄素对高脂饮食大鼠血脂含量和caveolin-1表达的影响[J].实用预防医学,2010,17(6):1046-1048.DOI:0.3969/j.issn.1006-3110.2010.06.003.
[19] Feige J N,Alan G,Cristina C C.The Pollutant Diethylhexyl Phthalate Regulates Hepatic Energy Metabolism Via Species-specific PPARalpha-dependent Mechanisms[J].EnvironHealthPerspect,2010,118(2):234-241.DOI:10.1289/ehp.0901217.
[20] 宋文蔚,潘智敏,王英虎.调脂积冲剂对高脂诱导肥胖大鼠脂联素、抵抗素影响的研究[J].中华中医药学刊,2014,32(5):1074-1076.DOI:10.13193/j.issn.1673-7717.2014.05.038.
[21] Zierath J R,Livingston J N,Thorne A,etal.Regional Difference in Insulin Inhibition of Non-esterified Fatty Acid Release from Human Adipocytes:Relation to Insulin Receptor Phosphorylation and Intracellular Signalling Through the Insulin Receptor Substrate-1 Pathway[J].Diabetologia,1998,41(11):1343-1354.DOI:10.1007/s001250051075.
[22] Marchesini G,Brizi M,Morsellilabate A M,etal.Association of Nonalcoholic Fatty Liver Disease with Insulin Resistance[J].AmericanJournalofMedicine,1999,107(5):450-455.DOI:org/10.1016/S0002-9343(99)00271-5.
[23] Diez J J,Iglesias P.The Role of the Novel Adipocyte-derived Hormone Adiponectin in Human Disease[J].EuropeanJournalofEndocrinology,2003,148(3):293-300.DOI:10.1530/eje.0.1480293.
[24] Asayama K,Hayashibe H,Dobashi K,etal.Decrease in Serum Adiponectin Level Due to Obesity and Visceral Fat Accumulation in Children[J].ObesityResearch,2003,11(9):1072-1079.DOI:10.1038/oby.2003.147.
[25] 霍新慧.穴位埋线疗法对单纯性肥胖大鼠血脂、血清瘦素水平及脂肪蓄积的影响[D].乌鲁木齐:新疆医科大学,2008.DOI:10.7666/d.y1363445.
[26] Kubota N,Terauchi Y,Yamauchi T,etal.Disruption of Adiponectin Causes Insulin Resistance and Neointimal Formation[J].JournalofBiologicalChemistry,2002,277(29):25863-25866.DOI:10.1074/jbc.C200251200.
[27] Nam M,Choi M S,Jung S,etal.Lipidomic Profiling of Liver Tissue from Obesity-orone and Obesity-resistant Mice Fed a High Fat Diet[J].ScientificReports,2015,5:16984.DOI:10.1038/srep16984.
