秸秆热解工艺优化与生物炭理化特性分析
2018-03-10刘朝霞牛文娟楚合营牛智有
刘朝霞,牛文娟,楚合营,牛智有※
0 引 言
随着全球资源短缺日益严重,环境污染问题加剧,开发秸秆的高效转化利用技术,科学合理利用秸秆资源,有利于维护土壤肥力、保护生态环境和实现农业可持续发展。中国农作物秸秆资源丰富,秸秆年总产量达8亿t,其中,小麦秸秆、水稻秸秆、玉米秸秆、油菜秸秆和棉花秸秆的年产出量分别为1.54、1.19、3.32、0.24和0.22亿 t,占了总秸秆的 77.40%[1-2]。利用热解炭化技术处理秸秆,可以实现秸秆的回收利用,还能获得生物炭、生物油和燃气等高附加值能源产品[3-4]。
秸秆生物炭是秸秆慢速热解炭化后得到的固体产物,通常含有较高的固定碳和较强的稳定性[5-6]。近年来,生物炭在固碳减排和提高土壤肥力方面得到了一定的应用,引起了科学工作者的广泛关注[7-9]。将秸秆转化为生物炭添加到土壤中有利于改善土壤结构和持水性,降低肥料养分的流失[10-11]。国内外研究者在秸秆的热解工艺和生物炭的组成成分、结构特性、晶体和矿物特征等方面做了大量研究[12-14]。炭化温度、保温时间和升温速率是秸秆热解过程中重要的影响因素。炭化温度对热解产物的分布和性质有很大的影响[15-16],生物炭中固定碳随炭化温度的升高而增加[17],H/C和O/C随炭化温度升高而降低[18]。升温速率的增加会使秸秆达到炭化温度的时间变短,颗粒内外的温差较大,影响生物炭的比表面积和孔结构[19]。保温时间越长,炭化越完全,得到的生物炭产率越低,N质量分数增加,C/N原子比值减小,pH值增加,K和 P质量分数增加[20-22]。目前,世界各国虽然在热解技术方面的研究取得了一定的进展,但是在秸秆生物炭的肥料化利用的品质调控上仍然存在一些问题。由于秸秆原料不同,化学成分也不相同,具有不同的分子结构和基团,其热解炭化行为差别较大[23-25],进一步影响生物炭的肥料化利用。结合生物炭的营养特性和矿物质元素,优化秸秆热解工艺,调控生物炭的理化特性,对生物炭的肥料化利用具有一定的指导意义。
为了明确热解炭化工艺对秸秆生物炭的结构和组成成分等理化特性的影响,本文以水稻、小麦、玉米、油菜和棉花秸秆为原料,进行了正交试验设计,以生物炭的肥料化利用为目标,采用综合评分法对秸秆热解炭化工艺参数进行优化,试验因素包括炭化温度、升温速率和保温时间,并对秸秆的热解过程进行分析,研究最佳工艺条件下秸秆生物炭的组成成分、表面官能团和孔隙结构等特性。
1 材料与方法
1.1 秸秆的采集与生物炭制备
采集成熟期的水稻、小麦、玉米、油菜和棉花秸秆,于室外晾晒后,粉碎研磨过40目筛,然后样品在45 ℃干燥36 h。称取约30 g秸秆放入80 mm×60 mm×40 mm的方形瓷舟,置于管式炉的加热区域。通入氮气30 min,流速设置为1 L/min,在管式炉内形成氮气气氛,设置不同的工艺参数进行炭化,自然冷却至室温,取出后立即称取样品质量,并装入自封袋备用待测。
1.2 仪器设备
SKGL-1200C型管式炉(上海钜晶精密仪器制造有限公司);101-3AB型电热恒温干燥箱(天津天有利科技有限公司);SX2-4-10型箱式马弗炉(英山县建力电炉制造有限公司);EA3000型元素分析仪(Euro Vector,意大利);SDTQ600型TG–DSC同步热分析仪(TA,美国);高效液相色谱HPLC(安捷伦1200,美国);Foss 纤维素分析仪(Foss 2010,瑞典);AA6300C型原子吸收分光光度计(岛津,日本);Vertex 70型傅里叶变换红外光谱仪(Bruke,德国);ASAP2460型全自动吸附仪(Micromeritics,美国)。
1.3 测试方法
秸秆生物炭的肥料化利用关键在于其对土壤水肥的调控效应[26],秸秆生物炭的组成成分、表面基团和孔隙结构等理化特性对其肥料化利用具有重要作用。
1.3.1 工业分析
参照ASTM D 1762-84,测定样品中的挥发分(volatile matter,VM),灰分(Ash)。固定碳(fixed carbon,FC)采用差值法计算得出。
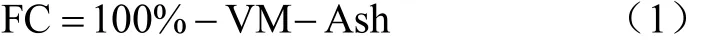
1.3.2 元素分析
采用元素分析仪测定样品中的碳(C)、氢(H)、氮(N)、氧(O)和硫(S)的质量分数,每个样本测3次,取平均值作为样品中该元素的质量分数值。
1.3.3 木质纤维成分
按照参考文献的方法[27],将样品进行酸处理,得到酸解液,采用高效液相色谱(HPLC)测定秸秆中纤维素和半纤维素的质量分数。用马弗炉灼烧酸解后的剩余残渣,测定出样品的木质素质量分数。
1.3.4 矿质元素
采用硫酸和双氧水将样品消解至透明,得到消解液,采用原子吸收分光光度计测定样品中的磷(P)、钾(K)、钠(Na)、钙(Ca)和镁(Mg)。
1.3.5 红外光谱分析
将样品烘干至质量保持不变后与溴化钾(KBr)以1∶100的比例混合均匀,用研钵磨细后压片,用红外分析仪测试,波长范围为400~4 000 cm-1。
1.3.6 热重分析
称取 0.50 mg样品置于坩埚中,以高纯氮气(99.999%)为载气,气体流速为100 mL/min,升温速率为10℃/min,样品均升温至900℃。
1.3.7 比表面积及孔径分布
用比表面积仪在液氮饱和温度下对秸秆生物炭样品进行静态等温吸附和脱附测定,计算样品的比表面积和孔径分布。
1.4 正交试验设计与数据处理方法
为了探讨炭化温度、保温时间和升温速率对秸秆生物炭的炭产率、稳定性和组成成分等的影响,在单因素试验的基础上,采用L16(45)正交试验方案设计3因素4水平的正交试验。因素水平分别设置为:炭化温度300、400、500、600 ℃,保温时间 30、60、90、120 min,升温速率5、10、15、20 /min℃。因素水平表如表1所示。5种秸秆均按照正交试验方案制备了生物炭样品。

表1 因素水平表Table 1 Factor standard
考虑秸秆生物炭的肥料化利用,试验选取炭产率(biochar yield)、固定碳(FC)、C和N的质量分数为考察指标[28-29]。根据多指标正交试验的综合评分法,取炭产率、固定碳、C和N质量分数的权重分别为0.3、0.3、0.2和0.2,满分为1.00。隶属度X由式(2)得出,其中X表示该指标隶属度,xi为指标值,xmin为指标最小值,xmax为指标最大值。综合评分y由式(3)得出。式中,XBiocharyield为炭产率的隶属度,XFC为固定碳的隶属度,XN和XC分别为N元素和C元素的质量分数隶属度。


2 结果与分析
2.1 秸秆原料的组成成分分析
5种秸秆原料组成成分的统计结果如表2所示。5种秸秆的各组成成分差异性显著(P<0.05)。5种秸秆相比,水稻秸秆的纤维素和灰分最高,棉花秸秆的木质素和固定碳最高,油菜秸秆的挥发分最高,而灰分最低,棉花和油菜秸秆中C的质量分数最高。
5种秸秆的H/C和O/C原子比分别为1.59~1.64和0.68~0.75。玉米秸秆中N的质量分数最高,约为1.96%。棉花秸秆中P的质量分数最高。5种秸秆的矿质元素中,K质量分数最高,约为1.35%~2.52%。Na、Ca和Mg的质量分数相对较低。
2.2 热解炭化工艺优化
以棉花秸秆为例,棉花秸秆热解的正交试验所得生物炭的炭产率及组成成分结果如表3所示。3个因素对棉花秸秆生物炭的综合分数 y的影响大小顺序为炭化温度A、保温时间B和升温速率C。
炭化温度、保温时间和升温速率 3个试验因素对 5种秸秆生物炭理化特性的综合评分的影响趋势如图 1所示。从图 1可以看出,炭化温度是影响综合评分的主要因素,500 ℃时玉米、油菜和棉花秸秆生物炭的综合评分y值最大,小麦和水稻秸秆生物炭的y值和400 ℃时的y值接近,由于400 ℃时秸秆中的木质纤维成分尚未分解完全[30-32],综合考虑 5种秸秆生物炭的理化特性,选择最优炭化温度为 500 ℃。炭化温度继续升高导致样品进一步分解,气体产量增加,减少生物炭的产生。

表2 5种农作物秸秆原料的组成成分分析Table 2 Compositional analysis of five crop straws
综合考虑5种秸秆生物炭,以获得最大的y值为标准,得到5种秸秆热解炭化的最优工艺参数组合是炭化温度为500 ℃,保温时间为30 min,升温速率为10 ℃/min。在此试验条件下,水稻、小麦、玉米、油菜和棉花秸秆生物炭的炭产率分别为:37.38%±0.17%、34.42%±0.51%、34.39%±0.62%、32.74%±0.18%、37.87%±0.66%。棉花秸秆生物炭的炭产率最高,可能是由于棉花中木质素的质量分数较高(表 2),木质素受热时主要发生脱侧链和缩合反应,是生物质炭的主要来源。Haykiri-Acma等[33]认为木质素在热解过程中形成了大部分的炭。Wannapeera[34]的研究表明木质素和金属元素的质量分数会影响炭的产率。水稻秸秆中灰分较多(表 2),所以热解得到的生物炭产率较高。玉米秸秆生物炭产率比小麦秸秆生物炭产率稍高,可能是由于玉米茎秆外皮的木质化程度较高造成的[35]。油菜秸秆中挥发分的质量分数最高(表2),热解过程中挥发性物质大量减少,可能转化为气体或液体产物,因此油菜秸秆生物炭产率最低。本研究表明,秸秆中不同的木质纤维成分、挥发分和灰分的质量分数会影响其转化为生物炭的产率,在秸秆热解炭化时需要考虑不同的组成成分对生物炭产率的影响。
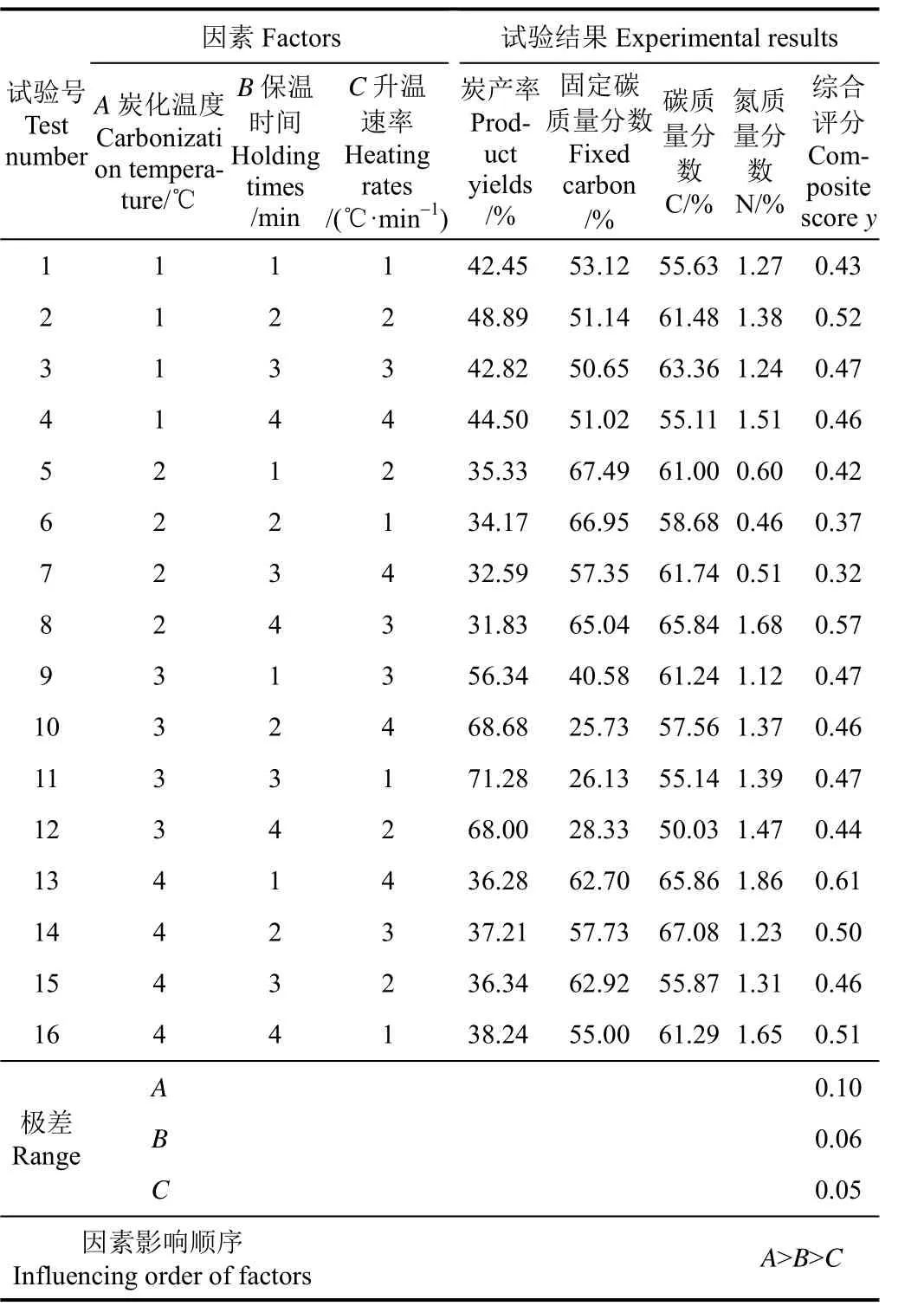
表3 棉花秸秆正交试验设计及结果Table 3 Design and results of orthogonal experiment for cotton stalk
2.3 秸秆的热解过程分析
图 2为标准物质、秸秆和最优工艺下的生物炭在氮气气氛下的热解特性曲线。由图2a可以看出,半纤维素的热解区间为180~300℃,2个失重峰分别出现在190℃和250℃,明显的失重过程在 500℃完成,最后的残留剩余物约为20%。纤维素的主要反应阶段为280~380℃,呈现一个单一的失重峰,最大失重速率对应的温度约为310℃。木质素的热解区间为 200~500℃,峰形较宽,总失重率约为50%。
由图2b可以看出,秸秆的热解过程主要分为4个阶段,且4个阶段的区分比较明显,总的失重率为73%~82%。第1阶段为脱水阶段(室温~130℃),此阶段主要为水分的挥发,失重率约为4%~8%。第2阶段为过渡阶段(130~240℃),此阶段仅发生微量的失重,低分子化合物发生降解,同时,秸秆发生木质纤维素的解聚及“玻璃化转变”阶段[32,36]。第3阶段是主要热解阶段(240~500 ℃),是失重的主要阶段,在此温度区间秸秆热解生成小分子气体和较大分子的可凝挥发分,失重达到60%~70%。此阶段热失重微分曲线有一个肩状峰和一个大的主峰,肩峰由半纤维素的热解形成,大的主峰由纤维素的热解形成,木质素的热解则包含在整个峰形结构[32,36]。秸秆的最大失重速率出现在这一阶段,最大失重速率对应的温度范围为325~340℃。第4阶段为炭化阶段(500~900℃),是残渣的二次热解反应,也是无机物的晶型转变过程,主要生成炭和灰分。500℃以后秸秆失重不明显,表明500℃时秸秆基本炭化完全。5种秸秆残渣的质量分数具有一定的差异性,主要是由秸秆的组成成分不同所导致的。
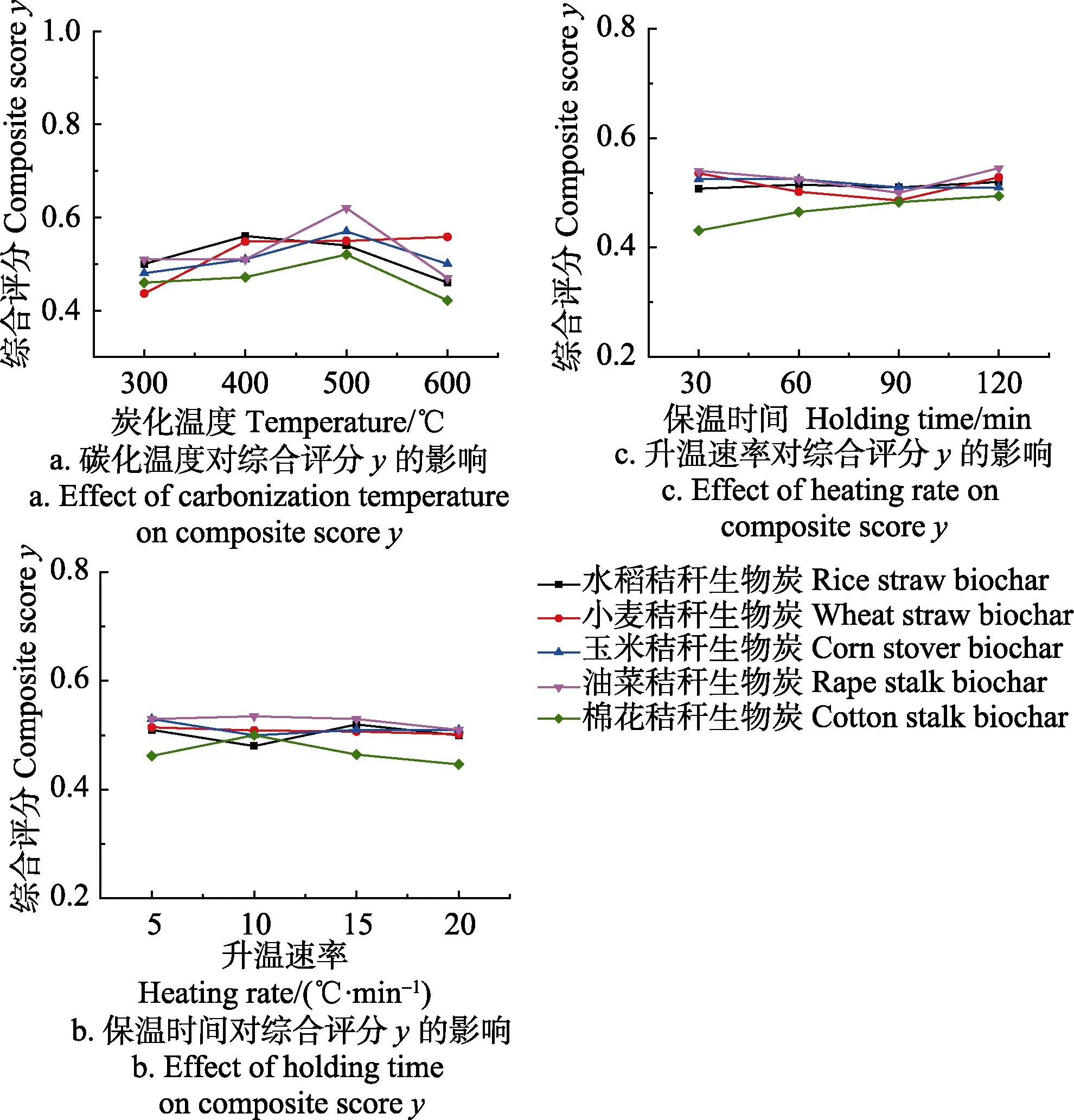
图1 热解参数对5种秸秆生物炭理化特性综合评分的影响Fig.1 Effect of pyrolysis parameters on physiochemical properties of five crop straw biochars.
从图2b和2c可以看出,500℃之前,最优工艺条件下制备的 5种秸秆生物炭的失重率很小,说明生物炭里面的木质纤维成分已经炭化较完全,表明500℃下制备的秸秆生物炭比较稳定。5种秸秆生物炭的失重率约为20%。秸秆生物炭的DTG曲线显示,只有在630~650℃出现一个小的失重峰,可能是残渣的二次热解反应和无机物的晶型转变过程。
2.4 最优工艺条件下秸秆生物炭的理化特性分析
2.4.1 生物炭的组成成分分析
最优工艺条件下(炭化温度500℃,保温时间30 min,升温速率10 ℃/min)制备的秸秆生物炭的组成成分如表4所示。
5种秸秆生物炭中固定碳的质量分数大于45%,油菜秸秆生物炭含有最高的固定碳,其次是棉花和小麦秸秆生物炭,水稻秸秆生物炭的固定碳含量最低。秸秆中的纤维素和半纤维素类物质在制备生物炭的过程中被解构,生成了呋喃类的芳香族化合物,因此生物炭施用于土壤后被微生物直接利用的可能性降低,具有较高的生物稳定性。生物炭中的K、Na、Ca、Mg等无机元素以灰分形式存在,热解过程对这些成分的浓缩和富集使生物炭中P、K、Ca、Mg等养分的质量分数明显高于秸秆原料(表2和表4)。5种秸秆生物炭中K元素的质量分数为3.41%~6.81%,小麦秸秆生物炭的K质量分数最高。油菜和棉花秸秆生物炭中的 Ca质量分数为 2.60%和1.04%。通常较高的固定碳更有利于提升土壤的碳封存能力[25],而灰分中丰富的营养元素也使生物炭的肥料化利用潜力优于秸秆。
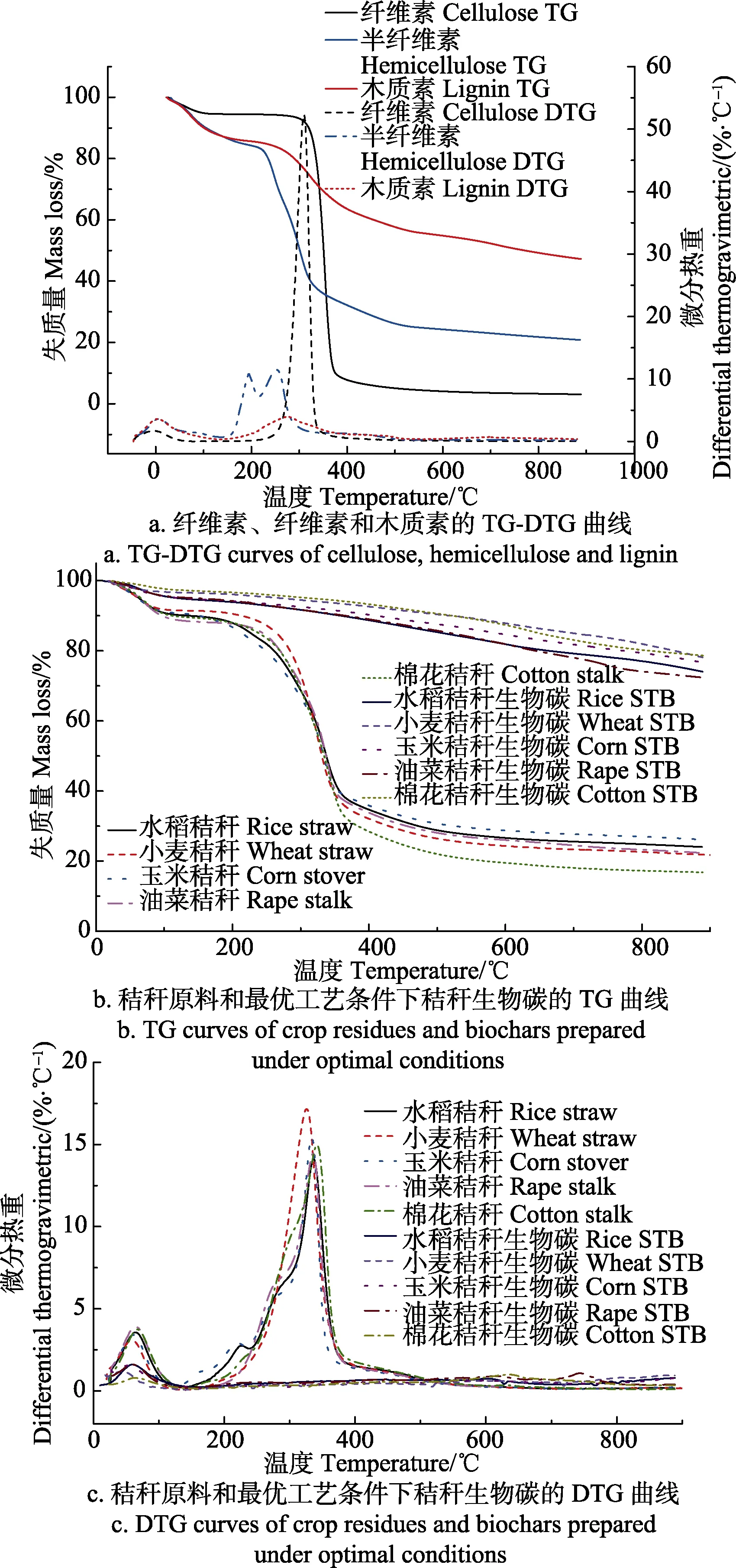
图2 秸秆原料和最佳工艺条件下制备的秸秆生物炭的热重分析Fig.2 TG-DTG curves of crop residues and biochars prepared under optimal conditions.
由表 4可以看出,最优工艺条件下的秸秆生物炭中的C元素的质量分数在53.23%~68.29%之间,N元素的质量分数为0.7%~2.5%。油菜秸秆生物炭C元素的质量分数最高,玉米秸秆生物炭中N元素的质量分数最高,N和S容易形成C-N、C-S、H-N和H-S化学键。
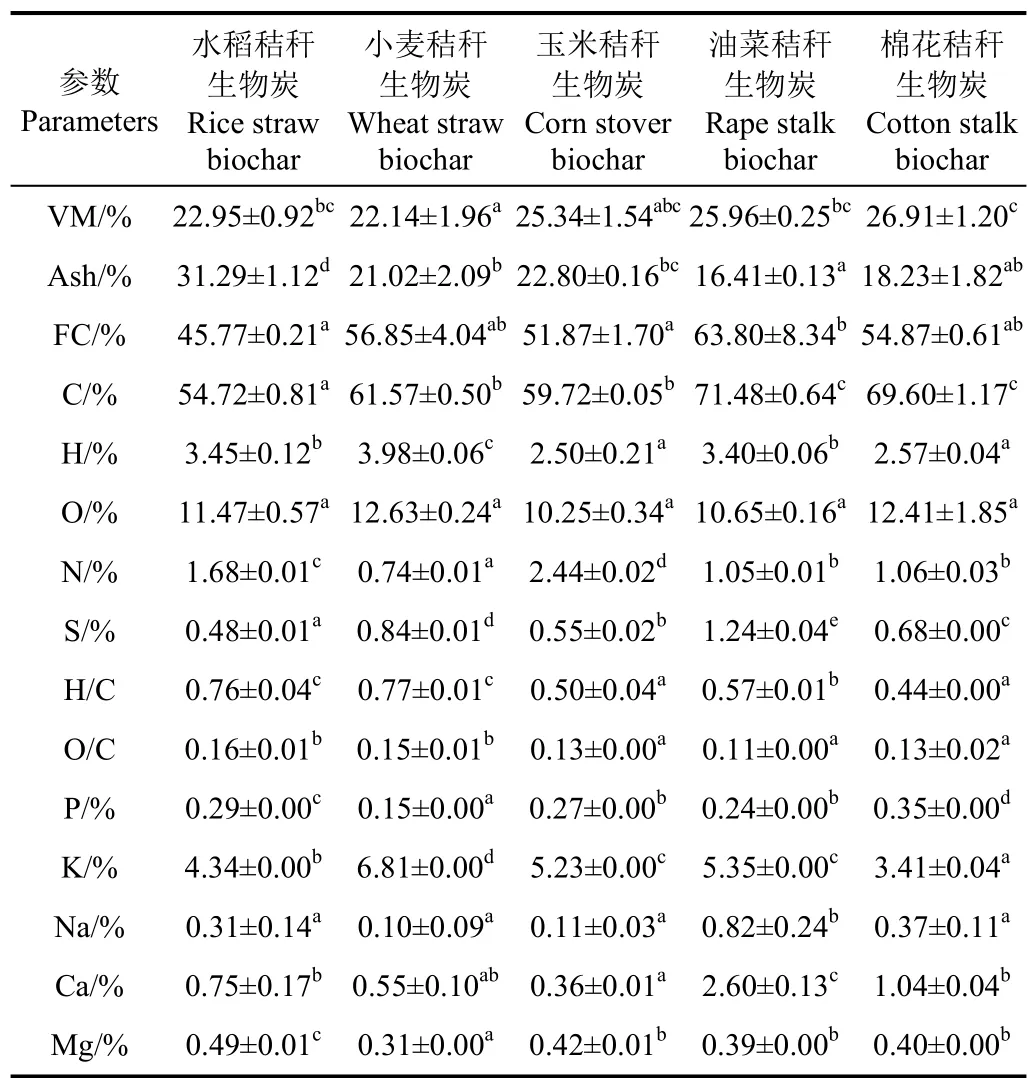
表4 最优工艺条件下制备的生物炭的组成成分分析Table 4 Compositional analysis of biochars prepared under optimal conditions
Spokas等[37]预测,O/C低于0.2的生物炭半衰期超过1 000年。Skjemstad等[38]研究发现生物质在400℃以上炭化后通常 H/C≤0.5,O/C≤0.6,随着生物炭特性研究的深入,生物炭的H/C和O/C原子比逐渐广泛用来确定生物炭的芳香化程度[39]。
图3为最优工艺条件下制备的5种秸秆生物炭的范氏图。5种秸秆生物炭的O/C小于0.2。玉米、油菜和棉花秸秆生物炭H/C小于 0.6,可以考虑用作土壤添加剂或者碳封存材料[32]。5种秸秆生物炭的H/C和O/C都比秸秆原料低(图 3),这是由于秸秆热解炭化后形成了更稳定的含C化合物,表面极性官能团减少。
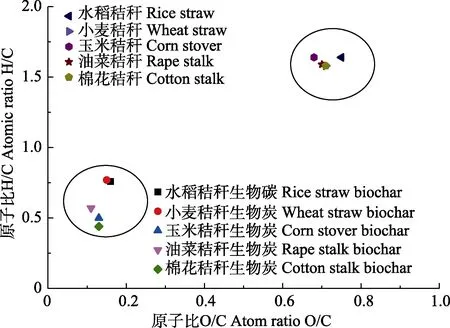
图3 秸秆原料和最优工艺条件下秸秆生物炭的范氏图Fig.3 Van Krevelan diagram for straw biochars prepared under optimal conditions and straws
水稻和小麦秸秆生物炭的H/C和O/C比高于其他3种秸秆生物炭,说明这 2种秸秆生物炭的芳香化程度较低。油菜秸秆生物炭的O/C最低,说明油菜秸秆生物炭的极性最低,性质比较稳定不易解离。水稻秸秆生物炭的O/C比其他4种生物炭的O/C高,说明这5种秸秆生物炭中水稻秸秆生物炭具有较高的亲水性,有利于提高土壤吸水能力和土壤持水量。
2.4.2 生物炭的傅里叶变换红外光谱分析
生物炭表面的化学官能团电离产生电荷,因此生物炭具有较高的离子吸附交换量,有些化学官能团如羧基和羟基等比较活跃,可以进行化学反应,生物炭可以通过静电吸附或化学反应负载肥料离子。以棉花秸秆为例,棉花秸秆和最优工艺条件下制备的秸秆生物炭的傅里叶变换红外光谱图如图4a所示。棉花秸秆的FTIR曲线在3 400 cm-1有明显的吸收峰,这是羟基的中O-H的伸缩振动峰[39],甲基、亚甲基等的C-H伸缩振动峰在2 922cm-1附近,羰基或酯类的C=O伸缩振动峰为1 740 cm-1和1 627 cm-1,1 372 cm-1处为侧链CH3中C-H或酚类O-H伸缩振动[40]。1 048 cm-1处木聚糖结构中C-O-C的伸缩振动峰表明秸秆中半纤维素以木糖为主,891 cm-1处 C-O-C的伸缩振动峰表明β-(1-4)糖苷键的存在。炭化之后得到的棉花秸秆生物炭,纤维素、半纤维素和木质素的特征吸收峰消失,在1 700 cm-1处出现较小的C=O伸缩振动的吸收峰,说明秸秆纤维素的热解途径可能为吡喃环的开裂以及环内 C-C键断裂为主,在生物炭表面存在羧基(-COOH)或者羰基(C=O)等含氧官能团[16]。

图4 最优工艺条件下的秸秆生物炭FTIR光谱分析Fig.4 FTIR spectral from straw and biochars prepared under optimal conditions
3 420 cm-1处羟基中O-H的伸缩振动峰强度有所减弱,说明炭化中秸秆发生了脱羟基反应,其中水稻秸秆生物炭的吸收峰最强,而小麦秸秆生物炭的吸收峰最弱。在1 600 cm-1附近的吸收峰归属于芳香环的面内振动,1 430 cm-1处的吸收峰是由芳环的C-C骨架振动造成的,此吸收带为芳香环骨架的特征吸收带,秸秆生物炭的光谱图中均显示出较强的吸收,说明秸秆生物炭中存在苯环结构。1 100 cm-1处的吸收峰归属于面内环的伸缩振动,800和617 cm-1附近的吸收峰分别对应于芳环C-H的面外弯曲振动和碳酸盐或烷基的面外弯曲变形[41],5种秸秆生物炭的吸收峰强度接近。
本研究表明,最优工艺条件下制备的 5种秸秆生物炭表面均含有一定数量的官能团,并且基团种类大致相同,吸收强弱有一定差异。生物炭表面的-COOH和-OH等含氧官能团使生物炭表面产生负电荷,在土壤中易与极性化合物和矿物质发生相互作用,增强土壤对阳离子的吸附能力,可以用来改善土壤的阳离子交换量[25]。
2.4.3 生物炭的吸附特性
根据国际与应用化学联合会(IUPAC)的规定,将孔隙分为微孔(< 2 nm)、中孔(2~50 nm)和大孔(> 50 nm)。不同孔结构的生物炭具有不同的气体吸附等温线。采用比表面积仪对水稻秸秆生物炭的比表面积和孔径分布进行分析。图 5为最优工艺条件下的制备的水稻秸秆生物炭的N2吸附-脱附等温线5a和孔径分布图5b,水稻秸秆生物炭的比表面积为10.35 m2/g。

图5 最优工艺条件下的水稻秸秆生物炭的N2吸附-脱附等温线和孔径分布Fig.5 Nitrogen adsorption-desorption isotherms and pore diameter distribution of rice straw biochar prepared under optimal conditions
图5 a中水稻秸秆生物炭的吸附等温线在低压区(相对压强<0.2)偏向y轴,吸附量从1.67 cm3/g增加到2.68 cm3/g。中压段等温线较平缓。当相对压强达到 0.5时,吸附和脱附支没有完全重合,说明生物炭中具有以中孔为主的介孔结构[42]。图 5a表明水稻秸秆生物炭的吸附-脱附等温线为Ⅳ型等温线,有迟滞环的存在,表明该样品为中孔为主的生物炭。图5b为水稻秸秆生物炭样品的孔径分布图,V为累积孔容,D为直径。曲线在3 nm和12 nm附近有2个峰,表明样品中存在3 nm以上的中孔和大孔。热解炭化破坏了秸秆自身的致密结构,由于挥发分的释放产生较多的孔隙,这些孔隙的存在有助于改善土壤结构。
秸秆生物炭的这些孔结构可以改善土壤的孔隙度,提高土壤的通透性和氧气供应,在土壤通气过程中有重要作用,还可以为土壤微生物提供栖息地,使微生物免受淋滤等因素的干扰[43]。这些生物炭进入土壤中可以改善土壤结构和性质,有利于作物生长。
3 结 论
1)综合考虑5种秸秆生物炭的炭产率和理化特性指标,影响秸秆热解炭化因素的主次顺序为炭化温度、保温时间和升温速率。最优工艺参数为:炭化温度500 ℃,保温时间30 min,升温速率10 ℃/min。该条件下制备的水稻、小麦、玉米、油菜和棉花秸秆生物炭的炭产率分别约为37.38%、34.42%、34.39%、32.74%、37.87%。
2)最优工艺条件下的5种秸秆生物炭固定碳的质量分数大于45%,C元素的质量分数大于53%,N元素的质量分数为0.7%~2.5%,K元素的质量分数为3.41%~6.81%。生物炭的O/C小于0.2,玉米、油菜和棉花秸秆生物炭的H/C小于0.6,其芳香化程度较好。
3)最优工艺条件下制备的秸秆生物炭表面含有一定数量的羧基等含氧官能团,内部含有丰富的中孔及大孔等孔隙结构,对生物炭的肥料化利用有益,生物炭可以考虑用作土壤添加剂或者碳封存材料。
[1] 毕于运,高春雨,王亚静,等. 中国秸秆资源数量估算 [J].农业工程学报,2009,12(9):211-217.Bi Yuyun, Gao Chunyu, Wang Yajing, et al. Estimation of straw resources in China [J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2009, 12(9): 211-217. (in Chinese with English abstract)
[2] Zhou X, Wang F, Hu H, et al. Assessment of sustainable biomass resource for energy use in China [J]. Biomass and Bioenergy, 2011, 35(1): 1-11.
[3] Ayşe E P, Nurgül Ö, Eylem P Ö, et al. Fixed-bed pyrolysis of cotton stalk for liquid and solid products [J]. Fuel Processing Technology, 2005, 86(11): 1207-1219.
[4] Chen Y, Yang H, Wang X, et al. Biomass-based pyrolytic polygeneration system on cotton stalk pyrolysis: Influence of temperature [J]. Bioresour Technol, 2012, 107: 411-418.
[5] Thomas K K. Biochar characterization and a method for estimating biochar quality from proximate analysis results [J].Biomass and Bioenergy, 2017, 96: 50-58
[6] Wu M, Yang M, Han X, et al. Highly stable rice-strawderived charcoal in 3700-year-old ancient paddy soil: Evidence for an effective pathway toward carbon sequestration[J]. Environmental Science and Pollution Research International, 2016, 23(2): 1007-1014.
[7] Ameloot N, Neve S D, Jegajeevagan K, et al. Short-term CO2and N2O emissions and microbial properties of biochar amended sandy loam soils [J]. Soil Biol & Biochemistry,2013, 57: 401-410.
[8] Wu F, Jia Z, Wang S, et al. Contrasting effects of wheat straw and its biochar on greenhouse gas emission and enzyme activities in a chernozemic soil [J]. Biol Fertil Soils, 2013,49(5): 555-565.
[9] 周桂玉,窦森,刘世杰. 生物质炭结构性质及其对土壤有效养分和腐殖质组成的影响[J]. 农业环境科学学报,2011,30(10):2075-2080.Zhou Guiyu, Dou Sen, Liu Shijie. The structural characteristics of biochar and its effects on soil available nutrients and humus composition [J]. Journal of Agro-Environment Science, 2011, 30(10): 2075-2080. (in Chinese with English abstract)
[10] 李 明,李忠佩,刘 明,等. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学,2015,48(7):1361-1369.Li Ming, Li Zhongpei, Liu Ming, et al. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil[J]. Science Agricultura Sinica, 2015, 48(7): 1362-1369. (in Chinese with English abstract)
[11] Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota: A review [J]. Soil Biology & Biochemistry, 2011,43:1812-1836.
[12] Chang Y J, Dodla S K, Wang J J. Fundamental and molecular composition characteristics of biochars produced from sugarcane and rice crop residues and by-products [J].Chemosphere, 2016, 142: 4-13.
[13] Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3): 3488-3497.
[14] Gonzaga M I S, Mackowiak C L, Comerford N B, et al.Pyrolysis methods impact biosolids-derived biochar composition, maize growth and nutrition [J]. Soil & Tillage Research, 2017, 165: 59-65.
[15] Kim K H, Kim J Y, Cho T S, et al. Influence of pyrolysis temperature on physicochemical properties of biochar obtained from the fast pyrolysis of pitch pine (Pinus rigida)[J]. Bioresource Technology, 2012, 118(8): 158-162.
[16] 高凯芳,简敏菲,余厚平,等. 裂解温度对稻秆与稻壳制备生物炭表面官能团的影响 [J]. 环境化学, 2016, 35(8):1663-1669.Gao Kaifang, Jian Minfei, Yu Houping, et al. Effects of pyrolysis temperatures on the biochars and its surface functional groups made from rice straw and rice husk [J].Environmental Chemistry, 2016, 35 (8): 1663-1669. (in Chinese with English abstract)
[17] Ronsse F, Hecke S V, Dickinson D, et al. Production and characterization of slow pyrolysis biochar: influence of feedstock type and pyrolysis conditions [J]. GCB Bioenergy,2013, 5(2): 104-115.
[18] Xiao X, Chen Z, Chen B. H/C atomic ration as a smart linkage between pyrolytic temperatures, aromatic clusters and sorption properties of biochars derived from diverse precursory materials [J]. Scintific Reports, 2016, 6(22644): 1-13.
[19] Zeng K, Minh D P, Gauthier D, et al. The effect of temperature and heating rate on char properties obtained from solar pyrolysis of beech wood [J]. Bioresource Technology,2015, 182: 114-119.
[20] 张千丰,孟 军,刘居东,等. 热解温度和时间对三种作物残体生物炭 pH值及碳氮含量的影响 [J]. 生态学杂志,2013,32(9):2347-2353.Zhang Qianfeng, Meng Jun, Liu Judong, et al. Effects of pyrolysis temperature and duration time on pH, carbon and nitrogen contents of biochars produced from three crop residues [J]. Chinese Journal of Ecology, 2013, 32 (9): 2347-2353. (in Chinese with English abstract)
[21] 吴志丹,尤志明,江福英,等. 不同温度和时间炭化茶树枝生物炭理化特征分析 [J]. 生态与农村环境学报, 2015,31(4): 583-588.Wu Zhidan, You Zhiming, Jiang Fuying, et al.Physico-chemical properties of tea-twig-derived biochars different in temperature and duration of pyrolysis [J]. Journal of Ecology and Rural Environment, 2015, 31 (4): 583-588.(in Chinese with English abstract)
[22] Shaaban A, Se S M, Mitan N M M, et al. Influence of heating temperature and holding time on biochars derived from rubber wood sawdust via slow pyrolysis [J]. Journal of Analytical and Applied Pyrolysis, 2014, 107: 31-39.
[23] 刘 标,陈应泉,孟海波,等. 棉秆和油菜秆热解焦炭的燃烧与吸附特性[J]. 农业工程学报,2014,30(10):193-200.Liu Biao, Chen Yingquan, Meng Haibo, et al. Burning and adsorption characteristics of char obtained from pyrolysis of cotton and rapeseed straw [J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(10): 193-200. (in Chinese with English abstract)
[24] Zhang J, Liu J, Liu R. Effects of pyrolysis temperautre and heating time on biochar obtained from the pyrolysis of straw and lignosulfonate [J]. Bioresource Technology, 2015, 176:288-291.
[25] Bian R, Ma B, Zhu X, et al. Pyrolysis of crop residues in a mobile bench-scale pyrolyser: Product characterization and environmental performance [J]. Journal of Analytical and Applied Pyrolysis, 2016, 119: 52-59.
[26] 李艳梅,张兴昌,廖上强,等. 生物炭基肥增效技术与制备工艺研究进展分析[J]. 农业机械学报,2017,48(10):1-14.Li Yanmei, Zhang Xingchang, Liao Shangqiang, et al.Research progress on synergy technologies of carbon-based fertilizer and its application [J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(10): 1-14. (in Chinese with English abstract)
[27] Sluiter J B, Ruiz R O, Scarlata C J, et al. Compositional analysis of lignocellulosic feedstocks: Review and description of methods [J]. Journal of Agricultural & Food Chemistry, 2010, 58(16): 9043-9053.
[28] Silber A, Levkovitch I, Graber E R. pH- dependent mineral release and surface properties of cornstraw biochar:Agronomic implications [J]. Environmental Science &Technology, 2010, 44(24): 9318-9323.
[29] 张伟明. 生物炭的理化性质及其在作物生产上的应用[D].沈阳:沈阳农业大学,2012.
[30] Werner K, Pommer L, Broström M. Thermal decomposition of hemicelluloses [J]. Journal of Analytical & Applied Pyrolysis, 2014, 110: 130-137.
[31] Brebu M, Tamminen T, Spiridon I. Thermal degradation of various lignins by TG-MS/FTIR and Py-GC-MS [J]. Journal of Analytical & Applied Pyrolysis, 2013, 104(11): 531-539.
[32] Shen D K, Gu S. The mechanism for thermal decomposition of cellulose and its main products [J]. Bioresource Technology, 2009, 100(24): 6496-6504.
[33] Haykiri-Acma H, Yaman S, Kucukbayrak S. Comparison of the thermal reactivities of isolated lignin and holocellulose during pyrolysis [J]. Fuel Processing Technology, 2010,91(7): 759-764.
[34] Wannapeera J, Worasuwannarak N, Pipatmanomai S. Product yields and characteristics of rice husk, rice straw and corncob during fast pyrolysis in a drop-tube/fixed-bed reactor [J].Songklanakarin Journal of Science & Technology, 2008,30(3): 393-404.
[35] 闫贵龙,曹春梅,鲁 琳,等. 玉米秸秆不同部位主要化学成分和活体外消化率比较[J]. 中国农业大学学报, 26,11(3): 70-74.Yan Guilong, Cao Chunmei, Lu Lin, et al. Comparison of main chemical composition and in vitro digestibility in various sections of corn stalks [J]. Journal of China Agricultural University, 2006, 11(3): 70-74. (in Chinese with English abstract)
[36] Brebu M, Tamminen T, Spiridon I. Thermal degradation of various lignins by TG-MS/FTIR and Py-GC-MS [J]. Journal of Analytical & Applied Pyrolysis, 2013, 104(11): 531-539.
[37] Spokas K. Review of the stability of biochar in soils:Predictability of O:C molar ratios [J]. Carbon Management,2010, 1(2): 289-303.
[38] Skjemstad J O, Graetz R D. The impact of burning on the nature of soil organic matter in Australia [J]. Agronomia,2003, 37: 85-90.
[39] Wu W, Yang M, Feng Q, et al. Chemical characterization of rice straw-derived biochar for soil amendment [J]. Biomass &Bioenergy, 2012, 47(4): 268-276.
[40] 武书彬,胡元,娄瑞等. 木质纤维生物质及其组分的理化特性与热解规律 [M]. 北京:科学出版社, 2013.
[41] Purakayastha T J, Kumari S, Pathak H. Characterisation,stability, and microbial effects of four biochars produced from crop residues [J]. Geoderma, 2015, 239: 293-303.
[42] 朱志强,李坤权. 磷酸低温活化蔗渣基中孔生物炭及其影响因素 [J]. 环境工程学报,2015,9(6): 2667-2673.Zhu Zhiqiang, Li Kunquan. Preparation and its influence factors of mesoporous activated carbon from bagasse with phosphoric acid activation at low temperature [J]. Chinese Journal of Environmental Engineering, 2015, 9(6): 2667-2673. (in Chinese with English abstract)
[43] Feng Youzhi, Xu Yanping, Xie Zubin, et al. Mechanisms of biochar decreasing methane emission from Chinese paddy soils [J]. Soil Biol & Biochemistry, 2012, 46: 80-88.
