基于信号特征分析的植物体表电信号记录模式选择
2018-03-10王子洋范利锋王永千李进海王忠义
王子洋,范利锋,王永千,李进海,周 桥,黄 岚,王忠义
0 引 言
在植物中发现生物电现象已经有 100多年的历史,国内外学者在植物电信号检测和分析研究上做了很多工作[1-4]。植物电的研究对象从以捕蝇草、含羞草以及跳舞草等具有明显叶片活动的高敏感度植物为主[5-6],已经延伸到模式植物拟南芥,小麦、玉米等作物[7-10],以及芦荟、燕子掌等观赏性植物[11];其信号类型从机械刺激出捕蝇草的动作电位,到以烧伤、光照、盐刺激诱导的变异电位,以及局部电位为主[12-15];其检测技术从用非极化金属电极刺入植物中引出接触部位整体的电位变化,到使用玻璃微电极引出细胞膜内电位变化,以及用多电极阵列、荧光染料标记探索群体电信号胞间传递[16-17]。二十世纪初,科学家们主要使用电流计(galvanometer)来探索植物兴奋的电活动[5-6,18]。通过对电生理领域的不断探索和电子技术的发展,大部分研究人员们开始使用放大器(electronic amplifier and potentiometer)来对电位进行检测[1-6]。由于植物产生的电信号频率极低,一般不对检测系统添加高通滤波器(即交流耦合方式)进行信号采集和处理[2,5]。在2000年以后,国内与国外个别研究组使用了交流耦合方式对植物进行静息信号的采集与分析[11,19-21]。
在植物电生理领域中,目前最小的研究单位是具有运输离子功能的膜蛋白,如钾离子通道,质子泵等。植物电信号的本质是离子跨膜运动所导致细胞极化程度变化。已有的研究表明,许多生理过程都伴随着细胞膜极化程度的改变,如:植物的光合作用,呼吸作用,化学递质分泌等[22-23]。高等植物的电活动绝大多数都是通过环境变化进行诱导产生,包括温度、光照等环境因素变化均可以诱导出植物电信号。植物的电活动现象更加倾向于是对环境变化的反馈。植物细胞不同于动物心肌等细胞,植物电生理领域的研究中,并未确凿发现可以产生自发的、短时间间隔且具有明显节律性的电信号,这甚至在植物电生理领域已经产生过争论[24]。对植物的节律研究主要围绕昼夜节律和光照节律对植物本身的影响[25-26],也有快速自发的节律性微弱信号在植物中被发现,但相关研究甚少[27]。
国内外学者对植物电信号的频率分布集中在 10 Hz以内已有共识[5,8,21],然而在信号幅度上,国内部分研究者对植物电信号幅度量级是微伏级还是毫伏级存在疑惑[21]。因此,本文通过小麦和含羞草作为试验样品,以光诱导局部电位和烧伤诱导变异电位为例,探讨并描述了直流耦合模式记录数据与交流耦合模式记录数据幅度区别,同时依据信号功率密度时频分布来阐述信号的频率分布,讨论了记录模式中影响较大的噪声源,分析了 2种耦合记录模式对抗噪声方面各自的特点,最后对信号可信度进行了讨论。
1 材料与方法
1.1 材料选择与培养
试验样品采用德抗 961品种的小麦(中国农业大学农学院提供)和易记录电信号的敏感性植物含羞草。用10%次氯酸钠溶液对小麦种子浸种消毒15 min,用去离子水冲洗3~6遍。以去离子水在暗处浸种12~24 h后,选择萌发一致的种子置于培养皿中的发芽纸上,加去离子水以湿润发芽纸,每天更换溶液和发芽纸。室温下培养,光暗周期为14(光)/10(暗)h,温度周期为28/26 ℃,相对湿度60%,萌发4~5 d后进行试验;含羞草为室内自然光下培养,土培(草炭土:珍珠岩:蛭石=3:1:1体积比)温度周期26/20 ℃,3~4月龄,主枝长度可达30 cm。
1.2 信号采集
使用自制Ag-AgCl电极作为记录电极和参比电极,方法详见参考文献[28],使用万向微操纵器(STW-3C,成都仪器厂,中国)控制记录电极,以产生微小位移。整体试验在自制防震台上,如图1c所示。记录电极以及参比电极位置如图1a,1b所示。在记录电极与活体样品(小麦叶片,含羞草叶柄)的接触部分,使用0.5%琼脂,5 mmol/L氯化钾胶质进行电极与样品接触点耦合处理,图1a中两处虚线部分均为耦合胶质,以减小接触噪声。图1b中参比电极浸入在0.2%琼脂,5 mmol/L氯化钾的移液管中,插进土中作为电位参考点[28]。使用高阻抗放大器(SWF-1B,成都仪器厂,中国)进行信号前置放大,再将其输出端接到生理信号采集系统(RM6240BD,成都仪器厂,中国)进行信号采集,采样频率200 Hz,交流耦合模式下时间常数可以设置为5、1、0.1、0.01和0.001 s。通过上位机软件进行信号分析,绘图等[29-30],整体试验示意图如图1c所示。在记录过程中,针对同一个记录电极,连接直流耦合挡位和交流耦合挡位,同步进行信号记录,交流耦合档的时间常数为1 s,即下限截止频率为0.16 Hz。交流耦合的原理是在记录直流信号的基础上,增加了高通滤波器。在试验中,电极漂移的影响会随记录时间的增长而变大,为了避免电极漂移对信号产生影响,小麦光照电位采集时间控制在5 h以内,含羞草试验中,电位记录控制在10 min以内。信噪比计算方法使用公式(1)进行计算,其中Vs为信号峰峰值,Vn为基线噪声峰峰值[9]。
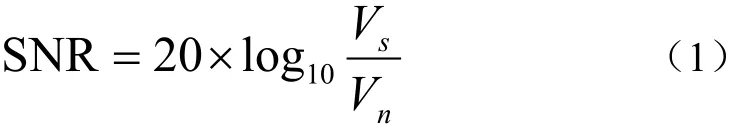
1.3 信号诱导方法
在光照诱导局部电位试验中,光源(MHAA-100W,MORITEX,日本)放置在法拉第屏蔽网外。通过鹅颈式光纤(A08400,MORITEX)将光打到小麦样品正上方,该方法可以有效地隔离光源中卤钨灯热辐射对小麦电信号的影响。试验环境温度保持在27~28 ℃之间,叶表温度维持在 26~27 ℃之间。试验过程中使用强度约为144 μmol/m2s的光照进行持续刺激,在刺激之前需要保持10~30 min的暗处理。烧伤诱导含羞草变异电位试验中,使用火焰外焰接触含羞草最外侧叶尖部进行热刺激来诱导变异电位,并同步录制视频(小蚁运动相机,小蚁科技,中国),通过查看试验的视频记录,可知热刺激时间约为0.3 s。
1.4 信号阻滞方法
在光诱导小麦电信号试验中,使用带有钙离子通道阻滞剂[17,31]的胶质(0.5%琼脂,5 mmol/L氯化钾,10 mmol/L氯化镧)与叶片相接触,如图1a所示,在试验过程中,使用带有阻滞剂的胶质放置在记录电极连接处(见图 1a中虚线内),进行阻滞4 h后再记录电信号。
1.5 数据处理
对直流耦合记录模式采集的植物电信号做 STFT(short-time Fourier transform)变换,用来实现信号功率密度时频分布图。这样,不但可以清晰地探明植物电信号的主要功率频率分布,而且可以根据输入信号的种类不同,来查询不同时间段的频率分布,可以和交流耦合记录模式进行相互比较。该方法如公式(2)所示。
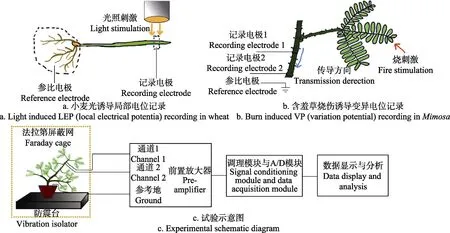
图1 小麦和含羞草电信号诱导试验方法及原理Fig.1 Schematic diagram of electrical signal recording in wheat and Mimosa
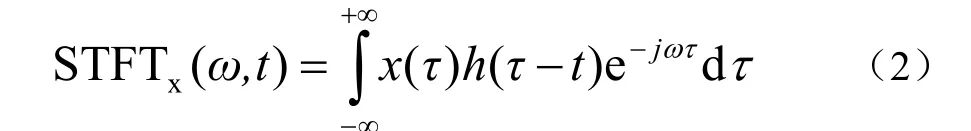
式中 x(τ)代表输入信号,h(τ-t) 代表窗函数,τ表示窗函数宽度。目前该方法已在心电领域对心音信号进行处理等[32-33]。我们使用MATLAB 2016a中的spectrogram(xt,window (win_width),overlap,nfft,fs)函数进行功率密度时频分布图绘制。在保证高时间分辨率和频率分辨率的前提下选用汉明窗(hamming)作为窗函数。其中win_width= 1 000,overlap=0.5*win_width,nfft=1 024,fs=100,即以窗宽为1 000样点(10 s),交叠数为500(5 s)的汉明窗,频率分辨率为0.097 Hz(fs/nfft),做短时傅立叶变换。
2 结果与分析
分别对光诱导的小麦局部电位和烧伤诱导的含羞草变异电位进行了 3次重复记录。小麦局部电位试验中,直流耦合档和交流耦合档记录到的信号均具有较高重复性;含羞草变异电位波形虽然重复性不高,但是其功率分布频率具有稳定性。
2.1 含羞草与小麦电信号直流耦合与交流耦合同步记录
图2a,2b为小麦光诱导局部电位。光照刺激后,直流耦合记录信号峰-峰值约为69 mV,而交流耦合记录信号中峰-峰值只有约2.7 mV,直流耦合记录信号变化幅度远大于交流耦合记录信号。其他波形参数包括持续时间、斜率等均具有明显差异。在小麦直流耦合记录的信号功率密度时频分布图中,可以观察到全时间段信号的主要功率分布在0.2 Hz以内,而在光照刺激后最初的前100 s中,存在0.2 Hz至1 Hz之间的少量的功率分布。这个结果与交流耦合记录到的数据具有较强的一致性。以0.16 Hz作为截止频率的交流耦合记录方式滤掉了绝大部分的有效信息。
如图2c,2d所示,含羞草烧伤变异电位功率分布主要集中在0.15 Hz以下,与小麦光诱导局部电位信号特征相似,电信号功率分布均集中在低频范围内。交流耦合记录的信号峰-峰值约33 mV,直流耦合记录的信号的去极化幅度约为70 mV。在25至30 s之间20 dB以上的功率强度已达到0.6 Hz。虽然功率的频率分布要明显高于光诱导下的局部电位数据,但是0.1 Hz以内依然占有超过50%的功率分布。在变异电位的记录中,使用0.16 Hz为截止频率的交流耦合记录模式也会滤掉绝大部分的有效信息。
从小麦的光诱导局部电位信号和含羞草烧伤诱导的电位信号中可以发现,无论是用直流耦合模式和交流耦合模式都可以对信号进行采集,但信号的波形和强度有所差异。事实上交流耦合所记录到的数据是在直流数据的基础上经过了高通滤波,交流记录数据与直流耦合记录数据在数值上是微分关系。从结果中可以发现,使用直流耦合记录模式可以更加全面的反应植物缓慢的电活动。交流耦合记录模式虽然放大了快变的电信号,但是遗漏了植物电活动中的缓慢变化。在信号幅度上,直流耦合记录的信号幅度基本维持在几十毫伏的量级。交流耦合记录到的信号幅度则要小于直流耦合记录的结果,尤其是慢变化的光诱导的局部电位。
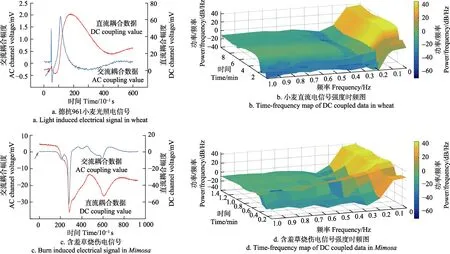
图2 小麦和含羞草电信号直流耦合与交流耦合同步记录Fig.2 DC(direct current) coupled and AC(alternating current) coupled electrical signal recording synchronously in wheat and Mimosa
2.2 交流耦合模式不同下限截止频率下小麦局部电位记录
为了进一步研究不同耦合方式对信号采集的影响,对小麦光照产生的电信号同时进行 4路通道的采集,如图 3所示,分别为直流耦合模式,0.03、0.16和 1.6 Hz下限截止频率的交流耦合模式。结果显示下限截止频率越高,所记录到的信号幅度越低。在图3a的直流耦合数据中,4 min以后的缓慢变化的信号在交流耦合模式中均未有明显变化。在记录刚进行光照刺激时的快变信号时,交流耦合模式的信号变化更加剧烈。
2.3 含羞草变异电位传导与小麦局部电位阻滞
我们需要通过药理学方法或其他方式进行验证所记录到的植物电信号是植物本身的电活动而非电极噪声或是环境干扰。针对烧伤诱导含羞草的变异电位,我们使用信号传导的方式来进行验证。记录电极1与记录电极2的固定位置如图1b所示。图4a、4b是含羞草变异电位2根记录电极的直流耦合与交流耦合记录结果,从结果可知,直流耦合与交流耦合数据均有明显的延迟现象,可以看出信号从记录电极1传递至记录电极2。而箭头所指为热刺激时间点,在箭头处可以看到 2根电极同时受到了干扰产生噪声。
小麦光诱导局部电位没有传导现象,我们通过使用钙离子通道阻滞剂氯化镧对小麦进行处理,在使用氯化镧处理前记录一组光诱导局部电位数据,然后对小麦叶片进行处理4 h,在4 h后再记录一组小麦光照诱导局部电位。箭头指向光照开始时间点。在图4c中,使用直流耦合模式记录到的数据可以看出光照的第一个去极化波幅度有了明显降低,图4d的交流耦合数据中,受到氯化镧处理的小麦所产生的波形幅度则产生明显降低。
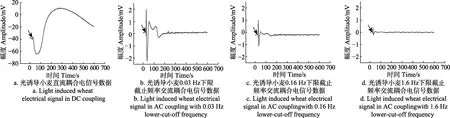
图3 直流耦合与不同下限截止频率交流耦合小麦电信号记录Fig.3 Measurement of DC coupled and AC coupled with different lower-cut-off frequency electrical signal in wheat
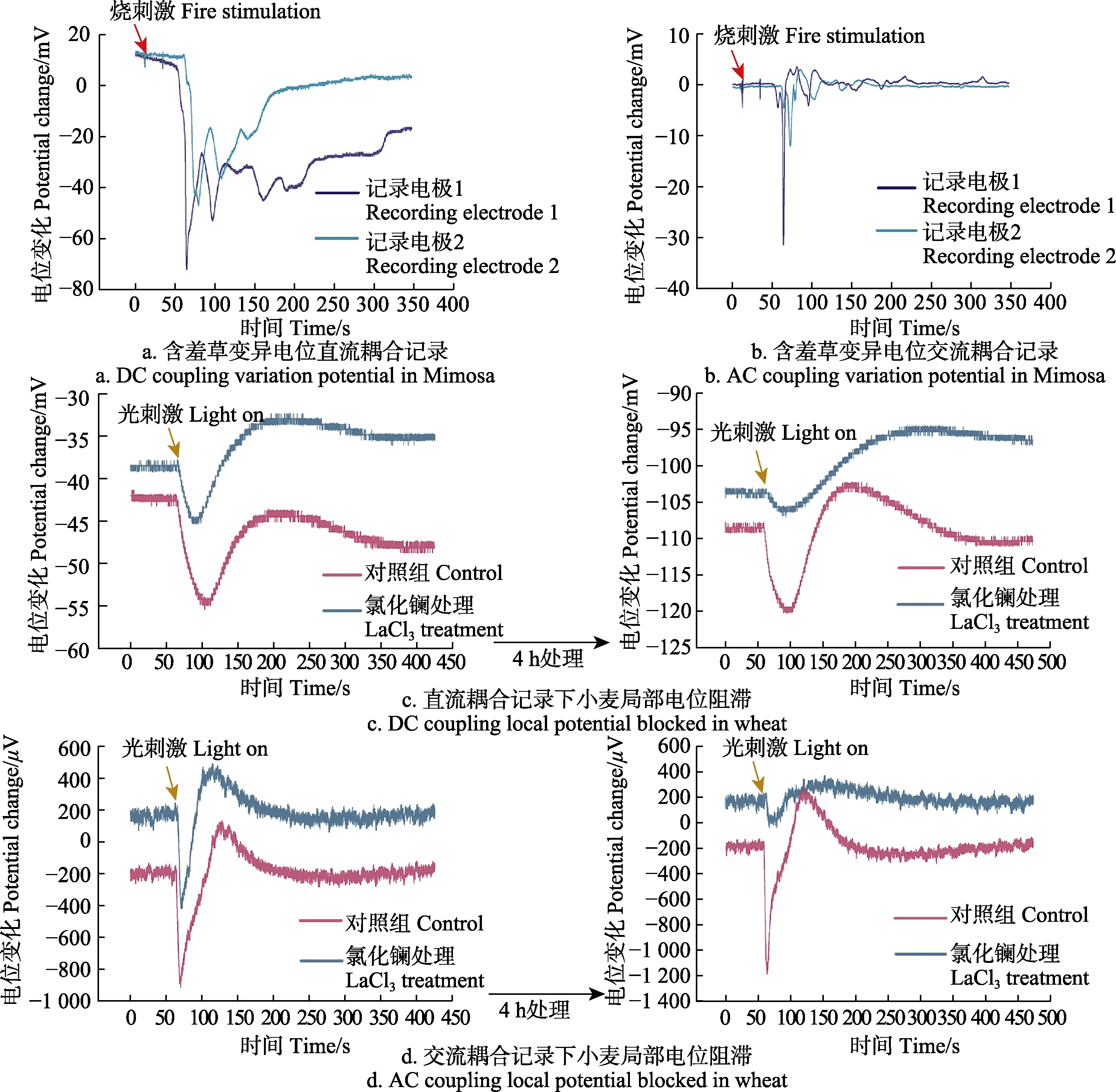
图4 植物电信号的传导与阻滞Fig.4 Plant electrical signal transmission and block
3 讨 论
3.1 信号噪声来源及消除方法
植物电信号属于微弱信号,其等效信号源输出电阻较大,可达 GΩ量级,因此在采集记录电位信号时的噪声抑制一直是个重要问题。如果仅考虑由样本与电极构成的通路引入的噪声,常见的噪声源有 50 Hz的工频噪声、操作员人体的静电电荷积累所产生的干扰和其他环境影响。所以,在记录植物电信号时,需要在法拉第屏蔽网中进行。并且,以单点接地的形式将屏蔽网内的夹持器等接地,试验操作时需要带上防静电手环,控制环境温湿度处于相对平衡值。
在使用直流耦合记录时,所遇到的主要问题是氯化银半电池的电位漂移。由于氯化银电极周围接触溶液离子浓度的影响,可能产生几十毫伏以上的电位漂移。这在长时间使用溶液进行电极与样品的耦合时容易出现。交流耦合记录模式则可以减弱电极电位漂移所产生的影响,然而对记录植物电信号而言,交流耦合记录模式则更容易受到如人体接触或者样品轻微移动等其他噪声源的干扰[5-6]。
3.2 两种耦合记录模式的电位采集分辨率
在以氯化银电极作为传感器的宏观电信号记录当中,直流耦合记录模式的特点是较宽的电压幅度采集范围。由于静息电位和电极接触电位的叠加使得基线的电位非零,并且伴随温度影响,最高有近700 mV的电位变化。因此,植物电信号采集系统的直流记录范围至少应达-1 V至+1 V,才可以确保记录基线在记录范围以内。再者,直流记录信号本身的变化范围大,如图2a、2c所示,信号幅度本身也达到60 mV以上,所以直流记录需要有较大的电压幅度记录范围。然而,较宽电压幅度记录范围会导致电压分辨率降低。
当采用交流耦合记录模式时,信号的直流成分(静息电位和电极接触电位)将被阻隔掉,只记录电信号的变化率。记录到的信号幅度较小,采集系统可采用较大的放大倍数,电压采集分辨相对较高。从图2a中可以看出直流耦合模式记录到的信号已经变化了 69 mV,而交流耦合模式记录的信号变化范围仅仅2.7 mV。由于信号采集范围的缩小,则可以将小信号进一步放大,从而提高了信号电压采集分辨率。然而,当有效信号达到“微伏”量级时,采集仪器系统噪声,电极接触噪声(1/f noise),电极热噪声则需要考虑和排除[34-35]。
3.3 植物电信号数据记录真实性与量级
尽管目前的一些研究在分析植物电信号时也会采用EEG(Electroencephalography)信号所用的分析方法[2,13,36-37],但值得注意的是,植物细胞膜电位变化和植物电信号产生的离子机制,完全不同于动物细胞膜电位和电活动[5,22-23]。一般认为,脑皮质大量神经元的突触后电位同步总和,构成头皮记录得到的脑电图(EEG)[38-39]。所记录脑电波的振幅主要决定于脑内发生的电活动的强度和参考电极的选择,幅度0.5 至100 μV[38-39]。由于植物细胞膜电位变化的离子机制和传导机制与动物不同,所以,以交流耦合模式从植物体上记录的微伏级电信号,到底是不是植物的自发电信号,必须在得到离子通道、胞内记录、微电极阵列及药理学试验数据的支持的情况下,才能确定其结论。
交流耦合记录模式与直流耦合记录模式记录到的植物电信号波形形状、幅度、频率会有明显差异,这可能使国内外部分学者对植物电信号幅度量级产生了疑惑。近十几年,国内外多个植物电信号研究组对交流耦合模式所记录到的植物静息信号[20-21],或是微伏级所谓的“低幅度信号”[19,40]进行研究,探索植物自身电信号与环境的关系。然而,正如上文所说,通过交流耦合方式来研究微伏级的信号时,首先应考虑如何排除掉仪器噪声,传感器热噪声,接触噪声与其他环境噪声干扰。根据植物电生理领域自1873年以来已有的国内外研究成果,极少发现随机性的植物电信号[5-6,41]。绝大部分通过直流耦合方式记录到的信号均可以划分至动作电位,变异电位,系统电位以及局部电位这 4类范围,而呈现随机性的、通过交流耦合方式记录到的微伏级植物电信号不同于上述 4类植物电信号。本文中通过交流耦合模式所记录到的微伏级植物电信号均呈非随机性,通过对比图 3中交流与直流耦合模式记录到的数据可知,植物的部分电活动在交流耦合模式下是难以记录到的。
然而,国内外所有发表的呈现随机性的微伏级信号迟迟没有对信号本身的离子机制进行讨论,并且对该类微伏级信号进行分析的研究组呈逐年增加趋势。因此,讨论所记录信号的真实性显得尤为重要。为了区别植物电活动所产生的信号和环境噪声,通常采用以下方式来进行信号验证:1)确认采集仪器和传感器本身的噪声范围,如图2a中交流耦合数据信噪比约为36.8 dB,排除采集仪器和传感器本身的热噪声与接触噪声。氯化银电极的自噪声范围是纳伏至微伏级[42-44],并不影响测量结果。2)在记录动作电位和变异电位中,可以使用多电极记录方式,通过信号传导来确定其真实性。因为环境噪声干扰会同时对多电极产生影响,无法记录到传导现象。如在图1b含羞草变异电位记录中使用了2根记录电极,相距4 cm来进行信号传导验证,数据如图4a、4b所示,2根记录电极所记录信号具有延时。3)局部电位不能传导,需要使用离子通道阻滞剂验证信号真实性,这是一种较为适用的方法[45],文中小麦光诱导的局部电位验证如图4c、4d所示,在进行4 h的钙通道阻滞剂(氯化镧)阻滞后部分信号幅度具有明显降低,这与文献[31]中光诱导植物电信号的离子机制相对应,该方法也可以用于变异电位和动作电位的阻滞,以确认信号的真实性。
4 结 论
本文记录了含羞草和小麦 2种植物在不同记录模式下的电信号,探索了不同耦合记录模式所记录植物体表波形数据特征。1)通过分析两类样品的波形幅度可知,在使用非极化金属电极进行植物表面电位记录时,直流耦合记录或者交流耦合记录方式均可以获得植物电信号数据,虽然所反映的是同一植物电活动,但 2种耦合方式所记录到的植物电信号在波形、幅度上会有明显差别。2)在记录高等植物电信号时,使用交流耦合方式记录可以观察快变信号,并需要通过直流耦合信号记录与分析确认功率的频率分布,以确定记录所需的合理的下限截止频率。3)验证所记录植物电信号真实性是深入研究和探索植物电活动的前提,应使用生物以及药理学方法来证明所记录的信号是由植物本身产生,而非采集回路噪声和环境干扰。
[1] Volkov Alexander G, Nyasani Eunice K, Tuckett Clayton, et al. Electrotonic potentials in Aloe vera l.: Effects of intercellular and external electrodes arrangement[J]. Bioelectrochemistry,2017, 113: 60-68.
[2] 刘锴,习岗,贺瑞瑞,等. 渗透胁迫下玉米叶片电位波动边际谱的变化与意义[J]. 农业工程学报,2017,33(1):199-205.Liu Kai, Xi Gang, He Ruirui, et al. Changes and significance of marginal spectrum on maize leaves potential fluctuations under osmotic stress[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE),2017, 33(1): 199-205. (in Chinese with English abstract)
[3] Bénédicte Wenden, Edwards Kieron D, Hall Anthony J W, et al. Light inputs shape the Arabidopsis circadian system[J].Plant Journal for Cell & Molecular Biology, 2011, 66(3):480-491.
[4] Pruneda-Paz Jose L, Kay Steve A. An expanding universe of circadian networks in higher plants[J]. Trends in Plant Science,2010,15(5): 259-265.
[5] Volkov Alexander G. Plant Electrophysiology: Theory and Methods[M]. Springer, 2006.
[6] Volkov Alexander G. Plant Electrophysiology- Signaling and Responses[M]. 2012.
[7] Mousavi S A, Chauvin A, Pascaud F, et al. Glutamate receptor-like genes mediate leaf-to-leaf wound signalling.[J].Nature, 2013, 500(7463): 422.
[8] Hedrich Rainer, Dreyer Ingo. Electrical wiring and longdistance plant communication[J]. Trends in Plant Science,2016, 21(5): 376.
[9] Masi E, Ciszak M, Stefano G, et al. Spatiotemporal dynamics of the electrical network activity in the root apex.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009,106(10): 4048.
[10] Novikova E M, Vodeneev V A, Sukhov V S. Mathematical model of action potential in higher plants with account for the involvement of vacuole in the electrical signal generation[J].Biochemistry Supplement, 2017, 11(2): 151-167.
[11] 王兰州,李峤. 燕子掌微弱电信号的计量研究[J]. 中国计量学院学报,2009,20(3):195-200.Wang Lanzhou, Li Jiao. Testing and measurements of weak electrical signals in Crassula portulacea[J]. Journal of China Jiliang University, 2009, 20(3): 195-200. (in Chinese with English abstract)
[12] Surova L, Sherstneva O, Vodeneev V, et al. Variation potential propagation decreases heat-related damage of pea photosystem I by two different pathways[J]. Plant Signaling& Behavior, 2016, 11(3): 00-00.
[13] Lan Huang, Wang Zhong Yi, Zhao Long Lian, et al.Electrical signal measurement in plants using blind source separation with independent component analysis[J]. Computers& Electronics in Agriculture, 2010, 71(1): 54-59.
[14] Szechyńska-Hebda Magdalena, Lewandowska Maria, Karpiński Stanisław. Electrical signaling, photosynthesis and systemic acquired acclimation[J]. Frontiers in Physiology, 2017, 8: 684.
[15] Chatterjee Shre Kumar, Das Saptarshi, Maharatna Koushik,et al. Exploring strategies for classification of external stimuli using statistical features of the plant electrical response[J].Journal of the Royal Society Interface, 2015, 12(104): 20141225.
[16] Zhao Dong Jie, Chen Yang, Wang Zi Yang, et al. Highresolution non-contact measurement of the electrical activity of plants in situ using optical recording[J]. 2015, 5(13425):1-14.
[17] Zhao Dong Jie, Wang Zhong Yi, Huang Lan, et al. Spatiotemporal mapping of variation potentials in leaves of Helianthus annuus L. seedlings in situ using multi-electrode array[J].Scientific Reports, 2014, 4: 5435.
[18] Pickard B G. Action potentials in higher plants[J]. Botanical Review, 1973, 39(2): 172-201.
[19] Pereira D R, Papa J P, Saraiva G F R, et al. Automatic classification of plant electrophysiological responses to environmental stimuli using machine learning and interval arithmetic[J]. Computers & Electronics in Agriculture, 2017,dio.org/10.1016/j.compag.2017.12.024.
[20] 陆静霞,於海明,陈士进,等. 基于植物电信号的环境因子预测模型[J]. 农业机械学报,2013,44(11):229-233.Lu Jingxia, Wu Haiming, Chen Shijin, et al. Environment factor prediction models based on plant electrical signals[J].Transactions of the Chinese Society of Agricultural Machinery,2013, 44(11): 229-233. (in Chinese with English abstract)
[21] 王兰州,李海霞,林敏. 等植物微弱电波信号的时、频域分析[J]. 中国计量学院学报,2005,16(4):294-298.Wang Lanzhou, Li Haixia, Lin Min, et al. Analysis of plant electrical signal in the time domain and frequency domain[J].Journal of China Jiliang University, 2005, 16(4): 294-298.(in Chinese with English abstract)
[22] Fromm J, Lautner S. Electrical signals and their physiological significance in plants[J]. Plant Cell & Environment, 2007,30(3): 249.
[23] Yan Xiaofei, Wang Zhongyi, Huang Lan, et al. Research progress on electrical signals in higher plants[J]. Progress in Natural Science, 2009, 19(5):531-541.
[24] Gradman D. Intelligent Plant or Stupid Studies[N/OL]. Lab Times, 2010-03-30 [2010-2-17]. http://www.labtimes.org/labtimes/issues/lt2010/lt03/lt_2010_03_30_33.pdf
[25] Golden S S, Strayer C. Time for plants. Progress in plant chronobiology[J]. Plant Physiology, 2001, 125(1): 98-101.[26] Dodd A N, Salathia N, Hall A, et al. Plant circadian clocks increase photosynthesis, Growth, Survival, and Competitive Advantage[J]. Science, 2005, 309(5734): 630-633.
[27] Karlsson L. Nonrandom bioelectrical signals in plant tissue[J]. Plant Physiology, 1972, 49(6): 982-986.
[28] Mousavi S A, Mousavi S A, Nguyen C T, et al. Measuring surface potential changes on leaves[J]. Nature Protocols,2014, 9(8): 1997.
[29] Zhao Dongjie, Wang Zhongyi, Li Jun, et al. Recording extracellular signals in plants: A modeling and experimental study[J]. Mathematical & Computer Modelling, 2013, 58(3-4):556-563.
[30] Chen A, Chen Y, Tang Y, et al. Hippocampal AMPARs involve the central sensitization of rats with irritable bowel syndrome [J]. Brain & Behavior, 2017, 7(3): 1-8.
[31] Krol E, Trebacz K. Calcium-dependent voltage transients evoked by illumination in the liverwort conocephalum conicum[J]. Plant & Cell Physiology, 1999, 40(1): 17-24.
[32] Fulop S A, Fitz K. Algorithms for computing the timecorrected instantaneous frequency (reassigned) spectrogram,with applications[J]. Journal of the Acoustical Society of America, 2006, 119(1): 360-371.
[33] 朱冰莲,杨磊. 心音信号的短时傅立叶变换分析[J]. 重庆大学学报:自然科学版,2004,27(8):83-85.Zhu Binglian, Yang Lei. FEM analysis on the earth pressure behind the panel of post-panel retaining wall[J]. Journal of Chongqing University: Natural Science Edition, 2004, 27(8):83-85. (in Chinese with English abstract)
[34] Huigen E, Peper A, Grimbergen C A. Investigation into the origin of the noise of surface electrodes[J]. Medical &Biological Engineering & Computing, 2002, 40(3): 332-338.[35] Liu X, Demosthenous A, Donaldson N. Platinum electrode noise in the ENG spectrum[J]. Medical & Biological Engineering & Computing, 2008, 46(10): 997-1003.
[36] Cabral Euvaldo F, Pecora Paula Cristina, Arce Aldo Ivan C,et al. Original papers: The oscillatory bioelectrical signal from plants explained by a simulated electrical model and tested using Lempel-Ziv complexity[J]. Computers &Electronics in Agriculture, 2011, 76(1): 1-5.
[37] Das Saptarshi, Ajiwibawa Barry Juans, Chatterjee Shre Kumar, et al. Drift removal in plant electrical signals via IIR filtering using wavelet energy[J]. Computers & Electronics in Agriculture, 2015, 118(C): 15-23.
[38] Geethanjali P. Fundamentals of Brain Signals and Its Medical Application Using Data Analysis Techniques[M]. Springer International Publishing, 2015.
[39] Schaul N. The fundamental neural mechanisms of electroencephalography[J]. Electroencephalography & Clinical Neurophysiology, 1998,106(2): 101-107.
[40] Cabral E F, Pecora P C, Arce A I C, et al. The oscillatory bioelectrical signal from plants explained by a simulated electrical model and tested using Lempel–Ziv complexity[J].Computers & Electronics in Agriculture, 2011, 76(1): 1-5.
[41] Sukhova E, Akinchits E, Sukhov V. Mathematical models of electrical activity in plants[J]. J Membr Biol, 2017(3): 1-17.
[42] 卫云鸽,曹全喜,黄云霞,等. 海洋电场传感器低噪声Ag/AgCl电极的制备及性能[J]. 人工晶体学报,2009(s1):394-398.Wei Yunge, Cao Quanxi, Huang Yunxia, et al. Preparation and properties of Ag/AgCl electrode with low noise of marine electric field sensor[J]. Journal of Synthetic Crystals,2009(s1): 394-398. (in Chinese with English abstract)
[43] 胡鹏,谭浩,龚沈光. Ag/AgCl电极自噪声的测定[J]. 海军工程大学学报,2011,23(2):68-71.Hu Peng, Tan Hao, Gong Shenguang. Measurement of Ag/AgCl electrode′s self-noise[J]. Journal of Naval University of Engineering, 2011, 23(2): 68-71. (in Chinese with English abstract)
[44] 黄芳丽,曹全喜,卫云鸽,等. Ag/AgCl电极的制备及电化学性能[J]. 电子科技,2010,23(6):29-31.Huang Fangli, Cao Quanxi, Wei Yunge, et al. The preparation and electrochemical performance of Ag/AgCl electrodes[J].Electronic Science and Technology, 2010, 23(6): 29-31. (in Chinese with English abstract)
[45] Krol E, Dziubinska H, Stolarz M, et al. Effects of ion channel inhibitors on cold and electrically-induced action potentials in Dionaea muscipula[J]. Biologia Plantarum, 2006, 50(3):411-416.
