甘蓝型油菜茎秆纤维组分含量和木质素单体G/S近红外模型构建
2018-03-10陈雪萍刘世尧尹能文荆凌云魏丽娟林呐肖阳徐新福李加纳刘列钊
陈雪萍,刘世尧,尹能文,荆凌云,魏丽娟,林呐,肖阳,徐新福,李加纳,刘列钊
(1西南大学农学与生物科技学院/重庆市油菜工程技术研究中心,重庆400715;2西南大学园艺园林学院,重庆400715)
0 引言
【研究意义】甘蓝型油菜(Brassica napus L.)作为世界性的油料作物,是食用油和蛋白质饲料的重要来源,也是加工业及生物能源的重要原料[1]。纤维组分是植物细胞壁的主要成分,在油菜茎秆中与植株抗病抗倒伏密切相关[2-3],籽粒中纤维组分含量高低直接影响饼粕的饲用价值[4],木质素单体G/S与油菜抗病存在显著相关[5]。植物纤维组分含量测定方法有 Van Soest法、王玉万法以及高效液相色谱法等[6],木质素单体含量测定方法有酸解法、硫代酸解法和高锰酸盐氧化法等[7]。这些传统的化学测定方法耗时长、操作过程繁琐、成本高,不能满足大批量测定的需求,较为新颖的高效液相色谱法虽然结果准确,但设备昂贵,同样不适合推广。近红外光谱分析技术(near infrared spectroscopy,NIRS)具有快速、无损、低成本、准确、无污染的优点,无需对样品进行复杂的预处理,就能完成样品中多种组分的定量测定[8-9]。【前人研究进展】近红外光谱技术在木本植物及草本植物纤维组分含量检测中被广泛应用。毛竹、杉木、桉树、玉米、苜蓿干草、小麦和水稻等植物中纤维素、半纤维素和木质素近红外模型已经建立并用来快速分析其含量[10-15]。近红外光谱分析技术在油菜品质育种中的应用也十分广泛,其中籽粒品质研究居多。20世纪80年代初,加拿大谷物实验室利用近红外光谱成功预测了油菜籽粒中油分、蛋白质和硫苷含量[16-17]。VELASCO等[18]建立了油菜籽粒脂肪酸组分的NIRS分析定标方程。FONT等[19-20]先后建立油菜籽粒ADL近红外模型,然而该模型未能用于其他纤维组分含量的测定。直到2012年,WITTKOP等[21]构建了适用于甘蓝型油菜籽粒纤维组分含量分析的NDF、ADF和ADL近红外模型。单子叶植物的木质素由G、S和H型木质素单体组成,而双子叶植物主要是由G型木质素单体和S型木质素单体组成[22]。国外已开始对木质素单体比例近红外预测模型可行性进行探究,在硬木、软木、禾本科以及豆科植物中建立了S/G单体比例多变量的化学预测模型[23-24]。【本研究切入点】目前,国内外已构建了预测含油量、蛋白质、硫苷、芥酸、脂肪酸、纤维组分等油菜籽粒品质指标的NIRS数学模型,而油菜茎秆纤维组分含量及木质素单体G/S预测模型尚未见报道。【拟解决的关键问题】采集供试材料的近红外光谱,通过内部交叉验证和外部验证研究近红外光谱法在纤维组分含量、木质素单体G/S测定中应用的可能性,旨在为甘蓝型油菜抗病、抗倒伏遗传育种提供参考工具。
1 材料与方法
1.1 试验材料
1.1.1 供试材料 茎秆纤维组分含量供试材料 376份,由200份资源材料和176份重组自交系材料组成。木质素单体G/S供试材料105份(资源材料70份,重组自交系35份),分别在2011和2013年种植于重庆市油菜工程技术研究中心。样品集分为校正集和检验集,校正集用于建立模型及模型的内部交叉验证,检验集用于模型的外部验证。本研究根据光谱学特征选取化学成分、含量具有代表性且3次重复精度较高的103份纤维组分含量和75份木质素单体G/S材料作为校正集,分别选取40份、30份化学值已知样本作为验证集。
1.1.2 样品准备 试验所用材料均为甘蓝型油菜品系,每个材料随机选取健康植株5株,距离地面20 cm处截取长度约30 cm的主茎,晒干后于60℃烘箱中烘干(约48 h),用FW80-1粉碎机彻底粉碎,充分混匀,收集至自封袋,样品重约40 g,密闭于干燥器中保存以采集近红外光谱。
1.2 纤维组分含量及木质素单体G/S的化学测定
纤维组分含量测定参照 VAN SOEST等[25]的方法。
木质素单体测定参照ROLANDO等的方法[26]。称取茎秆风干样品5 mg于15 mL反应瓶中,加入1 mL新鲜反应液(终浓度为2.5% BF3和10% EtSH溶于二氧杂环乙烷),100℃条件下反应4 h,冰上冷却5 min,加入200 μL内标,调pH至3—4。加入2 mL超纯水和1 mL CH2Cl2,涡旋后静置,收集下层有机相,用无水 Na2SO4干燥,氮吹仪吹干。挥干物重新溶于CH2Cl2中,加入50 μL嘧啶和100 μL的BSA,25℃静置4 h,进行GC分析,重复3次,取其平均值。色谱条件:RTX-5MS型弹性石英毛细管色谱柱(30 mm×0.25 mm×0.25 μm);FID检测器:载气为高纯氦气,载气流速为1.19 mL·min-1,进样口温度250℃;分流比20:1,进样量2 μL;柱升温程序:初始温度为50℃,以 35℃·min-1升温至 220℃,再以 0.5℃·min-1升温至230℃,最后以50℃·min-1升温到280℃,保留7 min。质谱条件:EI离子源,离子源温度200℃,电子能量70 eV,接口温度250℃;溶剂延迟5 min。
1.3 近红外模型的建立和检验
1.3.1 近红外扫描光谱的采集 将粉碎的样品置于室内环境24 h后,装入小圆型样品杯压实,样品量约为2.7 g。采用FOSS NIR Systems 5000型近红外光谱分析仪进行吸收光谱的采集,扫描范围为 1 100—2 498 nm,扫描次数为64次,分辨率为8 cm-1,为减少仪器波动和装样对光谱扫描的干扰,每个样品重复扫描3次,用光谱处理软件合并成平均光谱用于建模。
1.3.2 近红外检测模型的构建、筛选与检验 将化学测定值导入与近红外检测仪配套的化学计量学软件WinISI Ⅲ,剔除马氏距离GH(Global H)值大于3.0的超常样品,将马氏距离小于0.8的样品定义为相似样品,剩余的样品构成定标样品。使用无散射处理(None)、标准正常化+散射处理(SNV+Detrend)、标准正常化处理(standard normal variant,SNV)、去散射处理(Detrend Only)、标准化多元散射校正(Stand and MSC)、加权散射校正(Weighted MSC)和反相多元离散校正(Inverse MSC)来消除同一样品多次装样扫描结果产生的偏差。采用主成分回归法(PCR)、修正偏最小二乘法(MPLS)和偏最小二乘法(PLS)建立校正模型,模型的优劣采用内部交叉验证和外部验证评价,以校正标准差(SEC)、交叉验证标准差(SECV)、定标相关系数(RSQ)、交叉验证相关系数(1-VR)和预测标准差(SEP)等统计指标对模型进行综合评估。
2 结果
2.1 纤维组分含量及木质素单体G/S的测定
木质素单体 G/S样品的硫代硫酸解产物经GC-MS分析后,依据H、G和S型木质素单体的分子离子峰做定性鉴定。如图 1所示,定标样品 GM13L和GN280L的木质素单体含量差异较为显著,木质素单体组分在50 min内完全出峰,分离较为完全。由于H型木质素含量极低,本文仅统计G和S型木质素单体含量,其中GM13L单体G/S为0.804,GN280L样品中单体G/S为 1.180。纤维组分含量和木质素单体G/S近红外模型的校正集和检验集样品数据统计结果见表 1。茎秆材料的 NDF含量范围在 64.04%—85.34%,平均值75.55%;ADF含量范围在47.57%—64.02%,平均值 56.97%;ADL含量范围 6.31%—17.13%,平均值10.98%;木质素单体G/S范围在0.46—1.60,平均值 0.74。定标样品分布范围较广,差异明显,说明具有一定的代表性。
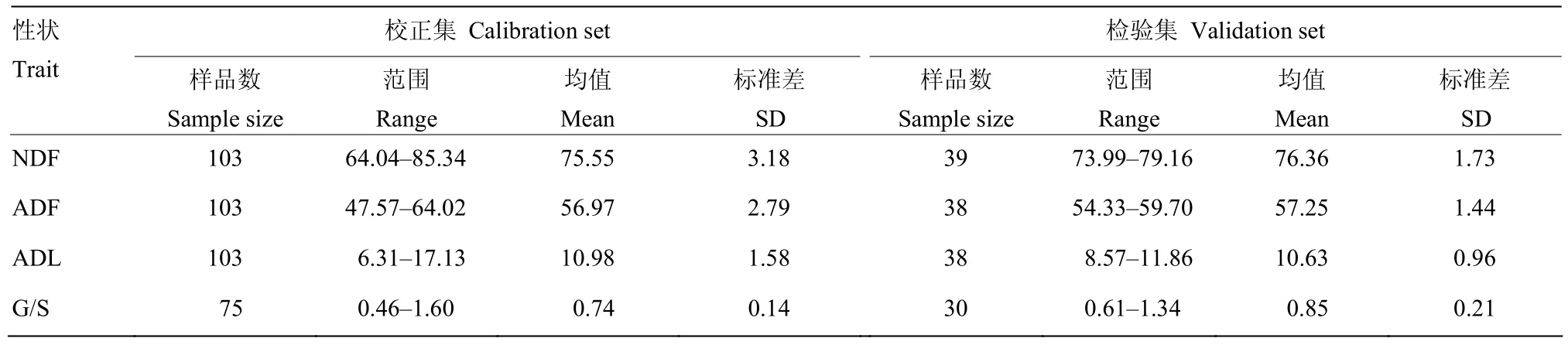
表1 油菜茎秆纤维组分含量和木质素单体G/S的测定Table 1 Measurement of stem fiber component content and lignin monomer G/S in rapeseed
2.2 近红外光谱的采集
近红外分析光谱的基础是样品的化学组成官能团在近红外区有特征吸收,吸光度与样品中成分含量大小有关。图 2所示为纤维组分含量和木质素单体G/S样品在1 100—2 498 nm的近红外漫反射光谱图,全波长范围内存在多个吸收峰。在1 450和1 940 nm处是水的特征吸收峰,分别为 O-H键一级倍频与合频吸收带,2 100 nm处吸收峰为O-H和C-O分子键二级倍频合频振动。不同样品在近红外光谱区吸收光谱特征基本一致,全光谱呈现低中高的变幅范围,说明样品主要成分基本相同,但各成分相对含量不同。

图1 样品GM13L和GN280L硫代硫酸解产物的主要气相色谱峰Fig. 1 Typical chromatograms for thioacidolysis products for GM13L and GN280L
2.3 近红外模型的建立
当回归方法采用修正偏最小二乘法(MPLS),光谱预处理分别采用None、SNV Only、Weighted MSC和SNV+Detrend时,构建的近红外预测模型其定标相关系数和交叉验证相关系数最大,校正标准差和交叉验证标准差最小。由表2可知,纤维组分含量和木质素单体G/S近红外模型内部交叉验证效果较好,1-VR分别为 0.864、0.861、0.872和 0.920,SECV分别为1.093、0.932、0.456和0.057,说明模型的预测准确性较好。

表2 近红外模型校正、内部交叉验证结果参数Table 2 The statistic parameters of calibration, cross-validation for NIRS models

图2 油菜茎秆纤维组分含量和木质素单体G/S的近红外吸收光谱图Fig. 2 NIRS spectra of stem fiber component content and lignin monomer G/S in rapeseed
2.4 近红外模型的检验
选取未参与定标的茎秆样品对所建纤维组分含量和木质素单体G/S模型进行验证。如图3所示,模型的预测值与化学值拟合存在较好的线性关系。相对误差反映测量结果偏离真值的实际大小,由表3可知,相对误差较小,说明预测结果较为准确。其中RSQ分别为0.837、0.818、0.870和0.935,SEP分别为0.680、0.636、0.348和0.054,表明纤维组分含量和木质素单体G/S近红外模型的预测准确度较好,能满足物质品质分析中对准确度的要求。
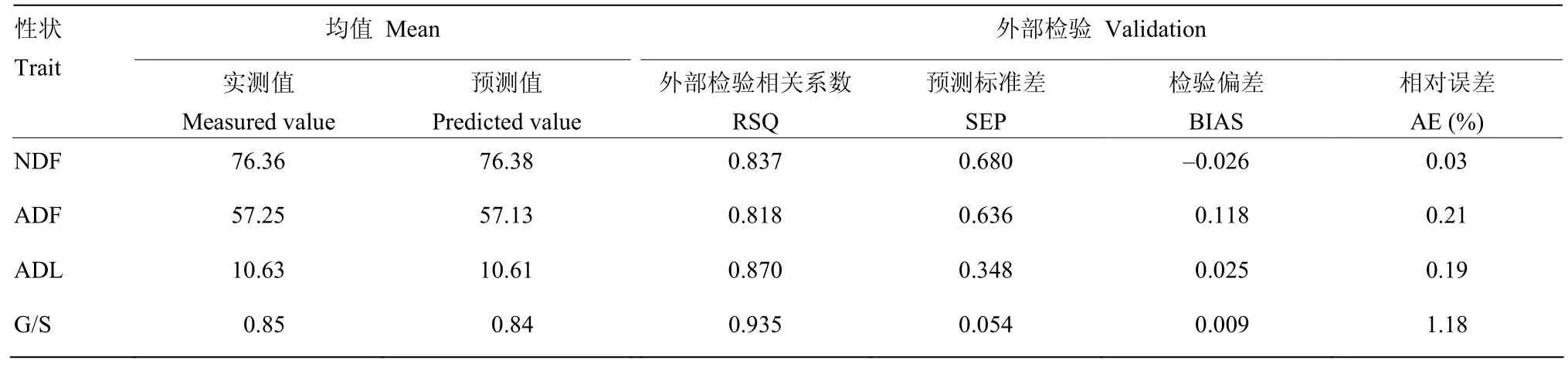
表3 近红外模型外部验证结果Table 3 External validation statistics for NIRS models
3 讨论
近红外光谱分析技术是一种新型的分析技术,它具有快速、高效、无损和适合在线分析等特点,在农业、制药和化石等领域得到了广泛应用[27-28]。近红外光谱主要是含氢基团的伸缩振动的倍频吸收谱带及伸缩振动和摇摆振动的合频吸收。植物纤维素主要由纤维素、半纤维素和木质素组成,其中纤维素为均一聚糖,半纤维素为两种或两种以上糖基的复合聚糖,都含有大量羟基,而木质素的基本结构单元是苯丙烷,苯环上具有甲氧基和羟基,可见这些成分在近红外光谱区都有较强的吸收。本试验中定标样品由资源材料和重组自交系材料组成。其中资源材料间存在较大差异,纤维组分含量及木质素单体比例分布范围较广,具有广泛的代表性;为提高模型准确性和可靠性,选取部分待测重组自交系材料参与建模,符合近红外建模的需要。本研究采用修正偏最小二乘法(MPLS)、偏最小二乘法(PLS)和主成分回归(PCR)的化学计量学方法进行分析建立定标模型,将校正模型进行对比研究可知,采用修正偏最小二成法建立回归方程最佳,这与李玉等[29]的研究结果一致。

图3 近红外模型检验集化学值与预测值的关系Fig. 3 The relationship between the predicted and measured values in validation set for NIRS models
在甘蓝型油菜的研究中,纤维组分含量化学测定复杂,准确的化学值测定难度较大,因此国内外少有关于纤维组分含量近红外模型构建的报道。姜训鹏等[30]基于近红外光谱技术对不同饲料原料的 NDF和ADF预测方法进行了研究,在近红外谱区中观察到1 450 nm、1 940 nm和2 100 nm处有明显吸收峰。本试验中在1 100—2 498 nm范围内主要有4个吸收峰,出峰位置分别为1 450 nm、1 940 nm、2 100 nm和2 274 nm,这与前人研究结果一致[30-32]。毛竹、杉木、桉树、玉米、苜蓿干草、小麦和水稻等中纤维素、半纤维素和木质素近红外模型已被建立并用来快速分析其含量[10-15]。WITTKOP等[21]建立甘蓝型油菜籽粒NDF、ADF和ADL近红外模型,外部检验相关系数分别为0.62,0.70和0.81,表明近红外光谱是一种有效检测油菜纤维组分含量的方法,但精确度还有待提高。本试验构建了甘蓝型油菜茎秆 NDF、ADF、ADL近红外分析模型,其外部检验相关系数分别为0.837、0.818、0.870,表明所建定标模型能快速地预测茎秆纤维组分含量,但效果并不十分理想。由于试验中中性洗涤过程受残留杂质的影响,过滤比较困难且耗时较多,而随着中性洗涤、酸性洗涤和硫酸消化处理,影响建模准确性的杂质被彻底去除,因而ADL近红外模型精度相对较高,这与陈贤情等[33]研究结果一致。国内外关于木质素单体组分近红外模型构建的研究较少且主要集中在木本植物。ROBINSON等[23]建立白杨木质素单体近红外分析模型,其中S和G型木质素单体具有较高的预测准确性,H型木质素单体模型预测能力较差。在此基础上SUN等[24]建立硬木、软木、禾本科、豆科植物 S/G单体比例多变量化学预测模型,能够快速准确的测定木质素单体比例。本研究构建的甘蓝型油菜茎秆木质素单体G/S分析模型,内部交叉验证相关系数和外部检验相关系数分别为0.920和0.935。
上述研究结果表明茎秆纤维组分含量和木质素单体G/S近红外模型均可应用于后续的试验和分析,但要使之成为完善成熟的模型仍然需要改进。近红外光谱分析结果的准确性受多种因素影响,因此深入了解近红外光谱分析的各种影响因素,降低负影响,是今后建立近红外模型中提高效率减少误差的关键[34]。另外,试验中使用定标样品不够多,而中国油菜品种多样,不具备普遍代表性,今后工作还需不断补充不同产地和年份的材料,增加样品品种和数量,进行模型补充校正和升级优化。
4 结论
本研究运用多种光谱预处理方法、化学计量学方法及内部交叉验证,筛选出1-VR值最高和SECV值最低的最佳茎秆纤维组分含量和木质素单体G/S近红外预测的模型。其交叉验证相关系数(1-VR)分别为0.864、0.861、0.872和0.920,用验证集样品检验模型,其外部检验相关系数(RSQ)分别为 0.837、0.818、0.870和0.935,说明所建模型定标效果较好,能快速测量茎秆纤维组分含量和木质素单体 G/S,可应用于甘蓝型油菜抗病抗倒伏育种和相关性状的遗传改良。
[1] 李培武, 杨湄, 张文, 陈洪, 谢立华, 李光明, 丁小霞, 汪雪芳. 我国油菜产品质量安全现状及对策. 中国油料作物学报, 2004, 26(1):84-88.LI P W, YANG M, ZHANG W, CHEN H, XIE L H, LI G M, DING X X, WANG X F. Studies on quality of oilseed rape products and its improvement strategy in China. Chinese Journal of Oil Crop Sciences,2004, 26(1): 84-88. (in Chinese)
[2] VANHOLME R, MORREEL K, RALPH J, BOERJAN W. Lignin engineering. Current Opinion in Plant Biology, 2008, 11(3): 278-285.
[3] 杨向东. 木质素合成调控及其与甘蓝型油菜抗菌核病和抗倒伏性关系研究[D]. 武汉: 华中农业大学, 2006.YANG X D. The study on relationship between lignin biosynthesis manipulation and Brassica napus’ resistance to Sclerotinia sclerotiorum and lodging[D]. Wuhan: Huazhong Agricultural University, 2006. (in Chinese)
[4] LIU L Z, QU C M, WITTKOP B, YI B, XIAO Y, HE Y J,SNOWDON R J, LI J N. A high-density SNP map for accurate mapping of seed fibre QTL in Brassica napus L. PLoS ONE, 2013,8(12): e83052.
[5] 荆凌云. 甘蓝型油菜茎杆菌核病抗性和木质素含量、单体比例的相关性及QTL定位研究[D]. 重庆: 西南大学, 2016.JING L Y. The relationship of stem Sclerotinia sclerotiorum resistance to lignin content and monomer ratio in Brassica napus and QTL mapping[D]. Chongqing: Southwest University, 2016. (in Chinese)
[6] KOJO K H, FUJIWARA M T, ITOH R D. Involvement of AtMinE1 in plastid morphogenesis in various tissues of Arabidopsis thaliana.Bioscience Biotechnology & Biochemistry, 2009, 73(12): 2632-2639.
[7] 宋银, 武玉翠, 张媛, 王喆之. 丹参木质素及其单体含量的测定.分析科学学报, 2011, 27(5): 586-590.SONG Y, WU Y C, ZHANG Y, WANG Z Z. Determination of lignin content and lignin monomer composition in Salvia miltiorrhiza Bge.Journal of Analytical Science, 2011, 27(5): 586-590. (in Chinese)
[8] 高荣强, 范世福. 现代近红外光谱分析技术的原理及应用. 分析仪器, 2002(3): 9-12.GAO R Q, FAN S F. Principles and applications of modern near infrared spectroscopic techniques. Analytical Instrumentation, 2002(3):9-12. (in Chinese)
[9] 冯放. 现代近红外光谱分析技术及其应用. 生命科学仪器, 2007,5(10): 9-13.FENG F. Modern near infrared spectroscopy technology and application. Life Science Instruments, 2007, 5(10): 9-13. (in Chinese)
[10] LI X, SUN C, ZHOU B, HE Y. Determination of hemicellulose,cellulose and lignin in moso bamboo by near infrared spectroscopy.Scientific Reports, 2015, 5: 17210.
[11] 黄安民, 江泽慧, 李改云. 毛竹、杉木木质素的近红外光谱法快速分析. 北京林业大学学报, 2006, 28(s2): 111-114.HUANG A M, JIANG Z H, LI G Y. Rapid analysis of lignin from bamboo and Chinese fir wood by near infrared spectroscopy. Journal of Beijing Forestry University, 2006, 28(s2): 111-114. (in Chinese)
[12] BARRIÈRE Y, THOMAS J, DENOUE D. QTL mapping for lignin content, lignin monomeric composition, p-hydroxycinnamate content,and cell wall digestibility in the maize recombinant inbred line progeny F838xF286. Plant Science, 2008, 175(4): 585-595.
[13] 聂至东, 韩建国, 玉柱, 仲勇, 刘富渊. 近红外反射光谱法测定苜蓿干草主要纤维成分的研究. 光谱学与光谱分析, 2008, 28(5):1045-1048.NIE Z D, HAN J G, YU Z, ZHONG Y, LIU F Y. Determination of main fiber compositions of alfalfa hay by near infrared reflectance spectroscopy. Spectroscopy and Spectral Analysis, 2008, 28(5):1045-1048. (in Chinese)
[14] PAYNE C E, WOLFRUM E J. Rapid analysis of composition and reactivity in cellulosic biomass feedstocks with near-infrared spectroscopy. Biotechnology for Biofuels, 2015, 8(1): 43.
[15] 李传友, 郝东生, 杨立国, 熊波, 郭建业, 张莉, 高娇. 水稻小麦秸秆成分近红外光谱快速分析研究. 中国农学通报, 2014, 30(20):133-140.LI C Y, HAO D S, YANG L G, XIONG B, GUO J Y, ZHANG L, GAO J. Rapid analysis of rice and wheat straw components by near-infrared spectroscopy. Chinese Agricultural Science Bulletin, 2014, 30(20):133-140. (in Chinese)
[16] TKACHUK R. Oil and protein analysis of whole rapeseed kernels by near infrared reflectance spectroscopy. Journal of the American Oil Chemists' Society, 1981, 58(8): 819-822.
[17] PANFORD J A, WILLIAMS P C, DEMAN J M. Analysis of oilseeds for protein, oil, fiber and moisture by near-infrared reflectance spectroscopy. Journal of the American Oil Chemists' Society, 1988,65(10): 1627-1634.
[18] VELASCO L, BECKER H C. Estimating the fatty acid composition of the oil in intact-seed rapeseed (Brassica napus L.) by near-infrared reflectance spectroscopy. Euphytica, 1998, 101(2): 221-230.
[19] FONT R, DEL R M, FERNÁNDEZ J M, DE H A. Acid detergent fiber analysis in oilseed Brassicas by near-infrared spectroscopy.Journal of Agricultural & Food Chemistry, 2003, 51(10): 2917-2922.
[20] FONT R, WITTKOP B, BADANI A G, MDEL R C, FRIEDT W,LUHS W. The measurements of acid detergent fibre in rapeseed by visible and near-infrared spectroscopy. Plant Breeding, 2008, 124(4):410-412.
[21] WITTKOP B, SNOWDON R J, FRIEDT W. New NIRS calibrations for fiber fractions reveal broad genetic variation in Brassica napus seed quality. Journal of Agricultural & Food Chemistry, 2012, 60(9):2248-2256.
[22] 黄杰恒. 干旱胁迫下油菜抗倒伏相关性状动态变化及木质素关键基因表达特性分析[D]. 重庆: 西南大学, 2013.HUANG J H. Lodging resistant traits and lignin related gene analysis in B. napus under drought stress[D]. Chongqing: Southwest University,2013. (in Chinese)
[23] ROBINSON A R, MANSFIELD S D. Rapid analysis of poplar lignin monomer composition by a streamlined thioacidolysis procedure and near-infrared reflectance-based prediction modeling. Plant Journal,2009, 58(4): 706-714.
[24] SUN L, VARANASI P, YANG F, LOQUÉ D, SIMMONS B A,SINGH S. Rapid determination of syringyl: Guaiacyl ratios using FT-Raman spectroscopy. Biotechnology & Bioengineering, 2012,109(3): 647-656.
[25] VAN SOEST P J, WINE R H. Use of detergents in the analysis of fibrous feeds. IV. Determination of plant cell wall constituents.Journal of the Association of Official Analytical Chemists, 1967, 50(1):50-55.
[26] ROLANDO C, MONTIES B, LAPIERRE C. Thioacidolysis, Methods in Lignin Chemistry. Berlin Heidelberg: Springer Berlin Heidelberg,1992: 334-349.
[27] 梁晓艳, 吉海彦. 近红外光谱技术在农作物品质分析方面的应用.中国农学通报, 2006, 22(1): 366-371.LIANG X Y, JI H Y. Applications of near infrared spectroscopy technology in analyzing the quality of crops. Chinese Agricultural Science Bulletin, 2006, 22(1): 366-371. (in Chinese)
[28] 王多加, 周向阳, 金同铭, 胡祥娜, 钟娇娥, 吴启堂. 近红外光谱检测技术在农业和食品分析上的应用. 光谱学与光谱分析, 2004,24(4): 447-450.WANG D J, ZHOU X Y, JIN T M, HU X N, ZHONG J E, WU Q T.Application of near-infrared spectroscopy to agriculture and food analysis. Spectroscopy and Spectral Analysis, 2004, 24(4): 447-450.(in Chinese)
[29] 李玉, 刘勋, 李加纳, 殷家明, 徐新福. 甘蓝型油菜粒色近红外光谱分析模型构建. 中国油料作物学报, 2012, 34(5): 533-536.LI Y, LIU X, LI J N, YIN J M, XU X F. Construction of near-infrared reflectance spectroscopy model for seed color of rapeseed. Chinese Journal of Oil Crop Sciences, 2012, 34(5): 533-536. (in Chinese)
[30] 姜训鹏, 雷恒, 李海涛, 焦鹏, 张宏宇, 王博. 不同饲料原料日粮纤维水平的近红外测定方法. 农业机械学报, 2016, 47(s1):353-358.JIANG X P, LEI H, LI H T, JIAO P, ZHANG H Y, WANG B.Measurement of fiber content in different feed ingredients using near-infrared spectroscopy method. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(s1): 353-358. (in Chinese)
[31] 易英, 宋春风, 袁洪福, 谢锦春, 杜俊琪, 李效玉. 近红外漫反射光谱法测定天然纤维素浆粕聚合度. 光谱学与光谱分析, 2014,34(9): 2372-2376.YI Y, SONG C F, YUAN H F, XIE J C, DU J Q, LI X Y.Determination of degree of polymerization of natural cellulose pulp using near-infrared diffuse reflectance spectroscopy. Spectroscopy and Spectral Analysis, 2014, 34(9): 2372-2376. (in Chinese)
[32] 黄珺, 袁洪福, 宋春风, 李效玉, 谢锦春, 杜俊琪. 近红外漫反射光谱法快速测定天然纤维素清洁浆料 ɑ-纤维素含量. 光谱学与光谱分析, 2013, 33(1): 60-64.HUANG J, YUAN H F, SONG C F, LI X Y, XIE J C, DU J Q.Determination of a-cellulose content of natural cellulose pulp in a new clean pulping process using near infrared diffuse reflectance spectroscopy. Spectroscopy and Spectral Analysis, 33(1): 60-64. (in Chinese)
[33] 陈贤情, 商晋, 宋慧芳, 郭康权. 秸秆中纤维素/半纤维素和木质素的几种测定方法对比//中国农业工程学会2011年学术年会论文集.重庆, 2011.CHEN X Q, SHANG J, SONG H F, GUO K Q. A Comparison of some methods for the determination of cellulose, hemicellulose and lignin in straw//Proceedings of 2011 Annual Conference on Chinese Society of Agricultural Engineering. Chongqing, 2011. (in Chinese)
[34] 李勇, 魏益民, 王锋. 影响近红外光谱分析结果准确性的因素. 核农学报, 2005, 19(3): 236-240.LI Y, WEI Y M, WANG F. Affecting factors on the accuracy of near-infrared spectroscopy analysis. Acta Agriculturae Nucleatae Sinica, 2005, 19(3): 236-240. (in Chinese)
