曲美他嗪对急性心肌缺血再灌注损伤大鼠的治疗效果及对Bcl_2、Caspase_3蛋白表达的影响
2018-03-10朱雪梅
朱雪梅
心肌缺血再灌注损伤的发生机制比较复杂,已有的研究认为与自由基损伤、钙离子超载、心肌纤维代谢障碍、血管内皮细胞损伤、中性粒细胞和细胞凋亡等诸多因素有关[1]。分子心血管病学研究已经证实,细胞凋亡参与心肌缺血再灌注损伤过程,是心肌细胞损伤的主要形式,其发生、发展受多种基因的调控[2]。本研究探讨曲美他嗪对急性心肌缺血再灌注损伤大鼠的治疗效果及对B细胞淋巴瘤/白血病_2基因(Bcl_2)、天冬氨酸特异性半胱氨酸蛋白酶_3(Caspase_3)表达的影响,现将结果报道如下。
1 材料与方法
1.1 实验动物:选取健康成年雄性SD大鼠48只,体重250~300g,由北京大学医学部实验动物科学部提供,许可证号SCXK(京)2016_0008。将大鼠随机分为四组:假手术组、模型组、曲美他嗪低剂量组(低剂量组)和曲美他嗪高剂量组(高剂量组),每组12只。
1.2 实验方法:
1.2.1 缺血再灌注损伤模型制备:腹腔注射10%水合氯醛3ml/kg麻醉,麻醉成功后固定大鼠四肢、头部。将针型电极插入四肢皮下,记录心电图。气管插管后连接呼吸机正压通气。沿胸骨左缘第3、4肋间开胸,逐层切开皮肤、皮下组织、肌肉,剪开心包,暴露心脏。假手术组大鼠在冠状动脉左前降支只穿线、不结扎;对模型组、低剂量组和高剂量组大鼠制备急性心肌缺血再灌注损伤模型,结扎冠状动脉左前降支,在肺动脉圆锥和左心耳连线中点下方约2mm处将缝合针穿过冠状动脉左前降支深部,在肺动脉圆锥旁出针,将一根直径1.5mm的凹槽硅胶管置于结扎线与血管之间,拉紧结扎线,使硅胶管压迫冠状动脉左前降支而致闭塞。保持缺血状态30min后松开,再灌注2h。在缺血30min时低剂量组给予10mg/kg曲美他嗪灌胃,高剂量组给予20mg/kg曲美他嗪灌胃。假手术组和模型组均给予等体积生理盐水灌胃。以心电图ST段抬高≥0.3mV和(或)T波高耸、局部心肌出现紫绀作为心肌缺血标志;心电图ST段降低和(或)T波恢复、心肌缺血区转红为再灌注成功标志。
1.2.2 免疫组化检测:取心尖部心肌组织采用生理盐水冲洗,4%多聚甲醛固定24h,石蜡包埋,制成5μm切片。经二甲苯、100%乙醇、75%乙醇梯度脱水后用蒸馏水洗。苏木素染色,自来水冲洗,盐酸乙醇分化。自来水浸泡后置入伊红液。经95%乙醇、100%乙醇、二甲苯脱水后中性树胶封固,显微镜下观察。
1.2.3 细胞凋亡检测:采用原位细胞凋亡检测(TUNEL)试剂盒检测细胞凋亡,切片常规脱蜡,滴加30ml/L的H202,室温处理10min。切片加5μl/ml的蛋白酶K、37℃消化15min。加标记缓冲液,按每张切片取末端脱氧核糖核酸转移酶和DIG_d_UTP,加入标记缓冲液中,混匀。甩去切片上多余液体后加标记液。37℃标记2h。室温加封闭液30min。滴加生物素化抗地高辛抗体,37℃反应30min。滴加试剂SABC,37℃反应60min。DAB显色。苏木素轻度复染,酒精脱水,二甲苯透明,中性树酯封片。显微镜下观察。阳性对照采用试剂公司附带切片;阴性对照以PBS代替标记液,其余步骤相同。
1.2.4 HE染色观察:采用HE染色法分别进行Bcl_2、Caspase_3蛋白染色,将切片放置于预先用多聚赖氨酸处理的载玻片上,70℃烤片2h。脱蜡前再次烤片15min。切片常规脱蜡,热修复抗原:高压锅加热至270℃沸腾后,将切片浸入0.01mol/L枸橼酸盐缓冲液(pH6.0)中,喷气后调至140℃ 2min。滴加3%的H2O2,室温反应15min,灭活内源性酶。滴加50g/L牛血清白蛋白封闭液,室温反应15min。分别滴加一抗、结合抗原,4℃过夜。室温静置2h,滴加生物素化山羊抗兔IgG,室温孵育30min。滴加SABC,20℃ 30min。DAB显色。苏木素轻度复染。脱水、透明、中性树胶封片。显微镜下观察,以试剂盒中自带阳性对照片为阳性对照;阴性对照采用PBS代替一抗,其余步骤相同。
1.2.5 心肌酶检测:造模成功后,经腹主动脉采血2ml,4℃、3000r/min离心15min,取上层血清冻存于-80℃冰箱保存待测。统一采用日立7060型全自动生化分析仪测定心肌酶CK、LDH含量。
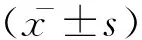
2 结果
2.1 各组心肌HE染色观察:假手术组大鼠心肌纤维排列整齐,胞核清晰可见,胞浆着色均匀;模型组大鼠心肌细胞核浓缩,细胞空泡变性,心肌纤维排列紊乱,有大量炎性细胞浸润;低剂量组大鼠心肌纤维排列仍较紊乱,细胞间质轻中度水肿,可见少量炎性细胞浸润;高剂量组大鼠心肌纤维排列正常,细胞间质轻度水肿,图1见封3。
2.2 各组心肌酶CK、LDH比较:模型组、低剂量组和高剂量组CK和LDH明显高于假手术组(P<0.05),见表1。

表1 各组心肌酶CK、LDH、AI值比较
注:与假手术组比较*P<0.05;与模型组比较△P<0.05;与低剂量组比较#P<0.05
2.3 各组心肌细胞凋亡情况:假手术组心肌可偶见细胞凋亡;模型组心肌细胞凋亡明显增多,呈弥漫分布;低剂量组心肌凋亡有所减少,而高剂量组心肌凋亡明显减少,图2见封3。模型组、低剂量组和高剂量组AI值明显高于假手术组(P<0.05),见表1。
2.4 各组Bcl_2、Caspase_3蛋白表达情况:模型组、低剂量组和高剂量组Caspase_2蛋白表达灰度值明显高于假手术组,而Bcl_2蛋白表达灰度值明显低于假手术组(P<0.05),见表2,图3见封3。

表2 各组Bcl_2、Caspase_3蛋白表达灰度值比较
注:与假手术组比较*P<0.05;与模型组比较△P<0.05;与低剂量组比较#P<0.05
3 讨论
缺血性心脏病是严重危害中老年人身体健康和生命安全的心血管疾病,随着我国社会人口老龄化进程,急性心肌梗死已成为缺血性心脏病患者死亡的首要原因,对急性心肌梗死的主要治疗目标是促进冠状动脉再通、恢复局部血供[3]。但近年来大量研究发现,缺血心肌再灌注后可能导致心律失常、心肌顿抑、无复流、甚至猝死等一系列再灌注损伤[4]。如何预防和治疗缺血再灌注损伤是目前临床研究的热点。
SD大鼠在进化学关系上与人类接近,两者的遗传基因相似率高达90%。大鼠的冠状动脉侧支循环少,发生缺血性损伤后早期即可出现心肌坏死、心律失常,并具有良好的重复性和稳定性[5]。左冠状动脉前降支是大鼠左心供血的主要血管,因此本研究通过结扎左冠状动脉前降支复制心肌缺血再灌注损伤模型。本研究中与假手术组相比,模型组、低剂量组和高剂量组大鼠心肌组织均发生不同程度梗死,提示缺血再灌注模型制备成功。
目前对于缺血心肌再灌注损伤的发生机制尚未完全阐明,大多数学者认为细胞凋亡在心肌缺血再灌注损伤的病理过程中具有重要作用,心肌细胞凋亡可影响心肌梗死面积、加速心脏结构重构等,而再灌注损伤也会引起心肌细胞凋亡,尤其是梗死灶的收缩带区域,导致细胞缩小、胞质凝缩、核膜崩解、胞浆空泡变等病理改变[6]。有研究发现,持续的缺血和缺血后再灌注的心肌均可引起细胞凋亡,尽管再灌注可阻止心肌坏死,但却不能阻止已坏死的心肌细胞发生凋亡[7]。曲美他嗪是一种抗心绞痛类药物,通过保护细胞在缺血缺氧状态下的能量代谢、维持细胞内环境稳定而发挥疗效[8]。本文假手术组心肌组织未见明显改变,模型组心肌纤维排列紊乱,细胞严重水肿,低剂量组和高剂量组心肌细胞肿胀减轻,这一结果提示,持续的缺血和缺血后再灌注可引起心肌细胞水肿、凋亡,而曲美他嗪可有效逆转心肌损伤和细胞凋亡。
心肌细胞内的LDH、CK、CK_MB、AST是广泛存在于细胞浆中的酶类,其中CK、LDH是心肌胞浆中的特异性酶[9]。当缺血再灌注损伤引起细胞膜、线粒体损伤、细胞膜通透性增加时,心肌细胞内的各种酶类释放入血,因此血清酶学指标水平可间接反映心肌细胞的损伤程度[10]。其中CK、LDH可作为评估心肌损伤程度、心肌梗死范围的定量指标[11]。本研究中高剂量组CK、LDH和AI值均明显低于低剂量组和模型组,这一结果提示,曲美他嗪可有效减轻心肌损伤程度、缩小梗死范围,其对心肌的保护作用与剂量有关,高剂量下心肌保护作用更强。
Bcl_2、Caspase_3是与细胞凋亡密切相关的蛋白[12]。Bcl_2基因也称为抗凋亡蛋白,是目前公认的与细胞凋亡密切相关的基因[13]。心肌缺血再灌注损伤时,心肌细胞Bcl_2基因表达下调,使蛋白线粒体膜的通透性发生改变,细胞色素C释放入胞浆中,激活Caspase_3而诱发细胞凋亡[14]。Caspase_3的底物是多聚ADP核糖聚合酶,具有促进细胞凋亡的作用[15]。本研究中模型组、低剂量组和高剂量组
Caspase_2蛋白表达灰度值明显高于假手术组,而Bcl_2蛋白表达灰度值明显低于假手术组;高剂量组Caspase_2蛋白表达灰度值明显低于低剂量组和模型组,而Bcl_2蛋白表达灰度值明显高于低剂量组和模型组。这一结果提示,曲美他嗪对急性心肌缺血再灌注损伤大鼠心肌细胞凋亡的抑制作用是通过上调Bcl_2蛋白表达,下调Caspase_2蛋白表达实现的。
综上所述,高剂量曲美他嗪能抑制急性心肌缺血再灌注损伤大鼠心肌细胞凋亡,与其上调Bcl_2蛋白表达,下调Caspase_2蛋白表达有关。
[1]徐盟.心肌缺血再灌注损伤的主要机制与相关药物治疗的研究进展[J].实用药物与临床,2014,17(8):1052-1056.
[2]高妮妮,王芳,廉哲勋,等.PI3K_Akt_eNOS信号通路在三磷酸腺苷后处理减轻兔心肌缺血再灌注损伤中的作用[J].中国循环杂志,2014,29(1):59-63.
[3]乔钰惠,孟增慧,郭丽君,等.心肌缺血再灌注损伤的机制和治疗[J].基础医学与临床,2015,35(12):1666-1671.
[4]位凯,王飞,张瑾,等.天麻素预处理减轻大鼠心肌缺血再灌注损伤的可能机制[J].安徽医科大学学报,2014,6(6):756-758,841.
[5]郭明,赵博,雷少青,等.Sestrin2/一磷酸腺苷活化的蛋白激酶介导的细胞自噬在糖尿病大鼠心肌缺血再灌注损伤中的作用及叔丁基对苯二酚预处理的保护作用[J].中华糖尿病杂志,2017,9(6):382-387.
[6]王富华,刘雪静,王欢,等.神经调节蛋白_1对心肌缺血再灌注损伤的保护作用[J].生理科学进展,2016,47(3):223-226.
[7]刘家袁,梁贵友,王红阳,等.腺苷酸活化蛋白激酶与心肌缺血再灌注损伤的研究进展[J].山东医药,2017,57(17):93-95.
[8]文冰,韩辉,焦周阳,等.曲美他嗪抗大鼠心肌缺血再灌注损伤中炎性反应的研究[J].中华实验外科杂志,2014,31(3):597-599.
[9]周大亮,于熙滢,耿硕,等.曲美他嗪后处理对大鼠心肌缺血再灌注损伤的保护性研究[J].中华老年心脑血管病杂志,2014,16(4):421-424.
[10]王婷,毕莹,陈泽富,等.曲美他嗪对小鼠急性心肌缺血再灌注损伤的保护作用[J].中华实用诊断与治疗杂志,2017,31(5):427-430.
[11]张权,赵学忠,郝守艳,等.曲美他嗪后处理对大鼠急性缺血再灌注损伤中心肌细胞凋亡的影响[J].中华老年医学杂志,2014,33(2):201-204.
[12]Pisarenko OI, Lankin VZ, Konovalova GG, et al. Apelin_12 and its structural analog enhance antioxidant defense in experimental myocardial ischemia and reperfusion[J]. Molecular and Cellular Biochemistry: An International Journal for Chemical Biology,2014,391(1/2):241-250.
[13]Ong SB, Samangouei P, Kalkboran SH, et al. The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury[J]. J Mol Cell Cardiol,2015,25(78):23-34.
[14]刘丽凤,王禹.细胞程序性死亡与心肌再灌注损伤的研究进[J].中华老年心脑血管病杂志,2015,17(5):549-550.
[15]于丽芳,周大亮,耿硕,等.曲美他嗪对心肌缺血再灌注损伤后大鼠Bcl_2及caspase_3蛋白表达影响[J].中华实用诊断与治疗杂志,2015,29(9):855-857,861.
